ω-3多不飽和脂肪酸單藥或聯合用藥逆轉多發性骨髓瘤耐藥性及細胞凋亡的機制研究
石微房德芳趙永剛
·基礎研究·
ω-3多不飽和脂肪酸單藥或聯合用藥逆轉多發性骨髓瘤耐藥性及細胞凋亡的機制研究
石微①房德芳①趙永剛②
目的:探討ω-3多不飽和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFA)單藥或聯合糖皮質激素地塞米松(dexamethasone,DEX)逆轉多發性骨髓瘤(multiple myeloma,MM)耐藥性及誘導細胞凋亡的作用及其機制。方法:采用不同濃度的兩種ω-3 PUFA,二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)單藥處理,或與DEX聯合處理DEX耐藥細胞系MM1R在24 h或48 h后,采用MTT法檢測細胞的增殖,流式細胞術檢測細胞周期的細胞凋亡,Western blot檢測相關凋亡蛋白的表達水平。分析方法采用兩樣本間t檢驗,以P<0.05為差異具有統計學意義。結果:不同濃度EPA或DHA(10、20、50、100 μM),及50 μM EPA或DHA與10 μM DEX聯合處理均能夠抑制MM1R細胞的增殖,且呈劑量和時間依賴性,聯合組抑制效果較EPA(50 μM)或DHA(50 μM)單藥組更明顯(P=0.014,0.032)。不同濃度EPA或DHA作用MM1R細胞48 h后,隨著藥物濃度增加,G0/G1期細胞逐漸增加,S期和G2期細胞逐漸減少,細胞凋亡率逐漸升高,細胞阻滯在G0/G1期;而兩藥聯合組與EPA(50 μM)或DHA(50 μM)單藥處理組相比,細胞阻滯和細胞凋亡率更加明顯(P=0.015,0.004);凋亡相關Cleaved caspase-3、Bax蛋白水平逐漸升高,Pro-caspase-3、BCL-2蛋白水平逐漸降低,且呈劑量依賴性。不同濃度EPA或DHA作用MM1R細胞,隨藥物濃度增加,耐藥倍數逐漸下降,逆轉倍數逐漸上升,而兩藥聯合組較單藥組細胞耐藥倍數下降及逆轉倍數上升更明顯。結論:ω-3 PUFA能夠抑制DEX耐藥MM細胞增殖,阻滯細胞周期,誘導細胞凋亡,與DEX聯合應用對抑制MM細胞增殖、誘導細胞凋亡具有協同作用,是一種新型且有效的逆轉MM耐藥的治療藥物。
ω-3多不飽和脂肪酸多發性骨髓瘤地塞米松耐藥
多發性骨髓瘤(multiple myeloma,MM)是一種起源于漿細胞的惡性腫瘤。近年來新型化療藥物的應用使MM的治療取得長足進展,但是患者的預后仍較差。耐藥是MM難治、復發的原因之一[1]。MM細胞異質性強,基因組高度不穩定,生長增殖高度依賴骨髓微環境,是耐藥細胞出現和存在的主要原因[1]。ω-3多不飽和脂肪酸(ω-3 polyunsaturated fatty acid,ω-3 PUFA)為人體必需脂肪酸,是細胞膜的組成成分,參與基因表達、生長發育等多種生理活動[2]。ω-3 PUFA包括二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)。研究表明ω-3 PUFA可通過影響某些基因轉錄,抑制細胞增殖、阻滯細胞周期及誘導細胞凋亡,從而發揮抗腫瘤作用[3]。地塞米松(dexamethasone,DEX)作為糖皮質激素的一種衍生物,被廣泛應用于MM的臨床治療。目前國內外尚無ω-3 PUFA對MM的影響以及對糖皮質激素耐藥改善情況的報道。本研究將EPA和DHA單藥或與地塞米松聯合作用于MM耐藥細胞系,觀察其對MM細胞生長的影響,為ω-3 PUFA用于治療MM提供理論依據。
1 材料與方法
1.1 材料
對DEX耐藥的人MM細胞株MM1R由本研究實驗室長期保存,實驗前從液氮取出,常規快速復蘇后傳代培養。RPMI-1640培養基和胎牛血清(均購自美國Gibco公司);EPA、DHA和DEX(均購自美國Sigma公司);MTT試劑盒(購自日本同仁化學研究所);細胞周期檢測試劑盒、流式凋亡檢測試劑盒(購自南京凱基公司);Cleaved caspase-3抗體、Pro-caspase-3抗體、BCL-2抗體、Bax抗體、GAPDH抗體(均購自美國Abcam公司);蛋白裂解液、BCA蛋白濃度測定試劑盒、ECL化學發光試劑盒(均購自上海碧云天生物技術有限公司)。
1.2 方法
1.2.1 細胞培養MM1R細胞常規培養于含10%胎牛血清、100 U/mL青霉素、100 U/mL鏈霉素的RPMI-1640培養基中,置于37℃、5%CO2飽和濕度下培養,每2~3 d換液傳代1次,取對數生長期細胞用于實驗。
1.2.2 藥物濃度設定根據既往文獻報道及預實驗結果,用二甲基亞砜配置濃度為10 mM的DEX儲備液,然后用RPMI-1640培養基稀釋至10 μM工作液。用無水乙醇配置濃度為100 mM的EPA和DHA儲備液,然后用RPMI-1640培養基稀釋,EPA和DHA工作濃度梯度為:10、20、50、100 μM。聯合加藥組中先加入50 μM的EPA或DHA培養12 h,再加入10 μM DEX培養24 h進行相關實驗。
1.2.3 MTT法檢測細胞增殖收集對數生長期的MM1R細胞,以0.25%胰酶消化后制成細胞懸液,調整細胞濃度為1×105/mL,接種于96孔培養板中,200 μL/孔,每種濃度5個復孔,37℃、5%CO2飽和濕度條件下培養24 h,待細胞貼壁后,加入不同濃度的藥物,分別處理24、48 h,吸去各孔培養液,換無血清培養液200 μL/孔,并加入20 μL/孔MTT(5 mg/mL),繼續培養4 h;吸盡各孔培養液,加入二甲基亞砜(DMSO)200 μL/孔,振蕩器上振蕩溶解5~10 min,以空白對照調零,用自動酶標讀數儀讀取各組吸光度(A)值,檢測波長為492 nm。細胞增殖抑制率(%)=(A對照組-A實驗組)/(A對照組-A空白組)×100%。實驗重復3次,取平均值為最終結果。
1.2.4 流式細胞術檢測細胞周期和凋亡細胞處理方法同上;培養48 h后收集各組細胞,用4℃預冷的PBS洗細胞2次,1 000 r/min離心5 min。取l×105個細胞,加入4℃預冷的70%乙醇固定6 h。用4℃預冷的PBS洗細胞2次,1 000 r/min離心5 min。。將細胞重懸于100 μL PBS中,加入5 μL碘化丙錠(propidium iodide,PI),混勻后室溫避光反應15 min,加入300 μL PBS,立即上流式細胞儀(BD FASC Calibur)檢測。另取1×105個細胞,用100 μL結合緩沖液重新懸浮細胞,加入5 μL AnnexinnV-FITC和5 μL PI,混勻后于室溫避光孵育15 min。加入400 μL結合緩沖液,立即上流式細胞儀分析。采用Modifit 1.0軟件分析細胞周期分布,采用CellQuest Pro軟件分析細胞凋亡,結果判斷:活細胞(Annexin-V-/PI-),早期凋亡細胞(Annexin-V+/PI-),晚期凋亡細胞(Annexin-V+/ PI+),細胞總凋亡=早期凋亡細胞+晚期凋亡細胞。實驗重復3次,取平均值為最終結果。
1.2.5 測定EPA和DHA單藥或與地塞米松聯合作用對MM細胞耐藥及逆轉倍數的影響細胞處理方法同上;取指數生長期細胞用胰酶消化后用培養液制成單細胞懸液,細胞計數后,以每孔6 000個細胞接種到96孔板上,每孔體積100 μL。細胞貼壁后,用細胞培養液配制不同濃度梯度的藥物培養細胞,對照孔細胞用普通培養基培養。48 h后,每孔加入20 μL MTT溶液(5 mg/mL),繼續培養4 h。以空白孔調零,全自動酶標儀于570 nm處測定各孔吸光值(OD值),參比波長為630 nm。實驗重復3次,取平均值。抑制率=(1-實驗組OD/對照組OD)×100%。采用直線回歸方程計算出生長抑制率50%時的藥物濃度即為半數抑制濃度(IC50)。耐藥倍數=耐藥細胞IC50/敏感細胞IC50;逆轉倍數(RF)=藥物IC50(不加逆轉劑)/藥物IC50(加逆轉劑)。
1.2.6 Western blot檢測蛋白表達水平細胞處理方法同上;培養24 h后收集各組細胞,用蛋白裂解液裂解細胞后,離心去細胞碎片,取上清液,BCA法定量細胞總蛋白,各組取20 μg總蛋白進行12%SDSPAGE,并轉印到PVDF膜上,用1%牛血清白蛋白(BSA)和0.05%Tween 20封閉非特異性抗原后,一抗4℃溫育過夜。次日TBST洗膜后,二抗1∶5 000稀釋,37℃溫育1 h,TBST洗膜后ECL熒光顯色。蛋白質條帶用掃描儀進行掃描,以GAPDH條帶作為參照,應用Imagaquent 5.1軟件對蛋白質條帶灰度進行相對定量分析。以目的蛋白條帶與GAPDH灰度比值表示蛋白相對表達水平。實驗重復3次,取平均值為最終結果。
1.3 統計學分析
采用SPSS 16.0軟件進行統計學分析,所有數據均采用±s表示,分析方法采用兩樣本間t檢驗。以P<0.05為差異具有統計學意義。
2 結果
2.1 EPA和DHA單藥或與地塞米松聯合作用對MM細胞增殖的影響
MTT法檢測細胞增殖結果顯示,EPA和DHA單藥或與DEX聯合均對MM1R細胞的增殖有抑制作用;同一時間點不同濃度的EPA或DHA對MM1R的增殖抑制率,差異均具有統計學意義(均P<0.05);同一濃度不同時間EPA或DHA對MM1R的增殖抑制率,差異均具有統計學意義(均P<0.05);兩藥聯合組較單藥組對細胞抑制作用更強,差異均具有統計學意義(均P<0.05)。結果見表1,2。
表1 EPA單藥或與地塞米松聯合作用對MM細胞增殖的影響(±s)Table 1Effects of EPA alone or in combination with dexamethasone on MM cell proliferation±s)
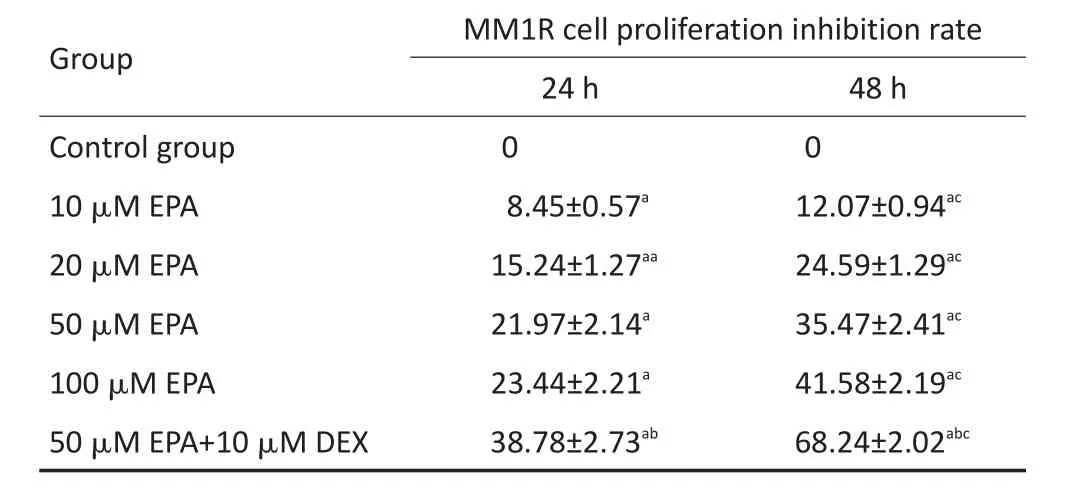
表1 EPA單藥或與地塞米松聯合作用對MM細胞增殖的影響(±s)Table 1Effects of EPA alone or in combination with dexamethasone on MM cell proliferation±s)
a.Compared with control group,P<0.05;b.compared with 50 μM EPA group,P<0.05;c.compared with 24 h,P<0.05
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+10 μM DEX MM1R cell proliferation inhibition rate 24 h 0 8.45±0.57a15.24±1.27aa21.97±2.14a23.44±2.21a38.78±2.73ab48 h 0 12.07±0.94ac24.59±1.29ac35.47±2.41ac41.58±2.19ac68.24±2.02abc
表2 DHA單藥或與地塞米松聯合作用對MM細胞增殖的影響(±s)Table 2Effects of DHA alone or in combination with dexamethasone on MM cell proliferation(±s)
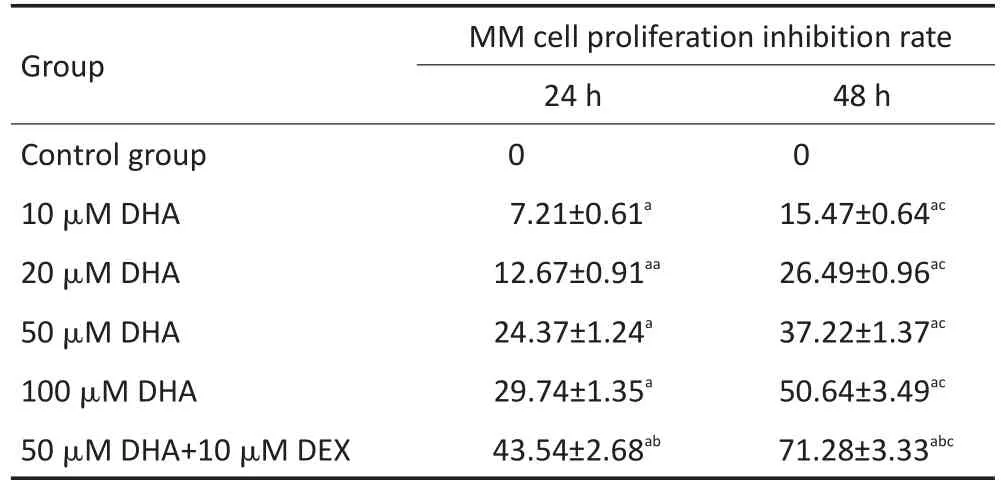
表2 DHA單藥或與地塞米松聯合作用對MM細胞增殖的影響(±s)Table 2Effects of DHA alone or in combination with dexamethasone on MM cell proliferation(±s)
a.Compared with control group,P<0.05;b.compared with 50 μM EPA group,P<0.05;c.compared with 24 h,P<0.05
Group Control group 10 μM DHA 20 μM DHA 50 μM DHA 100 μM DHA 50 μM DHA+10 μM DEX MM cell proliferation inhibition rate 24 h 0 7.21±0.61a12.67±0.91aa24.37±1.24a29.74±1.35a43.54±2.68ab48 h 0 15.47±0.64ac26.49±0.96ac37.22±1.37ac50.64±3.49ac71.28±3.33abc
表3 EPA單藥或與地塞米松聯合作用對MM細胞周期的影響(±s)Table 3Effects of EPA alone or in combination with dexamethasone on the cell cycle of MM(±s)
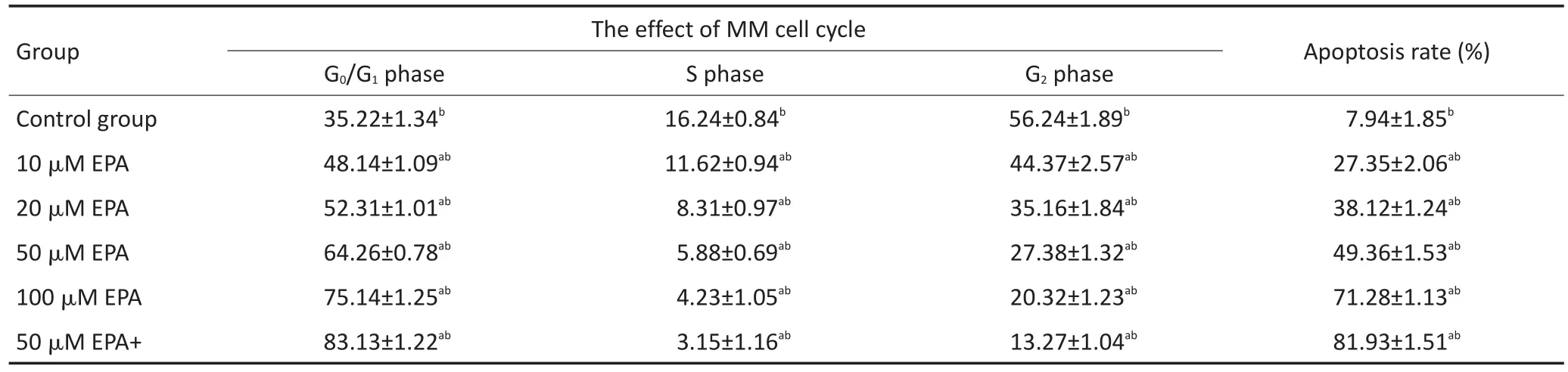
表3 EPA單藥或與地塞米松聯合作用對MM細胞周期的影響(±s)Table 3Effects of EPA alone or in combination with dexamethasone on the cell cycle of MM(±s)
Total variance analysis,significant level α=0.05.Multiple comparison,adjusting the significance level by comparing the number of times K,α'=0.05/K. Comparisonbetweenthetwogroups,usingLSDmethodandHSDmethod.a.Comparedwiththeblankgroup,therewasstatisticaldifference;b.therewas statisticaldifferencebetweenarbitrarilytwogroups
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+ The effect of MM cell cycle G0/G1phase 35.22±1.34b48.14±1.09ab52.31±1.01ab64.26±0.78ab75.14±1.25ab83.13±1.22abS phase 16.24±0.84b11.62±0.94ab8.31±0.97ab5.88±0.69ab4.23±1.05ab3.15±1.16abG2phase 56.24±1.89b44.37±2.57ab35.16±1.84ab27.38±1.32ab20.32±1.23ab13.27±1.04abApoptosis rate(%) 7.94±1.85b27.35±2.06ab38.12±1.24ab49.36±1.53ab71.28±1.13ab81.93±1.51ab
2.2 EPA和DHA單藥或與地塞米松聯合作用對MM細胞周期的影響
不同濃度EPA或DHA作用MM1R細胞48 h后,隨著藥物濃度增加,G0/G1期細胞逐漸增加,S期和G2期細胞逐漸減少,細胞阻滯在G0/G1期。而兩藥聯合組較單藥組細胞阻滯更明顯(均P<0.05)。結果見表3,4。
2.3 EPA和DHA單藥或與地塞米松聯合作用對MM細胞凋亡的影響
不同濃度EPA或DHA作用MM1R細胞48 h后,隨著藥物濃度增加,細胞凋亡率逐漸增加,而兩藥聯合組較單藥組細胞凋亡增加更明顯(均P<0.05)。結果見表3,4。
2.4 EPA和DHA單藥或與地塞米松聯合作用對MM細胞耐藥及逆轉倍數的影響
不同濃度EPA或DHA作用MM1R細胞,隨藥物濃度增加,耐藥倍數逐漸下降,逆轉倍數逐漸上升,而兩藥聯合組較單藥組細胞耐藥倍數下降及逆轉倍數上升更明顯。結果見表5,6。
表4 DHA單藥或與地塞米松聯合作用對MM細胞周期的影響(±s)Table 4Effects of DHA alone or in combination with dexamethasone on the cell cycle of MM(±s)
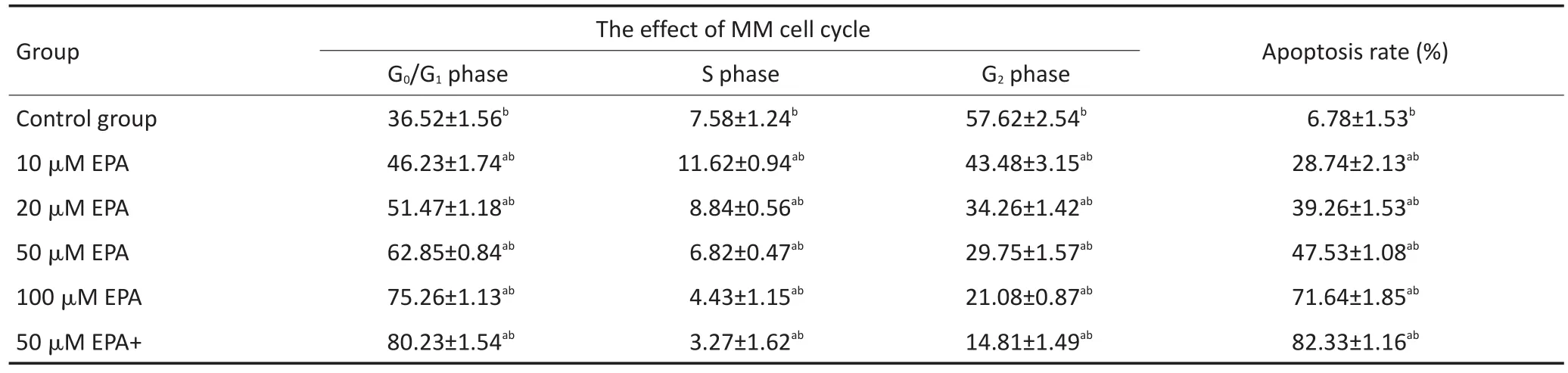
表4 DHA單藥或與地塞米松聯合作用對MM細胞周期的影響(±s)Table 4Effects of DHA alone or in combination with dexamethasone on the cell cycle of MM(±s)
Total variance analysis,significant level α=0.05.Multiple comparison,adjusting the significance level by comparing the number of times K,α'=0.05/K. Comparison between the two groups,using LSD method and HSD method.a.Compared with the blank group,there was statistical difference;b.there wasstatisticaldifferencebetweenarbitrarilytwogroups
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+ The effect of MM cell cycle G0/G1phase 36.52±1.56b46.23±1.74ab51.47±1.18ab62.85±0.84ab75.26±1.13ab80.23±1.54abS phase 7.58±1.24b11.62±0.94ab8.84±0.56ab6.82±0.47ab4.43±1.15ab3.27±1.62abG2phase 57.62±2.54b43.48±3.15ab34.26±1.42ab29.75±1.57ab21.08±0.87ab14.81±1.49abApoptosis rate(%) 6.78±1.53b28.74±2.13ab39.26±1.53ab47.53±1.08ab71.64±1.85ab82.33±1.16ab
表5 EPA單藥或與地塞米松聯合作用對MM細胞耐藥、逆轉及增敏倍數的影響(±s)Table 5Effects of EPA alone or in combination with dexamethasone on drug resistance,reversal,and enhancement of MM cells(±s)

表5 EPA單藥或與地塞米松聯合作用對MM細胞耐藥、逆轉及增敏倍數的影響(±s)Table 5Effects of EPA alone or in combination with dexamethasone on drug resistance,reversal,and enhancement of MM cells(±s)
a.Compared with the control group,there were significant differences;b.there were significant differences between the two groups in any group
Group Control group 10 μM EPA 20 μM EPA 50 μM EPA 100 μM EPA 50 μM EPA+10 μM DEX IC50 μmol/L 21.22±0.87b19.28±1.53ab15.67±1.65ab13.42±1.08ab9.47±1.14ab3.78±0.91abMultidrug resistance 4.86 3.57 2.76 2.19 1.45 0.49 Reversal index 0 1.15 1.79 2.58 3.76 4.89
表6 DHA單藥或與地塞米松聯合作用對MM細胞耐藥倍數及逆轉倍數的影響(±s)Table 6Effects of DHA alone or in combination with dexamethasone on drug resistance and enhancement of MM cells(±s)

表6 DHA單藥或與地塞米松聯合作用對MM細胞耐藥倍數及逆轉倍數的影響(±s)Table 6Effects of DHA alone or in combination with dexamethasone on drug resistance and enhancement of MM cells(±s)
Adjusting the significance level by comparing the number of times K,α'=0.05/K.Comparison between the two groups,using LSD method and HSD method.a.Compared with the blank group,there was statistical difference;b.there was statistical difference between arbitrarily two groups
Group Control group 10 μM DHA 20 μM DHA 50 μM DHA 100 μM DHA 50 μM DHA+10 μM DEX IC50μmol/L 22.38±1.85b18.76±1.63ab14.36±1.36ab12.42±1.57ab7.13±0.82ab4.57±0.81abMultidrug resistance 5.34 3.72 2.69 2.07 1.38 0.58 Reversal index 0 1.24 1.48 2.37 3.86 5.17
2.5 EPA和DHA單藥或與地塞米松聯合作用對MM細胞凋亡相關蛋白表達的影響
不同濃度EPA或DHA作用MM1R細胞24 h后,隨著藥物濃度增加,凋亡相關Cleaved caspase-3、Bax蛋白水平逐漸增加,Pro-caspase-3、BCL-2蛋白水平逐漸減少,且呈劑量依賴性。兩藥聯合組Cleaved caspase-3、Bax蛋白水平上調更明顯,而Pro-caspase-3、BCL-2蛋白水平下調更明顯(均P<0.05),結果見圖1~3。
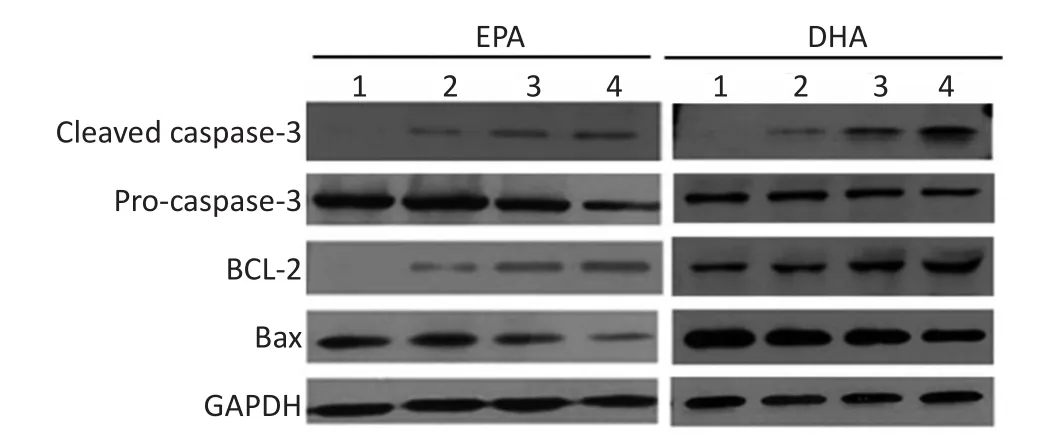
1.Control group;2.20 μM EPA or DHA;3.50 μM EPA or DHA;4.50 μM EPA or DHA+10 μM DEX圖1Western blot檢測凋亡相關蛋白表達水平Figure 1Detection of the expression level of apoptosis-related proteins

圖2 EPA單藥或與地塞米松聯合作用對MM細胞凋亡相關蛋白表達的影響Figure 2Effect of EPA alone or in combination with dexamethasone on the expression of apoptosis-related proteins in MM cells
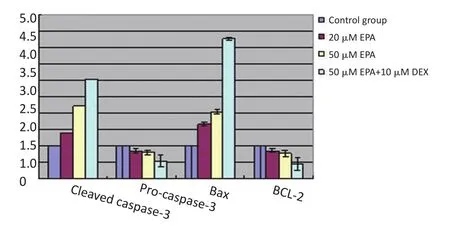
圖3 DHA單藥或與地塞米松聯合作用對MM細胞凋亡相關蛋白表達的影響Figure 3Effect of DHA alone or in combination with dexamethasone on the expression of apoptosis-related proteins in MM cells
3 討論
糖皮質激素是治療MM的一線藥物,是聯合化療方案中不可缺少的藥物。在化療過程中,不同MM患者對激素的反應差異較大,部分MM患者即使加大激素劑量仍表現為反應差甚至無反應,這種現象稱為糖皮質激素抵抗(glucocorticoid resistance,GCR)[4]。GCR導致化療無效或出現藥物嚴重不良反應,這是MM治療的難點。因此,如果能夠減少化療藥物的用量而降低化療藥物的不良反應顯得尤為重要。ω-3 PUFA與腫瘤的關系為:1)進展期腫瘤患者血ω-3 PUFA濃度降低;2)抗腫瘤治療期間補充ω-3 PUFA可以提高治療反應并改善患者生存質量;3)ω-3 PUFA在提高抗腫瘤治療的療效及減輕化療不良反應等方面起到重要作用[5-6]。如果EPA或DHA對MM細胞有抑制和殺傷作用,或有改善MM細胞GCR的作用,這在MM的治療領域將具有非常誘人的前景。
本研究結果發現,EPA和DHA單藥對DEX耐藥的MM細胞株MM1R的生長均有顯著的抑制作用,隨著劑量的增加和作用時間的延長,抑制效果越發顯著,呈濃度梯度和時間梯度依賴性,表明ω-3 PUFA對耐藥的MM細胞增殖起作用。同時聯合ω-3 PUFA與DEX來觀察兩者的協同作用,顯示采用50 μM ω-3 PUFA與10 μM DEX聯合產生的細胞增殖抑制效果均較EPA和DHA單藥產生的抑制效果強,且聯合組的抑制效果也呈時間梯度依賴性。不同濃度EPA或DHA作用MM1R細胞,隨藥物濃度增加,耐藥倍數逐漸下降,逆轉倍數逐漸上升,而兩藥聯合組較單藥組細胞耐藥倍數下降及逆轉倍數上升更明顯。充分表明ω-3 PUFA與DEX聯合具有協同作用,能夠發揮更大的腫瘤殺傷效果,微摩爾濃度的ω-3 PUFA能對耐藥MM細胞產生明顯的抑制作用,表明ω-3 PUFA是高效、低劑量毒性的抗MM藥物,并且能夠改善MM細胞的GCR作用。ω-3 PUFA的增強化療敏感性在臨床實體腫瘤中也獲得研究和證實。Serini等[7]研究發現ω-3 PUFA通過調控基因表達遺傳和M2巨噬細胞極性化改善大腸炎性反應和腫瘤的發生發展。在動物水平上,Chen等[8]研究發現,飲食內源性的ω-3 PUFA,無論是在體外還是體內,均有預防乳腺癌發生、腫瘤生長和轉移的作用。Abdi等[9]研究結果表明EPA和DHA能誘導骨髓瘤細胞凋亡,增加硼替佐米對MM細胞的敏感性,而正常人外周血單個核細胞的活性不受影響。Fahrmann等[10]對B細胞性慢性淋巴細胞白血病細胞系EHEB和MEC-2、B細胞性幼淋巴細胞白血病細胞系JVM-2進行體外培養,判斷在有無PUFA的情況下對化療藥物阿霉素、長春新堿或氟達拉濱的敏感性,結果提示EPA和DHA能通過G2/M阻滯、脂質過氧化作用誘導細胞凋亡,增加上述化療藥物的敏感性,ω-3 PUFA可能是慢性淋巴細胞白血病有效的化療增敏劑。因此,上述研究和本研究結果均證實ω-3 PUFA具有改善激素耐藥、增加化療敏感性的作用,具有良好的臨床應用前景。ω-3 PUFA可能通過以下幾個方面發揮其抗腫瘤作用:1)ω-3 PUFA可以摻入膜磷脂層影響膜相關信號轉導。可能關聯的信號轉導途徑有Ras、PI3K/Akt、HER-2/neu途徑等;2)脂質過氧化作用:ω-3 PUFA的脂質過氧化作用的產物可抑制腫瘤細胞DNA合成、細胞分裂及生長,誘導凋亡;3)抑制NF-κB信號轉導通路:NF-κB是重要的核轉錄因子,激活后可調控多種基因表達,參與炎性反應、免疫應答以及細胞的增殖、分化、凋亡等生物學過程;4)改變腫瘤細胞膜通透性,增加抗腫瘤藥物的攝入;5)作用于細胞凋亡相關因子,誘導腫瘤細胞凋亡。ω-3 PUFA影響腫瘤的機制非常復雜,是作用于多個靶點發揮效果。本研究發現EPA和DHA單藥或與DEX聯合應用能夠使MM1R細胞的細胞周期阻滯在G0/G1期,且隨著藥物劑量和作用時間的增加,阻滯效果逐漸明顯,呈劑量依賴性。表明ω-3 PUFA作用的敏感點在細胞周期的早期G0/G1期。藥物作用48 h后出現細胞凋亡,且隨著藥物劑量的增加,凋亡率越來越高,并且ω-3 PUFA與DEX聯合應用細胞凋亡增加更明顯,充分表明ω-3 PUFA具有細胞周期阻滯、誘導凋亡的雙重作用。有研究顯示EPA和DHA主要通過影響線粒體膜電位和激活caspase-3誘導細胞凋亡,且在細胞凋亡中起到不可替代的作用,是細胞凋亡過程中最主要的剪切酶[11]。另外,BCL-2和Bax是調控細胞凋亡非常重要的兩個基因,同屬BCL-2家族,BCL-2發揮抗凋亡作用,而Bax則促進細胞凋亡,它們在調節細胞凋亡和細胞耐藥方面具有重要作用[12]。本研究發現,經ω-3 PUFA作用后,MM1R細胞的Cleaved caspase-3、Bax蛋白水平均逐漸上調,Pro-caspase-3、BCL-2蛋白逐漸下調,而且具有劑量依賴性,表明ω-3 PUFA可能是通過caspase途徑和調節BCL-2/Bax比率來誘導MM細胞凋亡的。
綜上所述,ω-3 PUFA是一種新型且有效逆轉MM耐藥的治療藥物,為MM尤其是發生激素抵抗MM的治療提供新思路和新靶點,為提高MM的治療效果、降低化療藥物的不良反應、減少治療費用、改善患者生存質量開辟新的方法,具有重要的臨床意義。但是,目前該藥物對MM逆轉耐藥作用仍停留在初步研究階段,后續還需要動物實驗和臨床試驗進一步研究和證實。
[1]Zang MR,Qiu LG.Advances in drug resistance mechanisms of multiple myeloma:reports from the 55th ASH annual meeting[J].J Leuk Lymph,2014,23(3):133-136.[藏美蓉,邱錄貴.多發性骨髓瘤耐藥機制相關研究進展:第55屆美國血液學會年會報道[J].白血病·淋巴瘤,2014,23(3):133-136.]
[2]Lang LW,Wang HY,Hu B,et al.Research advanced of polyunsaturated fatty acids in cancer and inflammation disease[J].Chin J Biochem Pharm,2014,34(1):153-155.[郎麗巍,王洪允,胡蓓,等.多不飽和脂肪酸在癌癥及炎癥疾病方面的研究進展[J].中國生化藥物雜志,2014,34(1):153-155.]
[3]Liu CA,Xu QW,He K,et al.Preventive effect of n-3 polyunsaturated fatty acids intragastric administration on rats colorectal cancer[J]. Canc Res Prev Treat,2014,41(12):1279-1281.[劉春安,許慶文,何可,等.n-3多不飽和脂肪酸灌胃對大鼠結直腸癌的預防作用[J].腫瘤防治研究,2014,41(12):1279-1281.]
[4]Hao M,Lin JT.Research advanced in the molecular mechanisms of insensitivity glucocorticoid[J].Natl Med J China,2014,25(26):2073-2075.[郝敏,林江濤.糖皮質激素不敏感的分子機制研究進展[J].中華醫學雜志,2014,25(26):2073-2075.]
[5]D'eliseo D,Velotti F.Omega-3 fatty acids and cancer cell cytotoxicity: implications for multi-targeted cancer therapy[J].J Clin Med,2016,5 (2):3390-3399.
[6]Devi KP,Rajavel T,Russo GL,et al.Molecular targets of omega-3 fatty acids for cancer therapy[J].Anticancer Agents Med Chem, 2015,15(7):888-895.
[7]Serini S,Ottes VR,Fasano E,et al.Epigenetic regulation of gene expression and M2 macrophage polarization as new potential omega-3 polyunsaturated fatty acid targets in colon inflammation and cancer[J].Expert Opin Ther Targets,2016,20(7):843-858.
[8]Chen Z,Zhang Y,Jia C,et al.mTORC 1/2 targeted by n-3 polyunsaturated fatty acids in the prevention of mammary tumorigenesis and tumor progression[J].Oncogene,2014,33(37):4548-4557.
[9]Abdi J,Garssen J,Faber J,et al.Omega-3 fatty acids,EPA and DHA induce apoptosis and enhance drug sensitivity in multiple myeloma cells but not in normal peripheral mononuclear cells[J].J Nutr Biochem,2014,25(12):1254-1262.
[10]Fahrmann JF,Hardman WE.Omega 3 fatty acids increase the chemosensitivity of B-CLL-derived cell lines EHEB and MEC-2 and of B-PLL-derived cell line JVM-2 to anti-cancer drugs doxorubicin,vincristine and fludarabine[J].Lipids Health Dis,2013,12(36)1180-1194.
[11]Zhang C,Yu H,Shen Y,et al.Polyunsaturated fatty acids trigger apoptosis of colon cancer cells through a mitochondrial pathway [J].Arch Med Sci,2015,11(5):1081-1094.
[12]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy [J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
(2016-07-25收稿)
(2016-10-18修回)
(編輯:孫喜佳 校對:周曉穎)
Role and mechanisms of ω-3 polyunsaturated fatty acids in inducing cell apoptosis and reversing drug resistance in multiple myeloma
Wei SHI1,Defang FANG1,Yonggang ZHAO2
Defang FANG;E-mail:782674212@qq.com
1Nursing Department,Lianyungang TCM Branch,Jiangsu Union Vocational Technical Institute,Lianyungang 222006,China;2Department of Pathology,the First People's Hospital of Lianyungang,Lianyungang 222006,China
Objective:To explore the role and mechanisms of ω-3 polyunsaturated fatty acids(ω-3PUFAs)alone or in combination with dexamethasone(DEX)in inducing cell apoptosis and reversing drug resistance in multiple myeloma(MM).Methods:DEX-resistant MM cell line MM1R was treated with different concentrations of eicosapentaenoic acid(EPA)or docosahexaenoic acid(DHA)alone or in combinationwithDEXfor 24or 48h.Cell proliferationwasdetectedbyMTTassay.Cell cycleandapoptosisweremeasuredbyflowcytometry. Expression levels of apoptosis-related proteins were analyzed by Western blot.Two-tailed,unpaired Student's t-test was used to compare the two treatment groups.A value of P<0.05 was considered statistically significant.Results:MM1R proliferation was inhibited by different concentrations(10,20,50,and 100 μM)of EPA or DHA alone or in combination with 10 μM DEX in a dose-and time-dependent manner. The inhibition effect was significantly higher in combinative groups than in single EPA or DHA treatment group(P=0.014,P=0.032).The percentage of G0/G1phase and cell apoptosis rate in MM1R treated with different concentrations of EPA or DHA alone increased in a dosedependent manner.This percentage was also significantly higher in the combinative groups than in the single EPA or DHA treatment group (P=0.015,P=0.004).The expression levels of cleaved caspase-3 and Bax were upregulated,whereas those of pro-caspase-3 and BCL-2 were downregulated in a dose-dependent manner.Drug resistance gradually decreased in MM1R cells at different concentrations of EPA or DHA with the increase of drug concentration.The reversal fold also increased gradually,whereas the cells decreased in the two drug-combination groups compared with the single-drug group.Moreover,the drug-resistance reversal index increased significantly.Conclusion:ω-3PUFAs can inhibit DEX-resistant MM cell proliferation,arrest cell cycle,and induce cell apoptosis.ω-3PUFAs also exhibit a synergistic anti-resistanteffect in combination with DEX.Furthermore,ω-3PUFAs can serve as novel effective drugs for MM treatment.
:ω-3 polyunsaturated fatty acids,multiple myeloma,dexamethasone,drug resistance

10.3969/j.issn.1000-8179.2016.24.879
①江蘇省聯合職業技術學院連云港中醫藥分院醫學護理系臨床醫學教研室(江蘇省連云港市222006);②江蘇省連云港市第一人民醫院病理科
房德芳782674212@qq.com
石微專業方向為生物化學教學和分子生物學。
E-mail:846855639@qq.com

