3種方法提取辣椒根總RNA的效果比較
孫國勝 馬志虎 戴忠良 毛忠良 孫春青 潘躍平
摘 要: 針對辣椒根中富含多糖多酚的特點,比較了Trizol法、改良Trizol法和改良CTAB法3種方法對辣椒根總RNA提取的效果。結果表明,Trizol法、改良Trizol法能提取到辣椒根總RNA,但效果不理想;改良CTAB法提取到的辣椒根總RNA,28 S rRNA的亮度是18 S rRNA的2倍,OD260/OD280和OD260/OD230值分別為1.88和1.80,RNA質量濃度為254.0 mg·L-1;用提取到的RNA進行RT-PCR后可擴增出acting基因特異片段。因此改良CTAB法提取辣椒根總RNA的效果好、質量高、完整性好,能夠滿足后續試驗要求。
關鍵詞: 辣椒根; 改良CTAB法; RNA提取; 比較
Comparison of three methods on total RNA extraction from the root of Capsicum annuum L.
SUN Guosheng, MA Zhihu, DAI Zhongliang, MAO Zhongliang, SUN Chunqing, PAN Yueping
(Zhenjiang Institute of Agricultural Sciences in Hilly Area of Jiangsu Province, Jurong 212400, Jiangsu, China)
Abstract: As the characteristic of rich polyphenol and polysaccharide in the tissue of root in Capsicum annuum L.,three methods including Trizol,optimized Trizol and optimized CTAB to extract total RNA were compared. The results showed that the total RNA with high yields and better quality was extracted by optimized CTAB method that the 28 S rRNA band showed two folds than that of 18S rRNA The ratio of OD260/OD280 and OD260/OD230 are 1.88 and 1.80,the output rate of RNA was 254.0 μg·mL-1. Specific acting gene fragment was amplified by reverse transcription PCR. Above all,the RNA extracted by optimized CTAB method is intact with high quality and output rate. It can be used in following molecular biology experiments.
Key words: Capsicum annuum L.; Optimized CTAB method; RNA extraction; Comparison
高質量的植物組織總RNA是相關分子生物學試驗的基礎[1]。隨著分子生物技術的發展,RNA提取技術已經相當成熟,已有試劑盒可供選擇,如Trizol和RNAgents等[2],但就某些材料而言,單純的試劑盒或通用技術并不能獲得質量好的總RNA[3],所以找到合適的RNA提取技術至關重要。
葉片或嫩莖等采用常規試劑盒就可以提取到高質量的RNA,但是一些木質化程度高,富含多糖多酚等的植物組織,提取RNA的難度就會大大增加,且有時不會獲得理想的RNA[4]。因此針對難提取RNA的材料,需要采用特別或者改進的方法[5]。
辣椒(Capsicum annuum L.)是一種重要的蔬菜和調味品,是我國種植面積最大的蔬菜之一,種植面積僅次于大白菜,位居第2[6]。筆者在對辣椒黃綠苗突變體(Yellow bud mutant)的葉色變化研究中發現辣椒根富含多糖多酚,不能直接用Trizol法提取總RNA,所以有必要針對富含多糖多酚的辣椒根摸索一套RNA提取方法,以期為后續研究奠定基礎。為了解決這個問題,我們比較了Trizol法、改良Trizol法和改良CTAB法[7]提取辣椒根總RNA的效果。
1 材料與方法
1.1 材料
試驗材料為辣椒‘YBM1106-2黃綠苗突變體,由江蘇丘陵地區鎮江農科所蔬菜花卉研究室提供。辣椒播種采用50孔穴盤,基質為細河沙,待長出3~4片真葉時取試驗材料。
1.2 試劑
Trizol試劑購自Invitrogen 公司;十六烷基三甲基溴化銨(CTAB)、聚乙烯吡咯烷酮(PVP)、氯仿、乙醇、異戊醇、異丙醇、β-巰基乙醇、LiCl和EDTA-Na2·2H2O等均為分析純,購自國藥集團化學試劑有限公司;RT-PCR 試劑購自Takara公司。
2×CTAB提取緩沖液:100 mmol·L-1 Tris-HCl(pH 8.0),20 mmol·L-1 EDTA-Na2,1.4 mmol·L-1 NaCl,1%PVP(ω),2% CTAB(ω)。即配置100 mL 2×CTAB提取緩沖液需加:Tris 1.211 4 g,EDTA-Na2·2H2O 0.744 4 g,NaCl 8.181 6 g,PVP 1 g,CTAB 2 g,加RNase Free水60 mL,用4 mmol·L-1 HCl調pH至8.0,用RNase Free水定容至100 mL,65 ℃水浴溶解,122 ℃滅菌20 min。
氯仿/異戊醇為24 ∶1(V/V);8 mmol·L-1 LiCl (RNase Free水配置,122 ℃滅菌20 min)。
1.3 試驗方法
1.3.1 Trizol試劑提取法 (1)取100 mg 辣椒幼根加液氮研磨成粉末,在研缽中加入1 mL Trizol裂解液并置于室溫環境下靜置5 min,后將其轉入1.5 mL離心管中離心10 min(4 ℃,12 000 r·min-1);(2)取上清液,加200 μL氯仿后渦旋混勻,室溫靜置2 min,離心10 min(4 ℃,12 000 r·min-1);(3)取上清液,加入等體積的冰冷的異丙醇,渦旋混勻后室溫靜置10 min,離心10 min(4 ℃,12 000 r·min-1);(4)棄上清液,加入1 mL 75%(φ,后同)乙醇,振蕩后離心5 min(4 ℃,7 500 r·min-1),移凈上清液,開離心管蓋室溫靜置或放置在通風柜中通風10 min,加入20 μL RNAse Free 水溶解后-70 ℃保存。
1.3.2 改良Trizol試劑提取法 裂解液中加入20 μL β-巰基乙醇,并將裂解液置于65 ℃水浴10 min,在研磨后的粉末中加入上述裂解液,其余步驟同Trizol試劑提取法。
1.3.3 改良CTAB提取法 (1)將 CTAB提取液65~70 ℃水浴中預熱10 min;(2)取100 mg 辣椒根于液氮環境下研磨成粉末,在研缽中加入900 μL上述CTAB提取液,并加入20 μL β-巰基乙醇,溶化后裝入2 mL離心管渦旋30 s后重新放回65~70 ℃水浴中靜置5 min;(3)加入900 μL氯仿/異戊醇(24∶1,V/V),渦旋混合后,離心15 min(4 ℃,10 000 r·min-1);(4)取上清液,加等體積氯仿/異戊醇(24∶1,V/V)重復步驟3;(4)取上清液于1.5 mL 離心管,加1/3體積 8 mol·L-1 LiCl 4 ℃沉淀過夜或者加入等體積冰冷的異丙醇4 ℃沉淀2 h后離心5 min(4 ℃,12 000 r·min-1);(5)棄上清液,用500 μL 75%乙醇懸浮沉淀,離心5 min (4 ℃,12 000 r·min-1),棄上清液,用500 μL 100%(φ)乙醇洗滌沉淀,離心5 min (4℃,12 000 r·min-1);(6)棄上清液,開離心管蓋室溫靜置或放置在通風柜中通風10 min,加入20 μL RNAse Free 水溶解后-70 ℃保存。
1.3.4 總RNA凝膠電泳檢測 取2 μL提取的總RNA樣品,進行1.2%(φ)瓊脂糖凝膠電泳,用凝膠成像系統(Tanon,GIS2500)觀看RNA條帶。
1.3.5 總RNA純度檢測 總RNA純度檢測采用核酸蛋白分析儀(Eppendorf Biophotometre 4G 22331 Hamburg),測定其OD230、OD260、OD280及其濃度。
1.3.6 RT-PCR檢測 提取到的辣椒根總RNA經反轉錄(Takara,M-MLV反轉錄試劑盒)成cDNA后,采用acting基因進行檢測,特異性引物為P1: 5-cgt tga cat ccg taa aga cc-3,P2: 5-aac agt ccg cct aga agc ac-3。反應體系為20 μL,反應程序為:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30個循環;72 ℃延伸10 min,4 ℃保存。反應結束后進行1%(φ)瓊脂糖凝膠電泳檢測PCR產物。
2 結果與分析
2.1 辣椒根總RNA凝膠電泳檢測
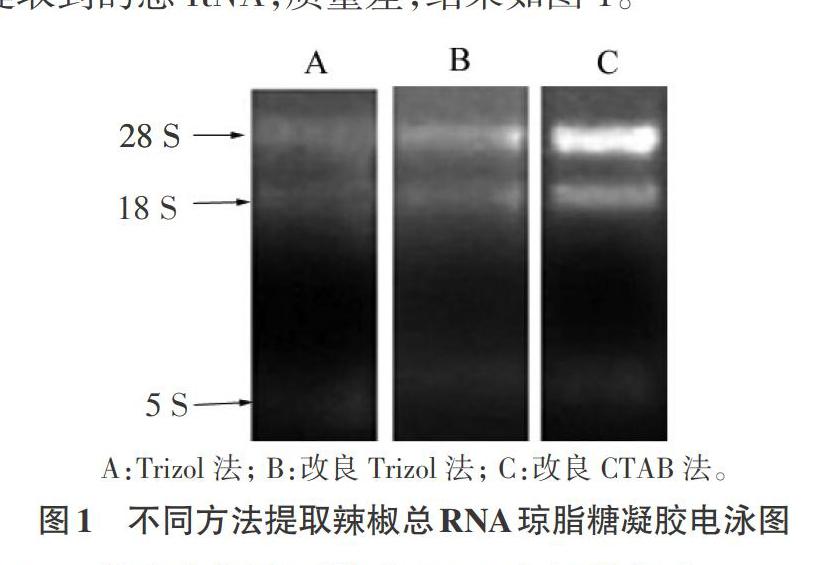
3種辣椒根總RNA提取方法中,改良CTAB法提取到的辣椒根總RNA條帶清晰,可明顯看到28 S、18 S和5 S共3條特征性條帶,且28 S條帶明顯亮于18 S(約2倍),無拖帶現象,說明無DNA、蛋白質及多糖的污染。
Trizol法和改良Trizol法提取到的辣椒根總RNA,也能看到特征性條帶,但亮度明顯不如改良CTAB法提取到的總RNA,尤其是直接用Trizol法提取到的總RNA,質量差,結果如圖1。
A:Trizol法; B:改良Trizol法; C:改良CTAB法。
圖1 不同方法提取辣椒總RNA瓊脂糖凝膠電泳圖
2.2 3種方法提取到的總RNA產量及純度
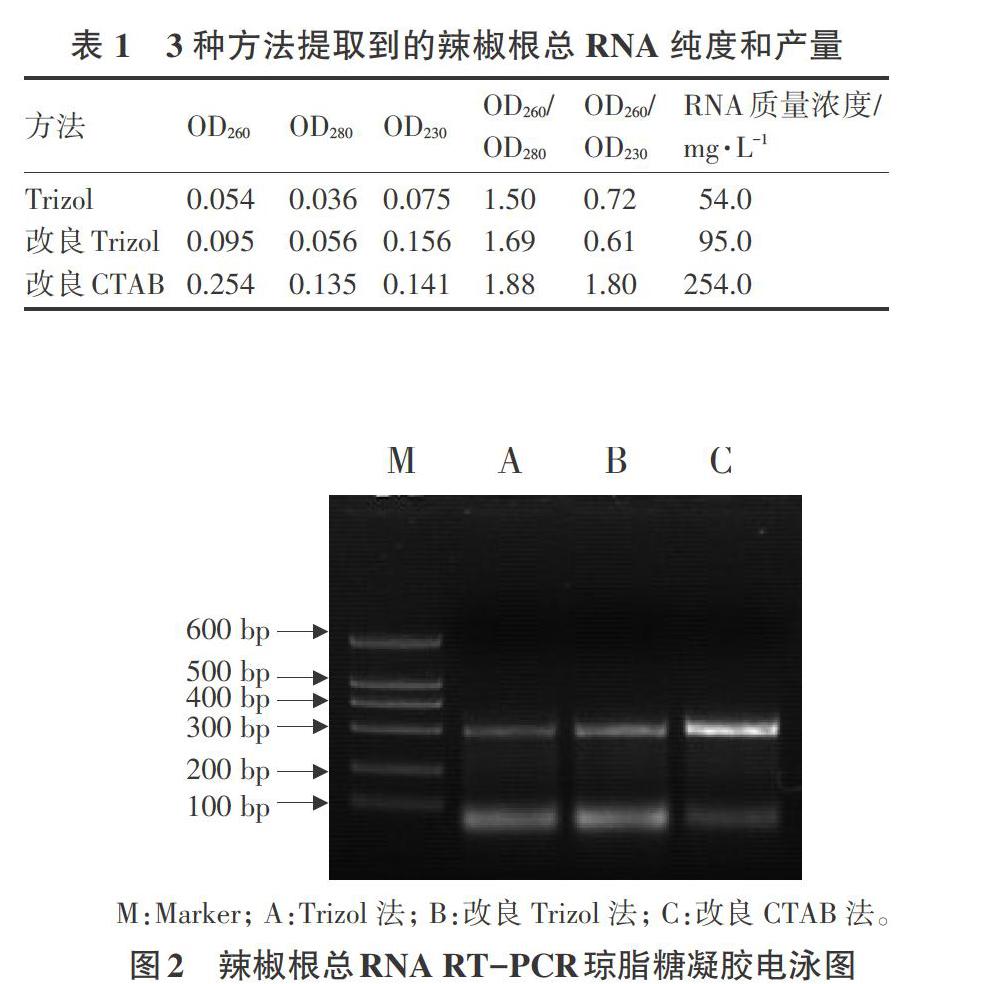
表1列出通過3種方法提取到的辣椒根總RNA的產量及其純度,所列為3種樣品在紫外分光光度計下測量230 nm、260 nm 和280 nm下的OD值,并計算出相應的OD260/OD280和OD260/OD230,并列出相應樣品的RNA濃度。
由表1可見:改良CTAB法提取的辣椒根總RNA 的OD260/OD280和OD260/OD230值分別為1.88和1.80(純度較高的RNA兩個值為1.7~2.0和>2.0),而Trizol法和改良Trizol法提取到的RNA,兩個值均比改良CTAB法的小,說明這2種方法提取的RNA受雜質污染嚴重。
而從RNA質量濃度可見,改良CTAB法提取到的RNA濃度最高,為254.0 mg·L-1,Trizol法和改良Trizol法提取到的RNA含量分別為54.0、95.0 mg·L-1,濃度均低于改良CTAB法。
2.3 RT-PCR檢測
對所提取到的辣椒根RNA進行RT-PCR檢測,目的是為了驗證其是否適宜RT-PCR或其他分子生物學試驗,以3種方法提取到的RNA反轉錄得到的cDNA為模板,用acting基因特異性引物進行PCR檢測。結果表明:3種方法均能得到目的條帶(約300 bp),但是以改良CTAB法提取到的總RNA為模板的條帶明顯比其他2種模板得到的條帶亮,且亮度差異很大(圖2)。試驗結果表明:改良CTAB法提取的RNA效果更好,能夠有效地滿足后續試驗要求。
M:Marker; A:Trizol法; B:改良Trizol法; C:改良CTAB法。
圖2 辣椒根總RNA RT-PCR瓊脂糖凝膠電泳圖
3 討 論
提取高質量的RNA是進行后續分子生物學試驗的基礎,辣椒根組織中富含多糖多酚,常規RNA提取方法雖然能夠提取到RNA,但是質量不高,影響后續試驗。酚類物質在氧化環境下極易被氧化成醌[8],并且極易與RNA產生不可逆的結合,改良CTAB法提取辣椒根RNA,在提取液中加入PVP,起著多酚螯合劑的作用[9-10],PVP具有很強的與多酚結合的能力,使其不易被氧化,能夠防止多酚與RNA相結合,PVP與酚類物質形成的螯合物在后續抽提中被除去,可有效減少酚類物質的影響。同時β-巰基乙醇作為強還原劑加入到裂解液中,可有效降低酚類物質的氧化[11]。多糖的理化性質與RNA相似,去除多糖的過程中容易將RNA一起去除,難以將其分開[12],也會造成RNA損失,采用8 mmol·L-1高濃度的LiCl低溫沉淀過夜,能專一性的沉淀RNA,但是會損失5 S rRNA,采用冰冷的異丙醇沉淀,亦能得到較高濃度的RNA,本試驗采用冰冷的異丙醇沉淀,若需更高質量的RNA,可選用高濃度LiCl過夜沉淀。采用氯仿、異戊醇體積比為24∶1抽提可有效去掉蛋白質,70%(φ)乙醇下RNA不溶解,可有效去除殘留蛋白質和多糖,從而得到高質量的辣椒根RNA。
本試驗比較了Trizol、改良Trizol及改良CTAB法提取辣椒根總RNA的效果,結果表明,改良CTAB法能夠有效地提取到高質量的辣椒根RNA,無論從質量、濃度和RT-PCR結果看,改良CTAB法提取到的辣椒根總RNA均能滿足后續分子生物學試驗,同時該方法具有操作簡單、快速的優點,可供其他富含多糖多酚植物的RNA提取借鑒。
參考文獻
[1] Woo S,Yum S,Yoon M,et al. Efficient isolation of intact RNA from the soft coral Scleronephthya gracillimum(Kükenthal) for gene expression analyses[J]. Integrative Biosciences,2005,9(4): 205-209.
[2] López-Gómez R,Gómez-Lim M A. A method for extracting intact RNA from fruits rich in polysaccharides using ripe mango mesocarp[J]. HortScience,1992,27(5): 440-442.
[3] 高志勇. 一種水稻總RNA提取的簡易方法[J]. 曲阜師范大學學報,2005,31(4): 97-98.
[4] 李燕凌,李大志. 辣椒組織總RNA提取方法研究[J]. 辣椒雜志,2007(2): 32-35.
[5] Liu J J,Goh C J,Loh C S,et al. A method for isolation of total RNA from fruit tissues of banana[J]. Plant Mol Biol Rep,1998,16:1-6.
[6] 鄒學校. 辣椒遺傳育種學[M]. 北京: 科學出版社,2009: 1.
[7] 杜中軍,徐兵強,黃俊生,等. 一種改進的富含多糖的芒果組織中完整總RNA提取方法[J]. 植物生理學通訊,2005,41(2): 202-204.
[8] Pasupathy K,Lin S,Hu Q,et al. Direct plant gene delivery with a poly(amidoamine)dendrimer[J]. J Biotechnol,2008,3: 1078-1082.
[9] 李志能,黃文俊,張佳琪,等. 異硫氰酸胍法快速提取二球懸鈴木組織總RNA的研究[J]. 武漢植物學研究,2007,25(3): 266-269.
[10] 楊占軍,谷守琴,張健,等. 幾種植物組織總RNA提取方法的特點及疑難對策[J].安徽農業科學,2009,37(18): 8341-8342.
[11] 李菁芳,黃劭毅,田仁鵬. 一種適用于RT-PCR的杉樹類植物中總RNA提取的方法[J].武漢植物學研究,2004,22(6): 551-556.
[12] Wang C S,Vodkin L O. Extraction of RNA from tissues containing high levels of procyanidins that bind RNA[J],Plant Molecular Biology Reporter,1994,12(2): 132-145.

