中國西北地區披堿草屬植物所帶內生真菌的培養特征
宋輝,南志標,田沛
(草地農業生態系統國家重點實驗室,蘭州大學草地農業科技學院,甘肅 蘭州 730020)
中國西北地區披堿草屬植物所帶內生真菌的培養特征
宋輝,南志標*,田沛
(草地農業生態系統國家重點實驗室,蘭州大學草地農業科技學院,甘肅 蘭州 730020)
摘要:內生真菌與植物所形成的共生體普遍存在于冷季禾草中,共生體有利于提高宿主植物的生物和非生物抗性。雖然目前研究者們已對禾草內生真菌做了大量的研究,但是尚未發現對分布于中國西北地區披堿草屬植物無性世代Neotyphodium內生真菌培養特征的研究。本研究從中國西北地區分離出15株來自不同地理種群披堿草屬植物無性世代Neotyphodium內生真菌。通過分離培養,測定了這15株無性世代Neotyphodium內生真菌的菌落生長速度,結果顯示,這15株無性世代Neotyphodium內生真菌菌落的平均生長速度為(0.41~0.85) mm/d,且生長速度與海拔具有相關性。分布在海拔低于3000 m的無性世代Neotyphodium內生真菌的菌落生長速度比生長于海拔高于3000 m菌落的生長速度快。觀察菌落發現,分布在海拔高于3000 m的菌落正面特征較為一致,而分布在海拔低于3000 m的菌落正面特征出現不同。另外,通過多基因聯合建樹發現,分布在海拔高于3000 m的無性世代Neotyphodium內生真菌聚在一個分支,而分布在海拔低于3000 m的無性世代Neotyphodium內生真菌呈現星狀分布。由于目前尚未對中國西北地區披堿草屬植物無性世代Neotyphodium內生真菌命名。因此,希望本研究結果能為該菌的命名提供理論依據。
關鍵詞:內生真菌;披堿草;菌落;多樣性;系統發育
Characteristic of asexual endophytes isolated fromElymusspecies in northwest China
SONG Hui, NAN Zhi-Biao*, TIAN Pei
KeyLaboratoryofGrasslandAgro-Ecosystems,CollegeofPastoralAgriculturalScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
Abstract:Forage grasses (Poaceae) often harbour endophytes belonging to the Neotyphodium and Epichlo? (Clavicipitaceae, Ascomycota) genera. Neotyphodium endophytes, the asexual state of Epichlo? species, helps to protect cool-season grasses against biotic and abiotic stresses including drought, disease, herbivory and parasitism and enhance aboveground and belowground vegetative and reproductive growth. There is little information on colonial diversity of asexual endophytes isolated from Elymus species in northwest Chinese. In the present study, different geographic populations of Elymus species were tested using the aniline blue screening method; 15 endophyte strains were isolated from endophyte positive plants. The average growth rate (on potato dextrose agar) of the isolated strains was 0.41-0.85 mm/day and was correlated with altitude. Endophyte strains isolated from regions below an altitude of 3000 m grew faster than strains isolated from regions above 3000 m. The colonial morphology of endophyte strains isolated from regions above 3000 m was similar whereas the colonial morphology of endophyte strains isolated from lower altitudes differed. In addition, the phylogenetic trees showed that endophytes collected above 3000 m were clustered whereas endophyte strains from lower altitudes demonstrated a star-like topology. The results will provide a theoretical basis for the identification of endophyte from northwest Chinese Elymus species.
Key words:endophyte; Elymus; colony; diversity; phylogeny
植物和其所帶真菌(或細菌)形成的共生體廣泛地分布在自然界中。這種互生共利的共生體能提高宿主植物對營養物質的吸收、提高對非生物脅迫的抗性以及通過產生生物堿避免昆蟲的采食和病原菌的侵入[1-12]。在過去30多年中,研究者們已經做了大量的關于宿主植物和其所帶內生真菌(endophyte)相互作用的研究。這里的內生真菌主要指的是子囊菌門(Ascomycota)麥角科(Clavicipitaceae)的有性世代Epichlo?和其所對應無性世代Neotyphodium。在這些研究中,研究者們發現了很多不同于其他植物和微生物所組成共生體的特征。Epichlo?(Neotyphodium)內生真菌廣泛地分布在一些重要的牧草中,由于他們的侵入一方面能提高宿主植物的生物學特征;另一方面,一些侵入宿主植物的內生真菌產生的生物堿又會引起家畜中毒甚至死亡。因此,在全世界范圍內引起了對Epichlo?(Neotyphodium)內生真菌的廣泛研究。最近,Leuchtmann等[13]根據大量的基因組測序結果并結合形態學描述,將Epichlo?(Neotyphodium)進行了重命名。他們將所有內生真菌均命名為Epichlo?,原本的Neotyphodium被認為暫時沒有發現其有性階段,也被冠以Epichlo?。由于這種命名并不能很好地揭示無性世代Neotyphodium內生真菌的起源和傳播。因此,在本文中仍采用原有的分類方法。
披堿草屬(Elymus)植物隸屬于禾本科小麥族,據統計大約有150種披堿草屬植物分布在北半球,主要分布在北極地區至亞熱帶之間[14-15]。關于披堿草屬植物內生真菌的系統研究僅限于分離于北美洲披堿草屬植物有性世代Epichlo?內生真菌,研究者對該內生真菌進行了命名并分析了產生物堿的特征[16]。相反,中國特有披堿草屬植物內生真菌的研究尚不系統,雖有研究者已經分離出中國特有披堿草屬植物無性世代Neotyphodium內生真菌,但尚未對其命名,也未對其進行系統發育分析。Zhang和Nan[17-18]已報道了分離于中國地區披堿草(Elymusdahuricus)無性世代Neotyphodium內生真菌,并從內生真菌產生物堿和對宿主植物的影響等方面進行了研究。他們的研究表明,共生體所產的生物堿peramine的含量隨季節變化,其中生長季末含量最高,另外,披堿草內生真菌能提高宿主植物的耐旱性和發芽率[19]。本文的主要目的是:1) 測定已分離于中國西北地區披堿草屬植物內生真菌菌落的生長速度和觀察菌落特征,為中國西北地區披堿草屬植物內生真菌的命名提供理論依據。2) 通過測定已分離內生真菌微管蛋白基因(tubB)和延長因子基因(tefA)序列構建系統發育樹,結合菌落生長速度,從分子生物學角度探討這些內生真菌的系統發育關系。
1材料與方法
1.1 材料
在中國西北地區共采集234株披堿草屬植物的種子和植株,采集省份包括寧夏、甘肅、青海。采集到的種子已播種到蘭州大學榆中校區試驗田。使用苯胺藍染色法[20]檢測這些披堿草屬植物的帶菌情況,帶有內生真菌的披堿草屬植物主要分布在甘肅和青海。詳細信息見表1。
1.2 內生真菌的分離和培養
將經過表面消毒的披堿草屬植物的莖稈或種子放置于馬鈴薯葡萄糖瓊脂培養基(PDA),25℃黑暗環境下培養。待莖稈或種子周圍有菌絲長出后,使用經過無菌處理過的解剖針挑取少量菌絲于新鮮PDA培養。將PDA培養基置于25℃黑暗環境下培養4周[21]。為揭示生長速度和培養時間的關系,本研究對內生真菌菌落的生長速度采用十字法進行2次測量,第1次測量時間為內生真菌生長2周后(設置3個重復),第2次測量時間為內生真菌生長4周后采用同樣的方法進行測量。
1.3 內生真菌DNA的提取和擴增
使用OMEGA公司的真菌DNA試劑盒(D3195-01)提取無性世代Neotyphodium內生真菌DNA。本研究以微管蛋白基因(tubB)和延長因子基因(tefA)序列為分子標記構建披堿草屬植物無性世代Neotyphodium內生真菌的系統發育關系。其PCR引物、反應程序以及反應體系參照Moon等[3]的方法。擴增tubB和tefA序列的引物為:tub-5: GAGAAAATGCGTGAGATTGT 和 tub-3: GTTTCGTCCGAGTTCTCGAC以及tef-5: GGGTAAGGACGAAAAGACTCA和tef-3: CGGCAGCGATAATCAGGATAG。PCR反應體系為:模板DNA,1 μL;引物各1 μL;2×taq master-mix,12.5 μL;使用無菌雙蒸水補至25 μL。反應程序為:94℃預變性5 min,然后運行35個循環,分別是,94℃,30 s;45℃,45s(tefA:55℃,45 s);72℃,1 min。最后,72℃延伸10 min。PCR產物經純化后連接至pMD18-T載體(Takara, 大連),利用PCR法篩選陽性克隆,每個樣本的每個分子標記均挑選3~5個陽性克隆委托蘭州勵合生物進行序列測定。
1.4 數據分析
使用MAFFT 7.0 軟件[22]對tubB和tefA序列進行多序列比對,對其結果使用GeneDoc軟件[23]進行手工調整。然后使用SequenceMatrix軟件[24]將2個序列合并為1條序列,并對其進行不相合長度差異檢測(incongruence length difference test, ILD test)以檢測2條序列是否適合聯合建樹。檢測結果表明,合并后的序列完全適用于多序列聯合建樹。系統進化樹由PAUP 4.0軟件[25]采用ML方法構建。ML系統進化樹的最佳模型為K80由Mrmodeltest軟件[26]計算。構建的進化樹均采用1000次隨機取樣重復,即自舉值(bootstrap value)設置為1000。
此外,使用SPSS 17.0軟件[27]對菌落生長速度進行分析。
2結果與討論
2.1 菌落生長速度測定
通過對15株披堿草屬植物無性世代Neotyphodium內生真菌菌落生長速度的研究發現,無性世代Neotyphodium內生真菌菌落的生長速度與宿主植物的生長區域具有特異相關性,而與宿主植物的種類沒有特異性。分布在海拔低于3000 m不同宿主植物無性世代Neotyphodium內生真菌菌落的生長速度(0.45~0.85) mm/d 顯著大于海拔高于3000 m不同宿主植物無性世代Neotyphodium內生真菌菌落的生長速度(0.41~0.65) mm/d (P<0.05)。
統計不同種類內生真菌菌落生長速度發現,內生真菌在不同時期具有不同的生長速度[28]。但是,本研究的結果卻與此不同。在培養無性世代Neotyphodium內生真菌的4個星期過程中,菌落平均生長速度為(0.41~0.85) mm/d,前2周和后2周的菌落平均生長速度均為(0.42~0.83) mm/d。這3組數據表明,本研究無性世代Neotyphodium內生真菌菌落在不同生長時期的速度基本沒有變化。進一步分析發現,分布在海拔低于3000 m披堿草屬植物無性世代Neotyphodium內生真菌菌落前2周的平均生長速度為(0.43~0.83) mm/d,而分布在海拔高于3000 m披堿草屬植物無性世代Neotyphodium內生真菌菌落前2周的平均生長速度為(0.42~0.63) mm/d。分布在海拔低于3000 m披堿草屬植物無性世代Neotyphodium內生真菌菌落后2周的平均生長速度為(0.43~0.83) mm/d,而分布在海拔高于3000 m披堿草屬植物無性世代Neotyphodium內生真菌菌落后2周的平均生長速度為(0.42~0.63) mm/d。海拔低于3000 m無性世代Neotyphodium內生真菌菌落4周的平均生長速度為(0.45~0.85)mm/d,而海拔高于3000 m無性世代Neotyphodium內生真菌菌落4周的平均生長速度為(0.41~0.65) mm/d。這些結果表明:1) 海拔低于3000 m無性世代Neotyphodium內生真菌菌落的平均生長速度顯著大于海拔高于3000 m無性世代Neotyphodium內生真菌菌落的平均生長速度(P<0.05)。 2) 分布在不同地理區域的內生真菌在不同生長時期的平均生長速度基本相同。
有性世代和無性世代內生真菌的生長速度不同[28]。分離于北美洲披堿草屬植物有性世代Epichlo?elymi內生真菌菌落的生長速度為(2.0~2.9) mm/d[16]。另外,通過分析tefA和tubB序列與其他已報道的內生真菌的系統發育關系時發現,本研究所分離的中國西北地區披堿草屬植物無性世代內生真菌與分離Poapratensisssp.pratensis的有性世代Epichlo?liyangensis之間存在親緣關系,而與分離于北美洲披堿草屬植物有性世代的內生真菌并不存在親緣關系,表明本研究分離的內生真菌與E.liyangensis存在共同祖先(未發表)。研究表明E.liyangensi的生長速率為(1.72~2.37) mm/d[29]。因此,不管是與分離于北美洲披堿草屬植物有性世代E.elymi內生真菌相比,還是與分離于Poapratensisssp.pratensis的有性世代E.liyangensis內生真菌相比,本研究所分離的無性世代Neotyphodium內生真菌菌落的生長速度(0.41~0.85) mm/d均比較慢。這與無性世代Neotyphodium內生真菌的生長速度小于有性世代Epichlo?內生真菌的生長速度的結論相一致[30]。
通過觀察披堿草屬植物內生真菌菌落的形態特征,還發現一些規律。所有菌落背面形態相似,均為深褐色;但是,海拔低于3000 m無性世代Neotyphodium內生真菌的正面菌落存在一個球形(NI_201203、NI_201208)、半圓形(NI_201201、NI_201206和NI_201210)或無突起(NI_201221)(圖1A);而海拔高于3000 m無性世代Neotyphodium內生真菌的正面菌落存在一個類似“蒙古包”突起(圖1B)。另外,麥賓草(Elymustangutorum)所帶無性世代Neotyphodium內生真菌在不同海拔表現出不一樣的菌落形態,而分布在海拔高于3000 m的菌落卻出現相同的菌落形態特征(表1和圖1)。這表明,披堿草屬植物內生真菌的菌落特征與海拔具有特異性,而與宿主植物的種類無特異性。Karimi等[31]通過使用AFLP(amplified fragment length poly-morphisms)分子標記研究伊朗3種宿主植物(Festucaarundinacea,Festucapratensis和Loliumperenne)與無性世代Neotyphodium內生真菌的關系時發現,無性世代Neotyphodium內生真菌與宿主植物的地理分布具有特異性而與物種之間沒有直接的特異性。另外,這一結論與Card等[32]使用SSR(simple sequence repeat)分子標記技術研究小麥族(Triticeae)植物,特別是大麥屬和披堿草屬植物的結果是一致的。但是,Simpson等[33]在新西蘭發現了一株帶有無性世代Neotyphodiumlolii內生真菌的矮化的黑麥草(Loliumperenne),他們在分離這株矮化黑麥草的內生真菌時發現,該內生真菌的菌落形態與其他黑麥草N.lolii內生真菌的形態不一致。隨后,他們將該形態不同的內生真菌接種到用殺菌劑處理后的黑麥草植物中,結果發現,原本正常生長的黑麥草竟然出現了矮化現象。這表明不同基因型的內生真菌可能會影響宿主植物的表型。
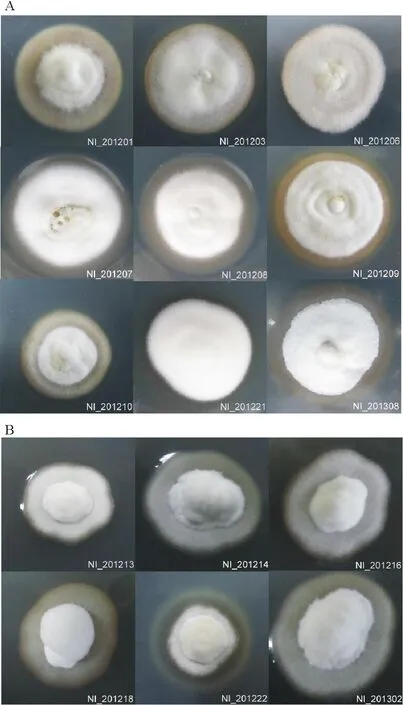
圖1 中國西北地區披堿草屬植物無性世代Neotyphodium內生真菌菌落形態特征Fig.1 Colonial morphotype of asexual Neotyphodium endophytes from northwest Chinese Elymus species A:海拔低于3000 m菌落形態特征;B:海拔高于3000 m菌落形態特征。A: Colonial morphotype regions below 3000 m; B: Colonial morphotype regions above 3000 m.
雖然本研究尚不能很好地解釋披堿草屬植物無性世代Neotyphodium內生真菌菌落形態不同的原因,但是本研究根據目前的結果并參考Sipmpon的研究結果大膽提出以下2個問題:1) 披堿草屬植物內生真菌的菌落形態由于海拔差異而出現了不同,是不是內生真菌與不同地理區域披堿草屬植物具有特異性?2) 是不是這兩種不同菌落形態的內生真菌對宿主植物的影響不同?例如:哪種菌落形態下,宿主植物對生物或非生物的抗性更強?
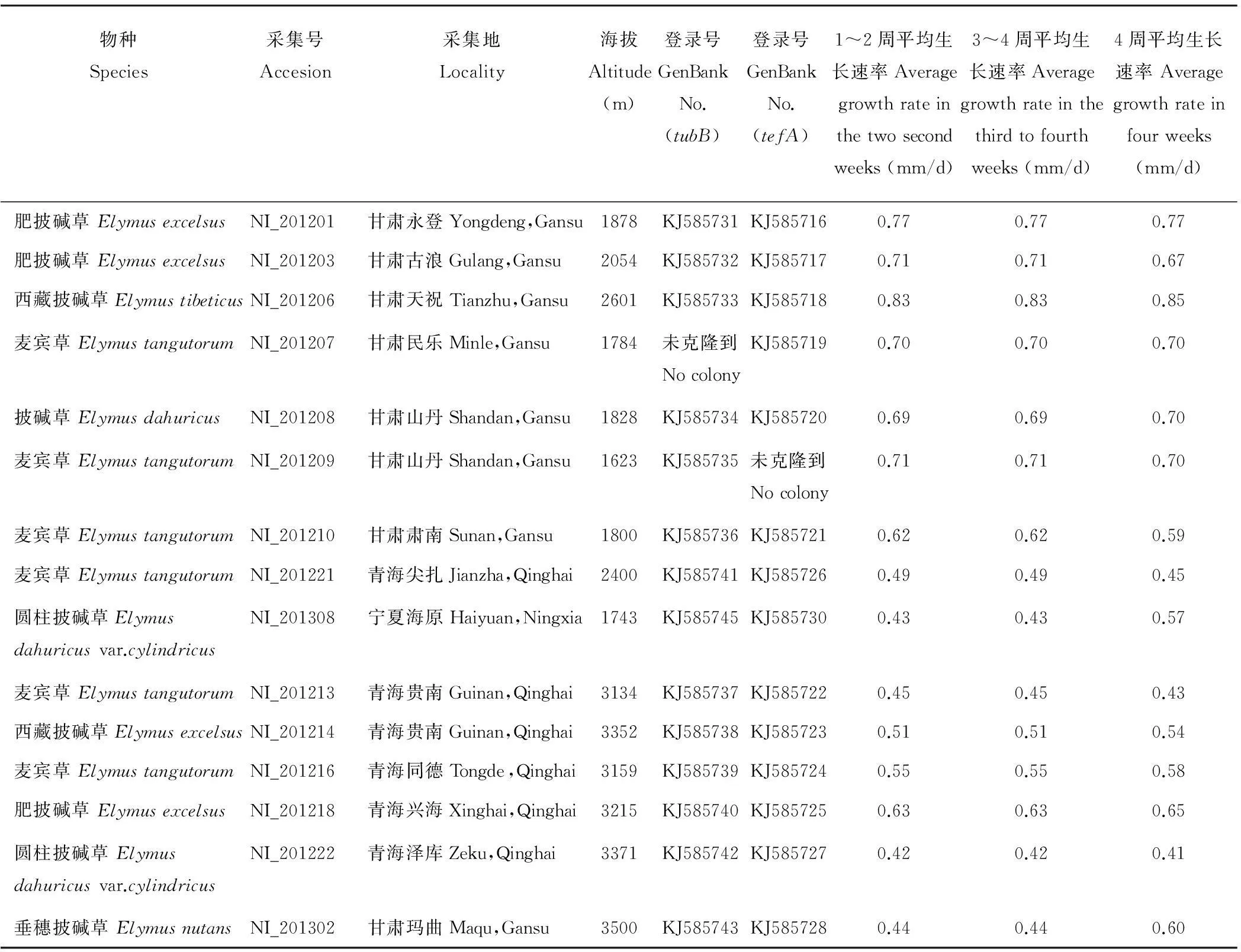
表1 中國西北地區披堿草屬植物無性世代Neotyphodium內生真菌生長速度
2.2 系統發育關系分析
與菌落培養特征相似,ML系統進化樹同樣反映出無性世代Neotyphodium內生真菌的聚類與海拔的相關性。由于NI_201207未克隆到tubB序列、NI_201209未克隆到tefA序列。因此在系統進化分析中缺少NI_201207和NI_201209。系統進化樹中有一個主要分支(圖2),該分支包含所有海拔高于3000 m的披堿草屬植物無性世代Neotyphodium內生真菌(自展率: 85)。相反,海拔低于3000 m的披堿草屬植物內生真菌并不聚集在一起,而呈星狀分布。雖然有研究表明,同一物種不成聚類分布的現象可能是由于基因重復(gene duplication)造成的[16,29-34],但是披堿草屬植物無性世代Neotyphodium內生真菌tubB、tefA和actB序列均未發現基因重復事件(未發表)。這可能是由于海拔低于3000 m的披堿草屬植物無性世代Neotyphodium內生真菌與其宿主植物長期相互作用的結果。
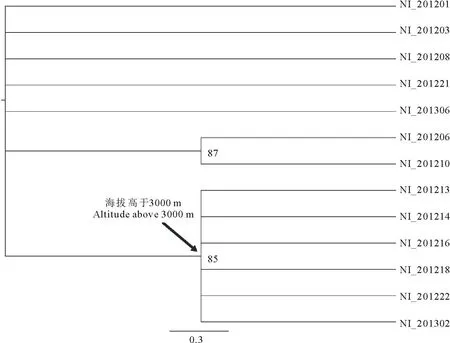
圖2 中國西北地區披堿草屬植物無性世代Neotyphodium內生真菌系統發育關系Fig.2 Phylogenetic relationships of asexual Neotyphodium endophytes from northwest Chinese Elymus species
另外,環境因素也可能發揮著重要的作用。Iannone等[35]研究阿根廷Poabonariensis宿主植物的內生真菌發現,分布在干旱地區的P.bonariensis宿主植物帶有內生真菌,而分布在潮濕草原中的P.bonariensis宿主植物則不帶有內生真菌。本研究的披堿草屬植物分布在中國西北較為干旱的地區。海拔高于3000 m的地方,晝夜溫差更大并且紫外線更為強烈。或許晝夜溫差和紫外線的強度是造成海拔高于3000 m的披堿草屬植物無性世代Neotyphodium內生真菌聚集在一起的原因。相反,海拔低于3000 m的地方環境因素更為多變,如降雨量的不同,陰面和陽面的區別等。這些外界因素可能是使海拔低于3000 m披堿草屬植物無性世代Neotyphodium內生真菌的菌落形態特征和在系統進化樹上不成聚類的原因。不過,具體的機制有待進一步的研究。
References:
[1]Latch G C M. An Overview onNeotyphodium-grass Interactions[M]. Springer US, 1997: 1-11.
[2]Malinowski D P, Belesky D P. Adaptations of endophyte-infected cool-season grasses to environmental stresses: mechanisms of drought and mineral stress tolerance. Crop Science, 2000, 40(4): 923-940.
[3]Moon C D, Miles C O, J?rlfors U,etal. The evolutionary origins of three newNeotyphodiumendophyte species from grasses indigenous to the Southern Hemisphere. Mycologia, 2002, 94(4): 694-711.
[4]Moy M, Li H M, Sullivan R,etal. Endophytic fungal β-1,6-glucanase expression in the infected host grass. Plant Physiology, 2002, 130(3): 1298-1308.
[5]Monnet F, Vaillant N, Hitmi A,etal. EndophyticNeotyphodiumloliiinduced tolerance to Zn stress inLoliumperenne. Journal of Plant Physiology, 2001, 113(4): 557-563.
[6]Saikkonen K, Helander M, Faeth S H,etal. Endophyte-grass-herbivore interactions: the case ofNeotyphodiumendophytes in Arizona fescue populations. Oecologia, 1999, 121(3): 411-420.
[7]Scott B.Epichlo? endophytes: fungal symbionts of grasses. Current Opinion in Microbiology, 2001, 4(4): 393-398.
[9]Gao F K, Dai C C, Liu X Z. Mechanisms of fungal endophytes in plant protection against pathogens. African Journal of Microbiology Research, 2010, 4(13): 1346-1351.
[10]O’Hanlon K A, Knorr K, Jorgensen L N,etal. Exploring the potential of symbiotic fungal endophytes in cereal disease suppression. Biological Control, 2012, 63(2): 69-78.
[11]Oberhofer M, Leuchtmann A. Genetic diversity in epichloid endophytes ofHordelymuseuropaeussuggests repeated host jumps and interspecific hybridizations. Molecular Ecology, 2012, 21(11): 2713-2726.
[12]Porras-Alfaro A, Bayman P. Hidden fungi, emergent properties: endophytes and microbiomes. Annual Review of Phytopathology, 2011, 49: 291-315.
[13]Leuchtmann A, Bacon C W, Schardl C L,etal. Nomenclatural realignment ofNeotyphodiumspecies with genusEpichlo?. Mycologia, 2014, 106(2): 202-215.
[14]Dewey D R. The Genomic System of Classification as a Guide to Intergeneric Hybridization with the Perennial Triticeae[M]. Springer US, 1984: 209-280.
[16]Charlton N D, Craven K D, Mittal S,etal.Epichlo? canadensis, a new interspecific epichloid hybrid symbiotic with Canada wildrye (Elymuscanadensis). Mycologia, 2012, 104(5): 1187-1199.
[17]Zhang Y, Nan Z. Distribution of epichlo? endophytes in Chinese populations ofElymusdahuricusand variation in peramine levels. Symbiosis, 2007, 43(1): 13-19.
[18]Zhang Y P, Nan Z B. Growth and anti-Oxidative systems changes inElymusdahuricusis affected byNeotyphodiumendophyte under contrasting water availability. Journal of Agronomy and Crop Science, 2007, 193(6): 377-386.
[19]Zhang X X, Li C J, Nan Z B. Effects of cadmium stress on seed germination and seedling growth ofElymusdahuricusinfected with theNeotyphodiumendophyte. Science China-Life Sciences, 2012, 55(9): 793-799.
[20]Neill J C. The endophyte of rye-grass (Loliumperenne). New Zealand Journal of Science Technology Section A, 1940, 21(5): 280-291.
[21]Zhang X, Ren A Z, Wei Y K,etal. Taxonomy, diversity and origins of symbiotic endophytes ofAchnatherumsibiricumin the Inner Mongolia Steppe of China. FEMS Microbiology Letters, 2009, 301(1): 12-20.
[22]Katoh K, Standley D M. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Molecular Biology and Evolution, 2013, 30(4): 772-780.
[23]Nicholas K B, Nicholas J H B. GeneDoc: A Tool for Editing and Annotating Multiple Sequence Alignments[A]. Distributed by the Author, 1997.
[24]Vaidya G, Lohman D J, Meier R. Sequence Matrix: concatenation software for the fast assembly of multi-gene datasets with character set and codon information. Cladistics, 2011, 27(2): 171-180.
[25]Swofford D L. PAUP*: Phylogenetic Analysis Using Parsimony (*and Other Methods), Version 4b10[M]. Massachusetts, USA: Sinauer, Sunderland, 2003.
[26]Nylander J A A. MrModeltest v2. Program Distributed by the Author[M]. Evolutionary Biology Centre, Uppsala University. 2004.
[27]George D, Mallery P. SPSS for Windows Step by Step: A Simple Guide and Reference. 11.0 update[M/OL]. Wps. Ablongman. Com/Wps/Media/Objects/385. George 4answers. pdf, 2003.
[28]Clay K, Schardl C L. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses. The American Naturalist, 2002, 160(S4): 99-127.
[29]Kang Y, Ji Y, Zhu K,etal. A newEpichlo? species with interspecific hybrid origins fromPoapratensisssp.pratensisin Liyang, China. Mycologia, 2011, 103(6): 1341-1350.
[30]White Jr. J F, Breen J P, Morgan-Jones G. Substrate utilization in selectedAcremonium,AtkinsonellaandBalansiaspecies. Mycologia, 1991, 83(5): 601-610.
[31]Karimi S, Mirlohi A, Sabzalian M R,etal. Molecular evidence forNeotyphodiumfungal endophyte variation and specificity with host grass species. Mycologia, 2012, 104(6): 1281-1290.
[32]Card S D, Faville M J, Simpson W R,etal. Mutualistic fungal endophytes in the Triticeae-survey and description. FEMS Microbiology Ecology, 2014, 88(1): 94-106.
[33]Simpson W R, Schmis J, Singh J,etal. A morphological change in the fungal symbiontNeotyphodiumloliiinduces dwarfing in its host plantLoliumperenne. Fungal Biology, 2012, 116(2): 234-240.
[34]Moon C D, Craven K D, Leuchtmann A,etal. Prevalence of interspecific hybrids amongst asexual fungal endophytes of grasses. Molecular Ecology, 2004, 13(6): 1455-1467.
[35]Iannone L J, Novas M V, Young C A,etal. Endophytes of native grasses from South America: biodiversity and ecology. Fungal Ecology, 2012, 5(3): 357-363.
宋輝, 南志標, 田沛. 中國西北地區披堿草屬植物所帶內生真菌的培養特征. 草業學報, 2015, 24(9): 89-95.
SONG Hui, NAN Zhi-Biao, TIAN Pei. Characteristic of asexual endophytes isolated fromElymusspecies in northwest China. Acta Prataculturae Sinica, 2015, 24(9): 89-95.
通訊作者*Corresponding author. E-mail:zhibiao@lzu.edu.cn
作者簡介:宋輝(1985-),男,山東魚臺人,在讀博士。E-mail:songh12@lzu.edu.cn
基金項目:國家“973”項目(2014CB138702)和中央高校基本科研業務費專項資金(lzujbky-2014-76, lzujbky-2014-81)資助。
收稿日期:2014-10-09;改回日期:2014-11-17
DOI:10.11686/cyxb2014411http://cyxb.lzu.edu.cn

