大腦中動脈狹窄的動態演變與其周圍微小血管的關系
鄭博文,許玉園,李明利,高山,馮逢,徐蔚海
大腦中動脈(middle cerebral artery,MCA)為動脈粥樣硬化性腦梗死最常受累的動脈,表現為MCA狹窄或閉塞[1-3],因此MCA的動脈粥樣硬化性狹窄或閉塞成為目前缺血性卒中研究的重點和熱點。隨著影像學檢查技術手段的進步,多種檢查技術如CT血管造影術(CT angiography,CTA)、灌注CT成像(perfusion-CT,PCT)、磁共振血管造影(magnetic resonance angiography,MRA)等均應用至MCA狹窄或閉塞的評估[4-7];其中,高分辨磁共振(high-resolution magnetic resonance imaging,HRMRI)作為近年來新出現的檢查手段,具有同時獲得血管壁、血管管腔及血管腔內栓子成分信息的能力,因此在MCA的動脈粥樣硬化性狹窄或閉塞研究中受到學者們的廣泛關注[8-10]。在研究MCA動脈粥樣硬化性狹窄或閉塞時,尤其是在側支循環相關的研究里,學者們發現了多種新的影像學現象,如FLAIR成像時觀察到的高信號血管征(FLAIR-hyperintense vessels)、深部細小血流腔隙(deep tiny flow voids,DTFV)、T1壓脂成像下的高信號征(high signals on T1-weighted fat-suppressed images)等[11-16],這些現象都在不同程度上為MCA動脈粥樣硬化性狹窄或閉塞的病情分析、預后評估方面提供了新的切入點,使顱內動脈粥樣硬化性疾病的評估系統變得更為客觀、全面。這項研究描述了在HRMRI觀察MCA動脈粥樣硬化性狹窄或閉塞時發現的一種新現象,稱為狹窄或閉塞周圍微小血管(small vessels around stenotic or occluded site,SVSOS),同時分析了復查條件下SVSOS現象和MCA狹窄或閉塞程度之間的聯系。
1 對象與方法
1.1 病例選擇 回顧性分析2007年1月-2015年3月在北京協和醫院行高分辨磁共振檢查的患者數據庫,選入因MCA狹窄或閉塞而進行大于或等于2次HRMRI檢查的病例,并通過MRA確認存在MCA狹窄或閉塞。對所有病例行頸部血管彩超檢查,排除同側頸內動脈狹窄>50%的病例,并行常規心電圖和心臟彩超檢查排除心源性栓子的可能。所有病例的兩次HRMRI檢查間隔的時間至少為1個月,且均在本院進行。1.2 納入、排除標準及分組 所有病例都經過詳細的病史采集、體格檢查及影像學評估。若患者復查MRA顯示MCA出現狹窄和閉塞之間的轉變,則納入變化組。若患者復查MRA顯示MCA狹窄或閉塞無明顯改變,則納入穩定組。滿足下列任意條件的病例應被排除:①MCA狹窄或閉塞同側并存>50%的頸內動脈狹窄;②近1個月有產生心源性栓子的可能,包括心肌梗死、心房顫動、室壁瘤、感染性心內膜炎、二尖瓣狹窄等;③年齡<40歲;④存在非動脈粥樣硬化性血管病變病史;⑤HRMRI成像質量不滿意。數據采集得到了本院倫理委員會的許可,參與研究的患者或患者家屬均簽署了知情同意書。
1.3 成像方法及分析 對MRI、MRA、HRMRI的常規成像所用的參數在以往的研究中已有提及[17-18]。本研究使用美國GE公司的Signa VH/i 3.0 T磁共振儀和標準的8通道頭部線圈來采集影像數據,通過三維MRA定位(最大強度投影和MRA的源圖像定位)獲得垂直于MCA M1段走行的HRMRI圖像,并采用美國GE公司的ADW 4.2工作站進行影像分析。
通過MRA結果判斷MCA狹窄或閉塞,而有無SVSOS的判斷則通過HRMRI結果確定。對雙側或多發性狹窄的病例,取閉塞處或狹窄程度最嚴重的一處進行評價;對多處閉塞的病例,取HRMRI復查時觀察閉塞程度變化最大的一處進行評價;當在HRMRI上持續多個層面觀察到管腔狹窄或閉塞,選擇開始出現狹窄或閉塞的兩個層面進行SVSOS的判斷和分析。
判斷存在SVSOS需要滿足以下條件:①在狹窄或閉塞的MCA周圍出現,與管壁相鄰;②在HRMRI上呈流空信號,至少在兩個連續的層面上數量≥3個;③其管腔大小小于或等于同一層面MCA管腔正常時的50%。MCA狹窄轉變為閉塞部位的周圍微小血管見圖1、圖2。
1.4 統計學方法 對兩組病例之間的年齡比較,呈正態分布數據采用t檢驗;對兩組病例性別、危險因素的比較,SVSOS和MCA狹窄或閉塞情況的變化分析,采用χ2檢驗。數據處理使用SPSS 22.0統計軟件完成。
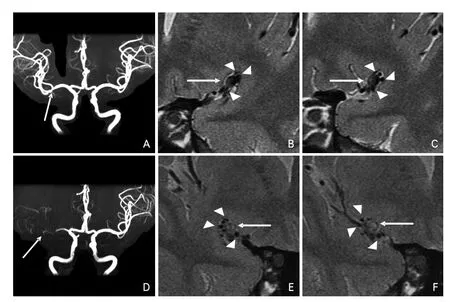
圖1 MCA狹窄至閉塞演變過程及其周圍微小血管示例
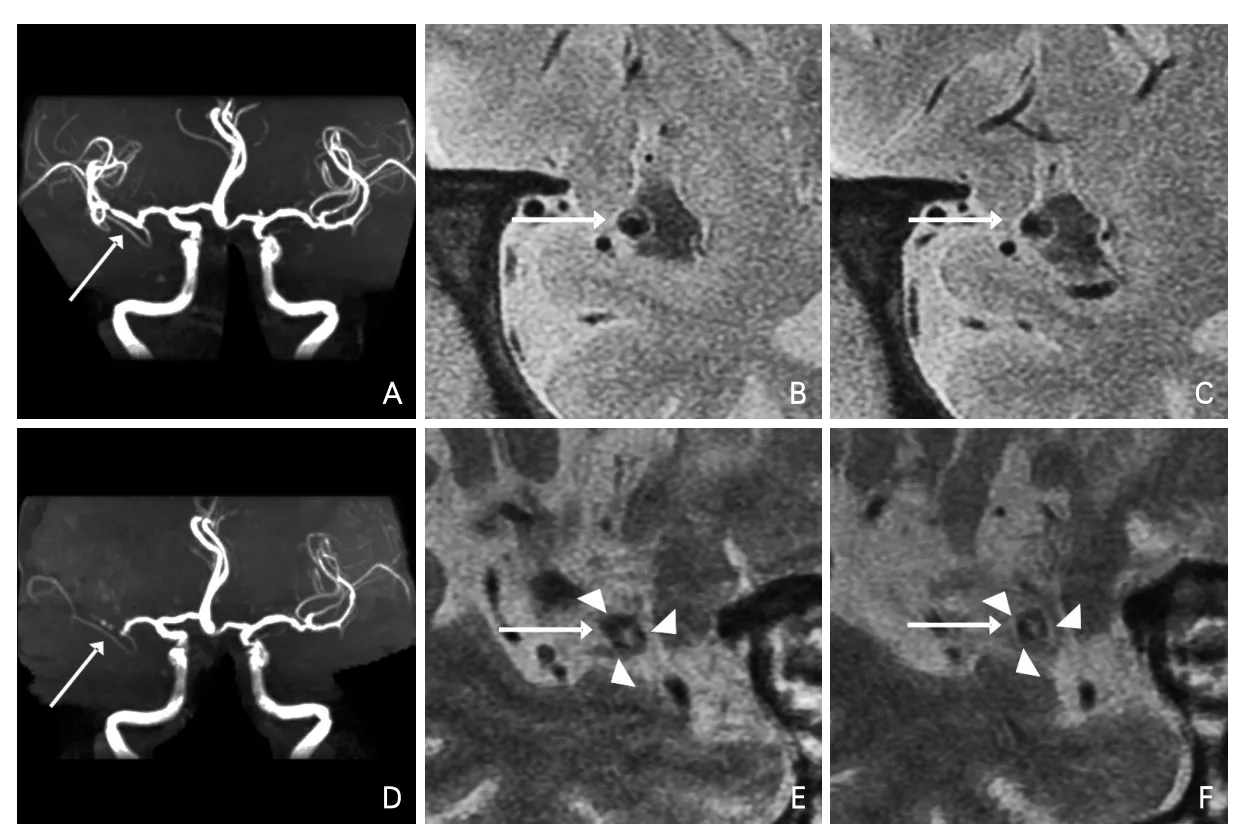
圖2 MCA狹窄至閉塞演變過程及其周圍微小血管變化過程示例
2 結果
2.1 一般資料 符合入組條件的MCA狹窄或閉塞病例共20例,其中MCA狹窄轉為閉塞組(變化組)7例,MCA維持狹窄不變組(穩定組)13例。兩組病例的年齡、性別及高血壓、糖尿病等危險因素比較,差異均無顯著性(表1)。
2.2 SVSOS狀況資料 最終復查HRMRI結果顯示,變化組有6例出現SVSOS(85.71%),而穩定組有3例出現(23.08%),兩組比較,差異有統計學顯著性(P=0.02)。在變化組和穩定組中各有1例出現SVSOS從無到有的變化,比較差異無統計學顯著性(P=1.00)。
3 討論
在這項研究中,本研究描述了在HRMRI觀察MCA動脈粥樣硬化性狹窄或閉塞時發現的一種影像學表現,即SVSOS。經過比較復查病例的影像學資料發現,雖然SVSOS在MCA的動脈粥樣硬化性狹窄變為閉塞的過程中沒有出現具有顯著意義的變化,但SVSOS傾向于在這個過程中出現,這也許說明SVSOS可作為MCA動脈粥樣硬化性狹窄轉變為閉塞的一個標記物。這對建立MCA動脈粥樣硬化性疾病評估體系,尤其是轉歸預測方面有重要意義。
MCA的動脈粥樣硬化性病變是缺血性卒中的最重要原因,其引起的缺血性卒中具有起病快、癥狀個體差異大、變化迅速、預后多樣的特點[19],而作為檢查金標準的有創檢查易受到時間、技術條件等的限制,因此針對MCA引起的缺血性卒中的無創影像學檢查得到了長久的重視并取得了重要的成果。其中,以HRMRI為首的新一代檢查手段成為目前國際關注的重點。HRMRI所獲得的圖像分辨率高,能觀察其他影像學手段所不能企及的細微結構,并且在解析血管內斑塊成分方面具有獨一無二的優勢,在分析MCA動脈粥樣硬化性病變的病因、狀態、預后方面具有重要的地位,因此HRMRI在臨床的應用日益受到重視[8]。目前,圍繞HRMRI對MCA動脈粥樣硬化性病變的研究日漸細化,在這些細化的領域里備受重視的一個是對MCA側支循環的研究。
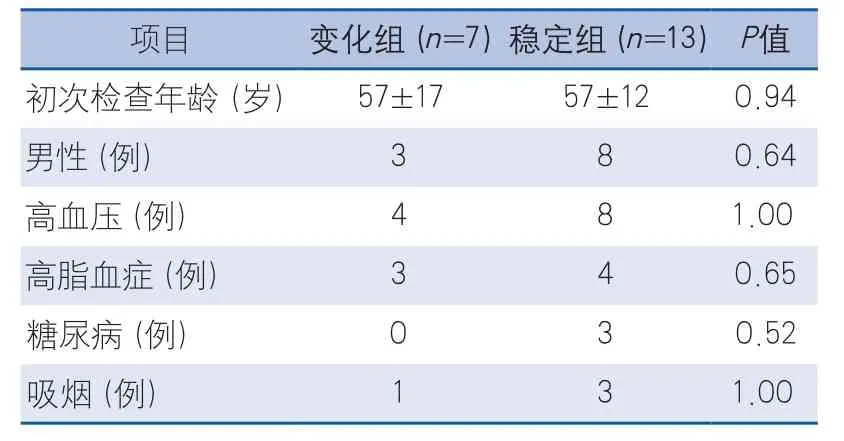
表1 患者臨床數據組間差異分析
MCA的側支循環分為三級,目前普遍認為側支循環對缺血性卒中具有良性作用,包括縮小梗死面積、減輕癥狀及改善預后等[20-21]。在這項研究中發現的影像學現象SVSOS,本研究將其假設為側支循環的其中一部分,通過多次HRMRI檢查探究其存在與否與狹窄或閉塞MCA轉歸的關系。而結果發現,MCA從狹窄轉變為閉塞的過程中和SVSOS有著顯著的相關性(P=0.017),因此本研究猜測SVSOS可能在MCA動脈粥樣硬化性病變轉變時發揮了作用或者是這個轉變過程的標記物。SVSOS在定義上是MCA狹窄或閉塞部位血管周圍的微小血管集合,這些微小血管集合在缺血性卒中的作用往往是代償性地為缺血區域輸送血液,理論上對狹窄的MCA有減小狹窄程度、對閉塞的MCA有促進再通的作用,但與預期相反,SVSOS和MCA從狹窄到閉塞的轉變過程有較大的關聯,說明SVSOS可能是MCA病變轉變過程的標記物。
在缺血性卒中發生后,側支循環受細胞因子如血管內皮生長因子(vascular endothelial growth factor,VEGF)等的刺激開始增生[20-23]。本研究認為這時患者的病變狀態取決于以下幾方面:①MCA病變的嚴重程度;②機體健康狀態是否能支持側支循環的增生、有無其他病理狀態阻止側支循環的生長;③MCA病變程度和側支循環增生程度的抗衡,決定了MCA病變的最終轉變。在本研究出現SVSOS的患者中,本研究猜想的病理生理過程如下:MCA動脈粥樣硬化病變導致缺血使側支循環增生,但由于機體基礎健康狀態不佳,導致側支循環雖有增生但其良性作用不足以抵消MCA病變的發展。雖然SVSOS的變化情況對MCA從狹窄到閉塞變化過程沒有指示作用,但僅從SVSOS傾向在MCA從狹窄到閉塞變化過程中出現就足以了解其價值所在。SVSOS可能是一種特定病理生理條件下MCA動脈粥樣硬化性狹窄到閉塞轉化的標記物,對研究建立MCA動脈粥樣硬化性病變導致的缺血性卒中預后的預測具有重要作用。
但這項研究同時也存在著以下的局限性:①研究樣本數量太少,可能是結果不具有顯著性意義的原因之一;②沒有進行DSA檢查,無法準確判斷側支循環的狀態;③由于出現SVSOS狀態變化的病例數只有2例,復查HRMRI間隔的時間對分析SVSOS生成所需的時間幫助不大,因此SVSOS出現變化所需的時間未能判斷;④回顧性研究的特點導致本研究在因果判斷的效力小于隊列研究,因此未來需要進一步的大樣本隊列研究證實。
綜上所述,本研究探討了使用HRMRI觀察MCA動脈粥樣硬化性狹窄或閉塞時發現的一種影像學表現,稱為SVSOS,這種表現和MCA動脈粥樣硬化性病變從狹窄轉變為閉塞的過程有關,可能為這個轉變過程在特定病理生理條件下的標記物。這個發現對MCA動脈粥樣硬化性病變的預后預測可能有重要作用,需要進一步研究證實。
1 Gorelick PB,Wong KS,Bae HJ,et al. Large artery intracranial occlusive disease:a large worldwide burden but a relatively neglected frontier[J]. Stroke,2008,39:2396-2399.
2 Degnan AJ,Gallagher G,Teng Z,et al. MR angiography and imaging for the evaluation of middle cerebral artery atherosclerotic disease[J]. AJNR Am J Neuroradiol,2012,33:1427-1435.
3 Tian L,Yue X,Xi G,et al. Multiple intracranial arterial stenosis influences the long-term prognosis of symptomatic middle cerebral artery occlusion[J].BMC Neurol,2015,15:68.
4 McVerry F,Liebeskind DS,Muir KW. Systematic review of methods for assessing leptomeningeal collateral fl ow[J]. AJNR Am J Neuroradiol,2012,33:576-582.
5 Calleja AI,Cortijo E,García-Bermejo P,et al.Collateral circulation on perfusion-computed tomography-source images predicts the response to stroke intravenous thrombolysis[J]. Eur J Neurol,2013,20:795-802.
6 Kim Y,Sin DS,Park HY,et al. Relationship between flow diversion on transcranial Doppler sonography and leptomeningeal collateral circulation in patients with middle cerebral artery occlusive disorder[J]. J Neuroimaging,2009,19:23-26.
7 Hwang YH,Kang DH,Kim YW,et al. Impact of time-to-reperfusion on outcome in patients with poor collaterals[J]. AJNR Am J Neuroradiol,2015,36:495-500.
8 Bodle JD,Feldmann E,Swartz RH,et al. Highresolution magnetic resonance imaging:an emerging tool for evaluating intracranial arterial disease[J].Stroke,2013,44:287-292.
9 Cho ZH,Lee YB,Kang CK,et al. Microvascular imaging of asymptomatic MCA steno-occlusive patients using ultra-high-field 7T MRI[J]. J Neurol,2013,260:144-150.
10 Yang WQ,Huang B,Liu XT,et al. Reproducibility of high-resolution MRI for the middle cerebral artery plaque at 3T[J]. Eur J Radiol,2014,83:e49-55.
11 Liu D,Li Y,Shi Z,et al. Presence of anterior temporal artery associates with good outcome in acute atherosclerotic M1-middle cerebral artery occlusion[J]. Neuroradiology,2014,56:1023-1030.
12 Lima FO,Furie KL,Silva GS,et al. Prognosis of untreated strokes due to anterior circulation proximal intracranial arterial occlusions detected by use of computed tomography angiography[J]. JAMA Neurol,2014,71:151-157.
13 Huang X,Liu W,Zhu W,et al. Distal hyperintense vessels on FLAIR:a prognostic indicator of acute ischemic stroke[J]. Eur Neurol,2012,68:214-220.
14 Haussen DC,Koch S,Saraf-Lavi E,et al. FLAIR distal hyperintense vessels as a marker of perfusiondiffusion mismatch in acute stroke[J]. J Neuroimaging,2013,23:397-400.
15 Xu WH,Li ML,Niu JW,et al. Deep tiny fl ow voids along middle cerebral artery atherosclerotic occlusions:a high-resolution MR imaging study[J]. J Neurol Sci,2014,339:130-133.
16 Xu WH,Li ML,Niu JW,et al. Luminal thrombosis in middle cerebral artery occlusions:a high-resolution MRI study[J]. Ann Transl Med,2014,2:75.
17 Xu WH,Li ML,Gao S,et al. In vivo high-resolution MR imaging of symptomatic and asymptomatic middle cerebral artery atherosclerotic stenosis[J].Atherosclerosis,2010,212:507-511.
18 Xu WH,Li ML,Gao S,et al. Middle cerebral artery intraplaque hemorrhage:prevalence and clinical relevance[J]. Ann Neurol,2012,71:195-198.
19 Huttner HB,Schwab S. Malignant middle cerebral artery infarction:clinical characteristics,treatment strategies,and future perspectives[J]. Lancet Neurol,2009,8:949-958.
20 Liu J,Wang Y,Akamatsu Y,et al. Vascular remodeling after ischemic stroke:mechanisms and therapeutic potentials[J]. Prog Neurobiol,2014,115:138-156.
21 Wang YQ,Guo X,Qiu MH,et al. VEGF overexpression enhances striatal neurogenesis in brain of adult rat after a transient middle cerebral artery occlusion[J]. J Neurosci Res,2007,85:73-82.
22 Grell AS,Thigarajah R,Edvinsson L,et al.Regulatory mechanism of endothelin receptor B in the cerebral arteries after focal cerebral ischemia[J].PLoS One,2014,9:e113624.
23 Liebeskind DS. Collateral perfusion:time for novel paradigms in cerebral ischemia[J]. Int J Stroke,2012,7:309-310.

