結腸癌組織中NDRG1及TGF-β 1的表達及意義
結腸癌組織中NDRG1及TGF-β1的表達及意義
曹翌1,彭春輝1,楊開1,張小薄2
(1錦州石化醫院,遼寧錦州121000;2中國醫科大學附屬盛京醫院)
摘要:目的觀察結腸癌組織中NDRG1及轉化生長因子β1(TGF-β1)的表達變化,探討其臨床意義。方法選取手術切除的結腸癌組織及其癌旁正常組織標本各78例,采用免疫組化法檢測其NDRG1、TGF-β1蛋白表達;切取新鮮結腸癌組織及癌旁正常組織16例,采用qRT-PCR法及Western blotting法檢測其NDRG1、TGF-β1的mRNA及蛋白表達水平。結果結腸癌組織中NDRG1、TGF-β1陽性表達率高于癌旁組織(P均<0.05)。NDRG1及TGF-β1蛋白陽性表達與腫瘤直徑、淋巴結轉移、腫瘤浸潤深度、腫瘤分化程度和Dukes分期有關(P均<0.05)。結腸癌組織中NDRG1與TGF-β1蛋白陽性表達率呈正相關(r=0.231,P<0.05)。結腸癌組織中NDRG1、TGF-β1蛋白及mRNA相對表達量高于癌旁組織(P均<0.05)。結論 NDRG1及TGF-β1在結腸癌組織中高表達,提示結腸癌預后不良,二者可能對結腸癌的惡性行為具有調控作用。
關鍵詞:結腸腫瘤;NDRG1基因;轉化生長因子β1
doi:10.3969/j.issn.1002-266X.2015.41.034
中圖分類號:R735.3
文獻標志碼:B
文章編號:1002-266X(2015)41-0081-04
收稿日期:(2015-07-06) (2015-04-10)
結腸癌發病為多基因、多因素共同作用的結果[1]。NDRG1屬NDRG家族成員,目前其作用存在抑癌及促癌兩種不同觀點,有研究認為其在不同組織來源、不同分化程度及腫瘤的不同階段對腫瘤惡性行為作用不同[2]。有研究認為,NDRG家族可能通過轉化生長因子β1(TGF-β1)對惡性腫瘤細胞的分化、增殖及凋亡等惡性行為發揮作用[3]。本研究對結腸癌組織中NDRG1及TGF-β1蛋白表達進行檢測,并分析其與結腸癌臨床病理特征的相關性,探討NDRG1及TGF-β1在結腸癌惡性行為中的作用及對預后的預測價值。
通信作者:曹翌
1材料與方法
1.1材料選取2013年1月~2014年7月于錦州石化醫院及中國醫科大學附屬盛京醫院普通外科手術切除并經病理檢查證實的結腸癌及其癌旁正常組織標本各78例,石蠟包埋;在手術標本移除后切取少量新鮮直徑0.5 cm結腸癌及癌旁正常組織16例,置于液氮中冷凍保存。鼠NDRG1多克隆抗體及兔TGF-β1多克隆抗體購自美國SantaCruz公司,SP免疫組化試劑盒、miRNA提取分離試劑盒、TRIzol及Lipofectamine 2000購自日本Takara公司。引物由大連寶生物技術有限公司設計合成,NDRG1上游引物:5′-CCTCUCATACGCGCGGAC-3′,下游引物:5′-CGCGGACCTAGUUGATCG-3′;TGF-β1上游引物:5′-CCAGGCUCGTTCTAGATGCUC-3′,下游引物:5′-CCGCUTCCTAGGAGACACCG-3′;GAPDH上游引物:5′-CTGCCUAGCTCACAUCCGCG-3′,下游引物:5′-CUCGTCTCGAGTAGUCTGC-3′。

[4] Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis[J]. Lancet, 2012,379(9828):1835-1846.
[5] Agnelli G, Becattini C. Acute pulmonary embolism[J]. N Engl J Med, 2010,363(3):266-274.
[6] Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association[J]. Circulation, 2011,123(16):1788-1830.
[7] Guyatt GH, Akl EA, Crowther M, et al. Executive summary: antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines[J].Chest, 2012,141(2 Suppl):7-47.
[8] 郭朝軍.術后肺梗塞的預防[J].中外醫學研究,2011,9(17):123.
[9] Tapson VF. Acute pulmonary embolism[J]. N Engl J Med, 2008,358(10):1037-1052.
[10] 吳軼雄,林國盛,陳國歡,等.溶栓加序貫抗凝治療次大面積肺栓塞療效觀察[J].臨床內科雜志,2011,28(12):835-836.
[11] 程顯聲,何建國,柳志紅,等.對急性肺栓塞中危患者溶栓療法的建議[J].中華醫學雜志,2011,91(32):2236-2238.
[12] Becattini C, Lignani A, Masotti L, et al. D-dimer for risk stratification in patients with acute pulmonary embolism[J]. Thromb Thrombolysis, 2012,33(1):48-57.
[13] Kabrhel C, Mark Courtney D, Camargo CA Jr, et al. Factors associated with positive D-dimer results in patients evaluated for pulmonary embolism[J]. Acad Emerg Med, 2010,17(6):589-597.
[14] 劉曉宇,劉運秋.急性肺動脈栓塞患者血漿中D-二聚體水平與死亡率的相關性分析[J].山東大學學報(醫學版),2010,48(6):96-99.
[15] 鄧朝勝,高少勇,林其昌,等.抗凝治療對老年與非老年肺栓塞患者D-二聚體的影響[J].中華老年醫學雜志,2012,31(6):475-478.
[16] 白重陽,呂曉麗,蘇征,等.急性肺栓塞血漿NT-ProBNP與D-二聚體水平的動態分析[J].國際檢驗醫學雜志,2014,35(5):599-600.
[17] 曾秀芳,李志海,郭芳青.彩色多普勒超聲在下肢深靜脈血栓診斷中的應用[J].國際醫藥衛生導報,2010,16(20):2496-2498.
1.2結腸癌組織及癌旁組織中NDRG1、TGF-β1表達檢測
1.2.1NDRG1、TGF-β1蛋白定性檢測采用免疫組化法。以已知小腸組織中NDRG1和TGF-β1蛋白陽性表達作為陽性對照,磷酸鹽緩沖液代替一抗作為陰性對照。石蠟塊切片(4 μm厚),60 ℃烤箱中烘烤2 h后進行脫水、脫蠟、抗原修復,3% H2O250 mL洗滌后37 ℃烤箱內烘干25 min,磷酸鹽緩沖液洗滌3次。加1∶500稀釋一抗置入濕盒中4 ℃下孵育過夜。室溫復溫20 min,PBS再洗滌3次,加入二抗37 ℃孵育30 min,二氨基聯苯胺顯色、蘇木素復染10 min、流水洗凈后鹽酸乙醇分化20 s,再次沖洗30 min,脫水透明,二甲苯中性樹膠封片。由2位高年資病理醫師采用雙盲法評估結果。400倍顯微鏡下每張切片隨機選取5個視野,每視野計數100個細胞,計算陽性細胞百分比。陽性細胞百分比<10%計0分,10%~24%計1分,25%~49%計2分,50%~74%計3分,≥75%計4分;染色強度評分:無著色計0分,淺黃色計1分,黃或深黃色計2分,褐或棕褐色計3分;二者相加>2分即為表達陽性。
1.2.2NDRG1、TGF-β1蛋白半定量檢測采用Western blotting法。取新鮮組織標本約100 mg,加500 μL蛋白裂解液后剪碎,冰上靜置30 min,4 ℃、12 000 g離心30 min,BCA定量試劑盒測定蛋白濃度,樣品均定量為6 g/L,每條泳道上樣蛋白量為50 μg,采用12%十二烷基磺酸鈉-聚丙烯酰胺凝膠在電壓70 V條件下進行80 min電泳,電轉移至PVDF膜。5%脫脂奶粉封閉2 h后加入一抗,4 ℃溫度下孵育過夜,TBST洗膜、加入二抗、室溫下孵育2 h,TBST清洗,ECL發光同時進行凝膠顯像儀顯像后采用Quantity One軟件分析灰度值。
1.2.3NDRG1、TGF-β1mRNA檢測采用qRT-PCR法。剪取新鮮結腸癌及癌旁組織標本約100 mg,進行液氮物理研磨,按TRIzol步驟進行細胞株總RNA的分離、純化,依據逆轉錄/擴增試劑盒說明書進行逆轉錄及擴增實驗,反應體系:SYBR Green 12.5 μL、DEPC-treated water 8.5 μL、cDNA模板2.0 μL、10 μmol/L的上下游引物各1.0 μL,總體積25 μL;反應條件:94 ℃預變性5 min、94 ℃變性5 s、60 ℃退火20 s、72 ℃延伸10 s,40個循環。所有反應均設復孔,GAPDH作為內參照,△△Ct法進行結果分析。
1.3統計學方法采用SPSS18.0統計學軟件。計量資料用±s表示,兩組比較采用t檢驗,多組比較采用單因素方差分析;計數資料的比較采用χ2檢驗。NDRG1與TGF-β1的相關性采用Spearman-rank相關分析。P<0.05為差異有統計學意義。
2結果
2.1結腸癌組織及癌旁組織中NDRG1、TGF-β1蛋白陽性表達情況NDRG1、TGF-β1蛋白陽性染色位于細胞質。結腸癌組織中NDRG1、TGF-β1蛋白陽性表達率分別為67.95%(53/78)、73.08%(57/78),癌旁組織中分別為21.79%(17/78)、34.62%(27/78),結腸癌組織中NDRG1、TGF-β1蛋白陽性表達率高于癌旁組織(P均<0.05)。
2.2結腸癌組織中NDRG1、TGF-β1蛋白陽性表達與臨床病理參數的關系結腸癌組織中NDRG1、TGF-β1的蛋白陽性表達與患者性別、年齡、腫瘤位置、病理分型、病理類型無關,而與腫瘤直徑、浸潤深度、淋巴結轉移、分化程度和Dukes分期有關(P均<0.05),見表1。
2.3結腸癌組織中NDRG1、TGF-β1蛋白陽性表達的相關性Spearman rank相關分析結果顯示,結腸癌組織中NDRG1與TGF-β1的蛋白陽性表達率呈正相關(r=0.231,P<0.05)。
2.4結腸癌組織及癌旁組織中NDRG1、TGF-β1蛋白相對表達量結腸癌組織中NDRG1蛋白、TGF-β1蛋白相對表達量0.864±0.219、0.769±0.425,癌旁組織中分別為0.323±0.104、0.317±0.154,結腸癌組織中NDRG1、TGF-β1蛋白表達量高于癌旁組織(P均<0.05)。
2.5結腸癌組織及癌旁組織中NDRG1、TGF-β1mRNA的相對表達量結腸癌組織中NDRG1與TGF-β1mRNA的相對表達量分別為1.367±0.281、1.379±0.326,癌旁組織分別為0.663±0.183、0.538±0.217,結腸癌組織中NDRG1、TGF-β1mRNA的表達水平高于癌旁組織(P均<0.05)。
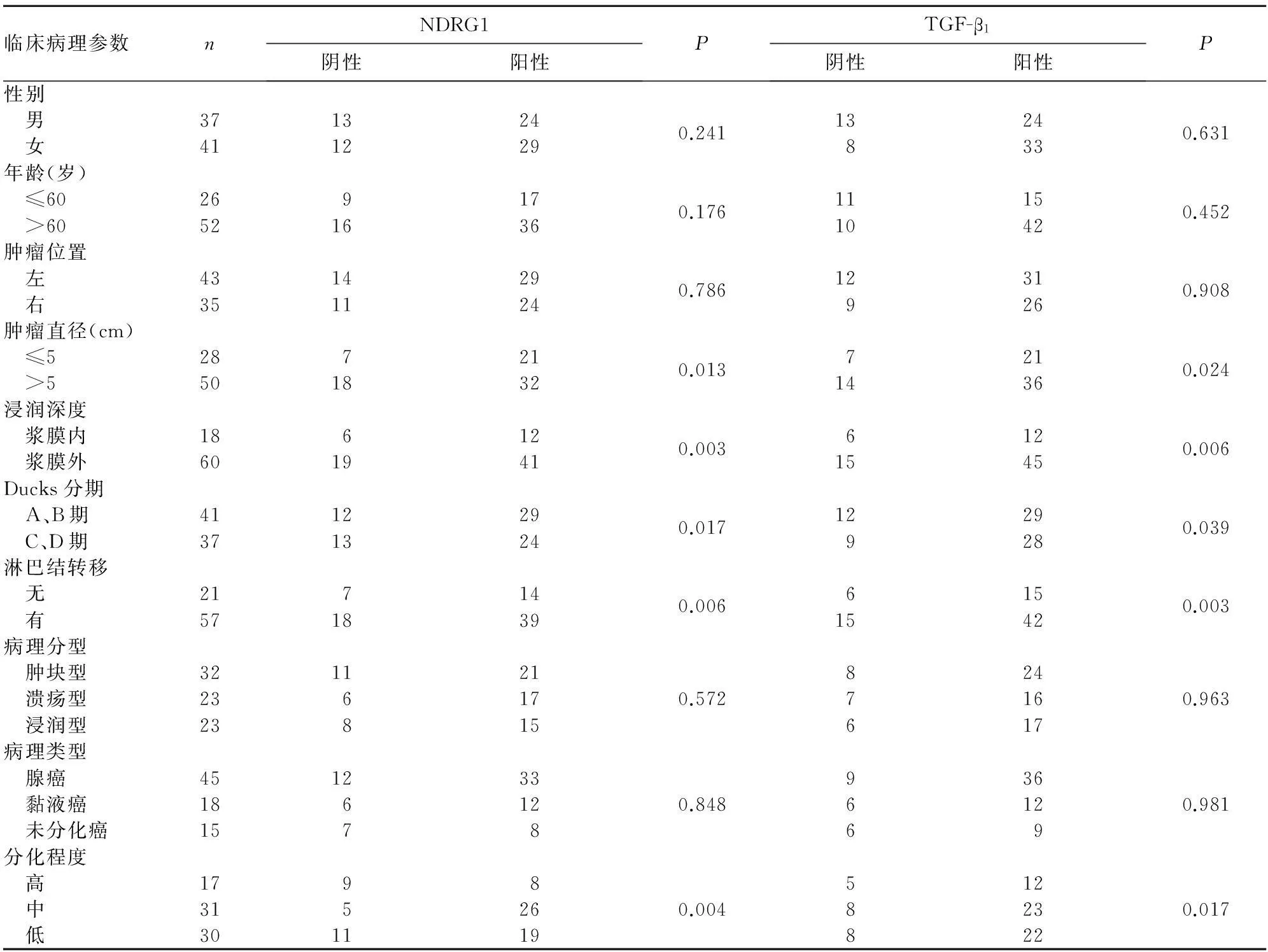
表1 結腸癌組織中NDRG1、TGF-β 1蛋白陽性表達與臨床病理參數的關系(例)
3討論
結直腸癌發病率以每年3%~10%速度增長,死亡率居我國惡性腫瘤第5位,浸潤及轉移是結腸癌死亡的主要原因[4]。手術切除是結腸癌治療的主要手段,早期發現和早期診斷是提高結腸癌根治性手術切除率及生存期的基礎,對結腸癌相關基因的篩查及治療靶點的選擇是目前研究的方向。
NDRG1在不同惡性腫瘤細胞及不同種族人群表達水平有區別[5],在腫瘤發展的不同階段表達水平也不同。有研究結果顯示,在肺癌A549細胞NDRG1過表達會逆轉TGF-β1對A549細胞Snail表達的誘導作用。TGF-β1通過Smad信號通路調控Snail表達,促進p-Smad、p-AKT磷酸化。但是,過表達NDRG1明顯抑制AKT磷酸化,但對Smad磷酸化卻無影響,可見NDRG1只參與TGF-β1對AKT的調控,從而抑制Snail表達。NDRG1對AKT的抑制可能與NDRGl調控PTEN表達相關[6]。研究結果顯示,NDRG1與胰腺癌的惡性行為呈正相關,其表達上調提示胰腺癌的不良預后[7]。在肝細胞癌中,NDRG1可能通過AKT信號通路調控TGF-β1表達,從而促進惡性腫瘤上皮間質轉化(EMT)形成[8]。在Ⅰ、Ⅱ期宮頸腺癌組織中NDRG1高表達促進腫瘤血管發生、發展,從而縮短患者的生存時間,并提示愈后不良[9]。NDRG1 mRNA和蛋白在中等分化胰腺癌細胞Capan-1中因缺氧上調,在分化差的Panc-1細胞系中無變化,NDRG1對胰腺癌細胞分化程度具有標志物作用。但也有研究結果與其相反,可能在不同分化階段及缺氧程度不同的條件下,NDRG1表現為抑癌及促癌雙重作用[10]。TGF-β1可激活細胞內多條信號通路對細胞生物學行為進行調節[11]。TGF-β1信號通路活化與腫瘤發生及發展密切相關,在不同條件下也表現出促癌或抑癌雙重作用。在正常上皮細胞中,TGF-β1通過誘導細胞周期蛋白依賴性激酶抑制因子而抑制細胞增殖;而在結腸癌細胞,TGF-β1會誘導腫瘤細胞EMT、轉移及浸潤,自抑癌向促癌活性轉變[12]。TGF-β1在結腸癌HaCaT細胞中從轉錄水平即直接激活NDRG1表達,并通過Smad2、Smad3及Smad4的轉錄調節活性激活NDRG1轉錄,Sp1過表達會進一步提高TGF-β1誘導NDRG1啟動子活性[13]。NDRG1高表達與胰腺癌微血管密度升高具有相關性,進一步提示其促癌活性。多種原因可誘導TGF-β1功能改變,多種因素誘發TGF-β1增殖抑制通路突變失活是主要原因,在結腸癌細胞TGF-β1缺陷修復通路不能有效激活以抑制基因缺陷信號通路,使其自抑癌基因向促癌基因轉變[14]。
本研究結果顯示,NDRG1及TGF-β1在結腸癌組織中表達高于癌旁組織。NDRG1及TGF-β1蛋白的陽性表達與患者性別、年齡、腫瘤位置、病理分型、病理類型無關,而與腫瘤直徑、淋巴結轉移、腫瘤浸潤深度、腫瘤分化程度和Dukes分期有關;NDRG1及TGF-β1表達水平升高提示結腸癌的惡性行為。有研究認為,分化的細胞處于缺氧環境中可表達NDRG1,NDRG1能抑制腫瘤的侵襲及轉移,但隨著缺氧加重,NDRG1可能對腫瘤的生長轉變為促進作用。本研究的病理組織均為進展期結腸癌,而以往的研究多為結腸癌離體細胞水平,腫瘤細胞所處的環境及細胞的生長階段不同,NDRG1表達的生物學特征也有差異[15]。本研究結果提示,結腸癌組織中NDRG1與TGF-β1蛋白的陽性表達率呈正相關性,二者可能在結腸癌病理學特征中具有協同作用;分子生物學研究結果也顯示,NDRG1在結腸癌演變過程中在表觀遺傳學方面的改變會對TGF-β1的功能具有調節作用,NDRG1會通過與靶基因3′端非翻譯區不完全配對,以抑制靶基因mRNA翻譯或降解,從而參與細胞分化、增殖、發育及代謝的生物過程。NDRG1可能參與TGF-β1對細胞周期的調控。本研究結果顯示,結腸癌組織中NDRG1、TGF-β1在蛋白水平及mRNA水平的表達高于癌旁正常組織,這與免疫組化結果一致,提示在mRNA水平即以發生NDRG1及TGF-β1的調控。
綜上所述,NDRG1及TGF-β1在結腸癌組織中高表達,二者的陽性表達與臨床病理指標具有相關性,提示直腸癌的惡性行為及不良預后,可作為結腸癌預后的標志物,是進一步基因治療的靶點之一。
參考文獻:
[1] Chow CJ, Al-Refaie WB, Abraham A, et al. Does patient rurality predict quality colon cancer care: a population-based study[J]. Dis Colon Rectum, 2015,58(4):415-422.
[2] Song Y, Lv L, Du J, et al. Correlation of N-myc downstream-regulated gene 1 subcellular localization and lymph node metastases of colorectal neoplasms[J]. Biochem Biophys Res Commun, 2013,439(2):241-246.
[3] Kim JT, Kim JW, Kang YH, et al. NDRG2 and PRA1 interact and synergistically inhibit T-cell factor/β-catenin signaling[J]. FEBS Lett, 2012,586(22):3962-3968.
[4] Langman G, Patel A, Bowley DM. Size and distribution of lymph nodes in rectal cancer resection specimens[J]. Dis Colon Rectum, 2015,58(4):406-414.
[5] Koshiji M, Kumamoto K, Morimura K, et al. Correlation of N-myc downstream-regulated gene 1 expression with clinical outcomes of colorectal cancer patients of different race/ethnicity[J]. World J Gastroenterol, 2007,13(20):2803-2810.
[6] 劉浩,宋瑩,賀智敏.過表達NDRG1對TGF-β誘導肺癌A549細胞上皮-間質轉化的逆轉作用[J].中國醫師雜志,2015,17(5):710-713.
[7] 張小薄,譚曉冬,王懷濤.NDRG1與MMP-7在胰腺導管腺癌中的表達及意義[J].現代腫瘤醫學,2015,23(13):1859-1862.
[8] Lu WJ, Chua MS, So SK, et al. Suppressing N-Myc downstream regulated gene 1 reactivates senescence signaling and inhibits tumor growth in hepatocellular carcinoma[J]. Carcinogenesi, 2014,35(4):915-922.
[9] 楊成萬,陶明珠,周鐵軍,等.在宮頸腺癌組織中的表達及臨床意義[J].山東醫藥,2014,54(5):15-17.
[10] 劉慶宏,姜琳,孫燦林,等.上調NDRG1基因表達對人胰腺癌細胞MMP-9、VEGF表達及侵襲和遷移的影響[J].中華臨床醫師雜志,2013,25(14):6452-6456.
[11] Mao Z, Sun J, Feng B, et al. The metastasis suppressor, N-myc downregulated gene 1 (NDRG1), is a prognostic biomarker for human colorectal cancer[J]. PLoS One, 2013,8(7):e68206.
[12] Kim EJ, Kang JI, Kwak JW, et al. The anticancer effect of (1S,2S,3E,7E,11E)-3,7,11, 15-cembratetraen-17, 2-olide(LS-1) through the activation of TGF-β signaling in SNU-C5/5-FU, fluorouracil-resistant human colon cancer cells[J]. Mar Drugs, 2015,13(3):1340-1359.
[13] Tong D, Qu H, Meng X, et al. S-allylmercaptocysteine promotes MAPK inhibitor-induced apoptosis by activating the TGF-β signaling pathway in cancer cells[J]. Oncol Rep, 2014,32(3):1124-1132.
[14] Strzelczyk B, Szulc A, Rzepko R, et al. Identification of high-risk stage Ⅱ colorectal tumors by combined analysis of the NDRG1 gene expression and the depth of tumor invasion[J]. Ann Surg Oncol, 2009,16(5):1287-1294.
[15] 何欣蓉,蔡燕,付茂勇,等.磷酸化ERK、TGF-β受體Ⅱ和磷酸化Smad2蛋白在食管癌組織中的表達及意義[J].山東醫藥,2012,52(7):10-11.

