高壓蒸煮烹飪模型中As(Ⅲ)的氧化及其動力學分析*
譚婷婷,王瑛,歐仕益,滕久委
(暨南大學食品科學與工程系,廣東 廣州,510632)
砷是自然界中普遍存在的有毒重金屬。由于環境污染的加劇,以及有機砷農藥的肆意亂用,部分農產品種植或養殖地區的水體和土壤中砷的污染也在加劇,這些砷不可避免地被動植物吸收和富集[1],再經食物鏈進入人體,導致急性或慢性的砷中毒[2]。
砷在食品中以多種形式存在,不同形態的砷化合物,毒性差別也很大,其中無機砷的毒性遠大于有機砷,例如有機砷砷甜菜堿(AsB)的LD50值大于10 000 mg/kg,As(Ⅲ)的 LD50值等于 34.5 mg/kg,兩者毒性相差約300倍[3-4],因此無機砷的去除對于食品安全而言具有重要意義,由于As(Ⅲ)的毒性和移動性遠超As(Ⅴ),因此As(Ⅲ)的氧化是常規除無機砷過程中必不可少的處理步驟[5]。
從人們的日常飲食習慣來看,大部分食物都不是直接食用,往往需要經過一定的加工處理,其中高溫高壓處理是常見的食品加工方式,尤其是我國的主食大米,往往要通過高壓鍋蒸煮才能食用,而一些膨化食品其需要的加熱溫度則更高,所以研究高壓高溫食品中砷的存在形態對于準確評估食品中的砷風險非常有意義。已有的文獻均表明高溫的確會導致砷形態發生變化,Van Elteren等發現,在160℃條件下加熱30 min和24 h后,部分AsB轉化成三甲基砷氧(TMAO)和四甲基砷離子(TMA+),二甲基砷酸(DMA)轉化成一甲基砷酸(MMA)、As(Ⅲ)、As(Ⅴ),MMA 轉化成 As(Ⅲ)和 As(Ⅴ)[6]。之后該作者在更廣的溫度下(85~190℃)對AsB的受熱降解反應進行了更深入的研究,并對該反應的動力學規律進行了分析[7]。但是對于毒性較大的無機砷在加熱條件下的價態變化尚未見有報道,本論文對此進行了研究。
1 材料與方法
1.1 原料及主要試劑
亞砷酸根溶液標準物質(GBW08666),中國計量研究院;砷酸根溶液標準物質(GBW08667),中國計量研究院;食品級穩定態ClO2,廣州穗澤環保科技有限公司;食品級無水Na2SO3,四川三湘精細化工有限公司;食品級H2O2,鄭州德誠生物科技有限公司;NaOH,廣州化學試劑廠;(NH4)2HPO4,天津市大茂化學試劑廠;實驗用水為MilliQ超純水。
1.2 主要儀器設備
MilliQ Acadamic超純水儀,美國Millipore公司;e2695型高效液相色譜儀,美國沃特世公司;Xseris2電感耦合等離子體質譜,美國賽默飛世爾科技公司;T-50.2L溶劑過濾器,天津市津騰實驗設備有限公司;GM-1.0A兩用型隔膜真空泵,天津市津騰實驗設備有限公司;DHG-9145A型電熱恒溫鼓風干燥箱,上海一恒科學儀器有限公司;25 mL水熱合成反應釜,中凱亞不銹鋼制品。
1.3 實驗方法
1.3.1 建立高壓蒸煮烹飪模型
將亞砷酸根溶液標準物質稀釋成500 μg/kg的As(Ⅲ)使用液,取10 mL As(Ⅲ)使用液置于25 mL水熱合成反應釜中,密閉后分別放于120、140、160、180℃的烘箱,通過控制加熱時間與溫度模擬不同程度的高壓蒸煮烹飪(全因素實驗),為更好的分析As(Ⅲ)在空氣介質中的氧化情況以便進行動力學分析,實驗溫度與時間相對于正常烹飪時間溫度有所擴大。
1.3.2 穩定態 ClO2、Na2SO3、H2O2對 As(Ⅲ)氧化的影響
加入適量食品級穩定態 ClO2、Na2SO3和 H2O2于500 μg/kg As(Ⅲ)使用液中,添加物最終濃度為2 mg/L,符合國標規定的限量[8],然后按照上述所建立的高壓蒸煮烹飪模型進行反應。
1.3.3 As(Ⅲ)和As(Ⅴ)標準曲線的繪制
亞砷酸根溶液標準物質和砷酸根溶液標準物質等體積混合稀釋得到100 μg/kg的無機砷混合標液[9],在規定的儀器條件下(見表1)依次吸取5、10、20 μL混合標液進行測定,記錄色譜圖并用數據處理軟件系統Plasma Lab計算峰面積。以峰面積(Y)為縱軸,相應各組分質量濃度(X,μg/kg)為橫坐標,繪制標準曲線及進行線性回歸分析。

表1 HPLC-ICP-MS儀器參數Table 1 Instrumental parameters of HPLC-ICP-MS
1.3.4 砷形態的檢測
加熱2、4、8、32 h 后,取出水熱合成反應釜,放入冰水中快速冷卻,將釜中樣品稀釋至100 μg/kg。樣液透過0.45 μm微孔濾膜后,用HPLC-ICP-MS分別測出As(Ⅲ)和As(Ⅴ)的含量。
2 結果與討論
2.1 無機砷混合標液的分離結果與線性方程
在規定工作條件下,混合標液的出峰順序依次為As(Ⅲ)、As(Ⅴ),且7 min內2種砷形態完全分離(見圖1)。
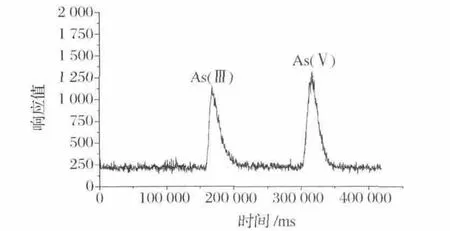
圖1 無機砷混合標液的色譜圖Fig.1 HPLC-ICP-MS chromatogram forinorganic arsenic mixed standard solution
對分離色譜圖上的As(Ⅲ)和As(Ⅴ)的峰面積與對應濃度進行線性回歸,發現線性擬合良好,相關系數均在0.999以上(表2)。

表2 As(Ⅲ)和As(Ⅴ)的線性方程及相關系數Table 2 Linear regression equation and correlation coefficient of As(Ⅲ)& As(Ⅴ)
2.2 高壓蒸煮烹飪模型
2.2.1 不同加熱溫度和時間對As(Ⅲ)氧化的影響
As(Ⅲ)水溶液在不同加熱溫度和時間的高壓蒸煮模型下反應,結果如表3所示。
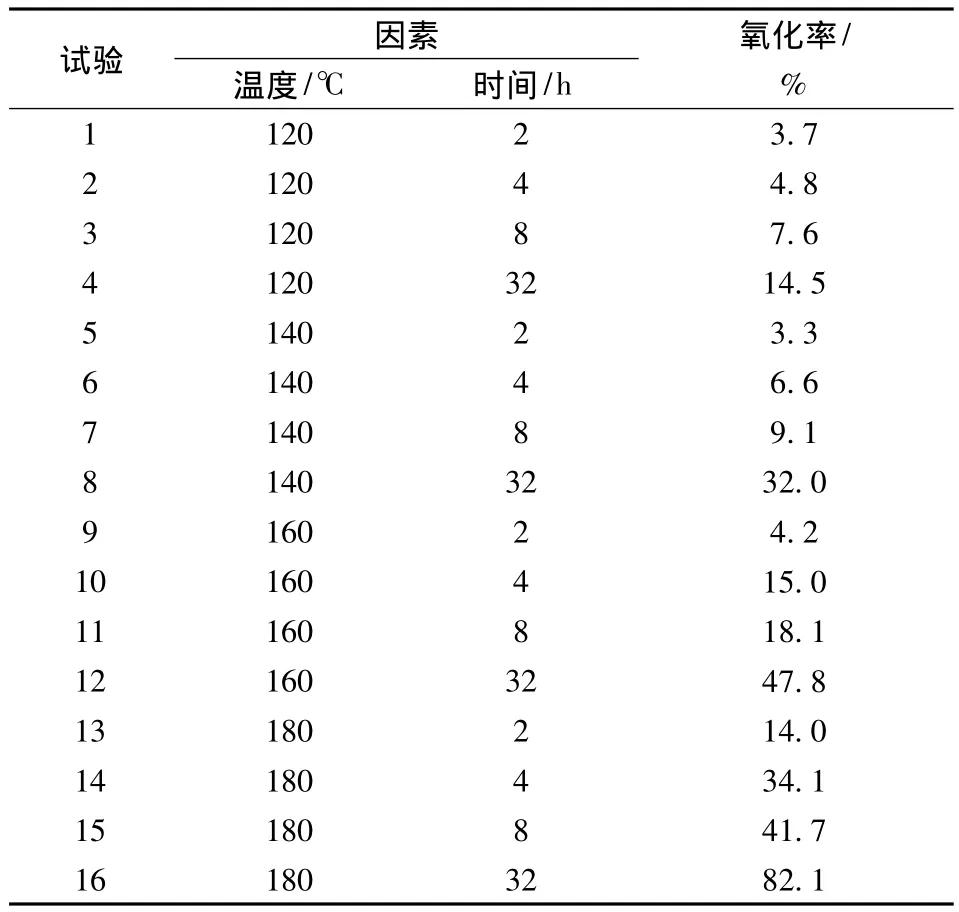
表3 As(Ⅲ)氧化實驗結果Table 3 The results of As(Ⅲ)oxidation
由于高溫加熱使得部分砷附著在瓶壁上不易洗脫,造成反應后總砷量減少。所以為了更為準確的反映As(Ⅲ)的氧化,這里定義反應后測得的As(Ⅴ)的量占As(Ⅲ+Ⅴ)總量的百分比為反應物As(Ⅲ)的氧化率。從表3中可以發現,加熱時間相同時,溫度越高,As(Ⅲ)的濃度越小,這說明As(Ⅲ)的氧化速率隨溫度的升高而加快。為得到具體的氧化速率常數,更為直觀的體現As(Ⅲ)氧化受溫度的影響,將表3所得數據進一步進行動力學分析。
2.2.2 As(Ⅲ)氧化一級動力學分析
佟殿鑫[10]對As(Ⅲ)水溶液在不同溫度下被空氣氧化的速率分別進行過一級動力學和二級動力學的擬合實驗,發現一級動力學模型更符合描述As(Ⅲ)被空氣氧化的速率曲線。因此本文選擇對測得的數據進行一級動力學擬合。即As(Ⅲ)的濃度應滿足一級反應速率方程Inc= -kt+B,其中c表示反應物濃度,k表示速率常數,t表示時間,B表示積分常數[10-11],即反應物濃度的對數值,與時間有線性關系(圖3),且Inc-T直線斜率的絕對值就是反應速率常數k值。
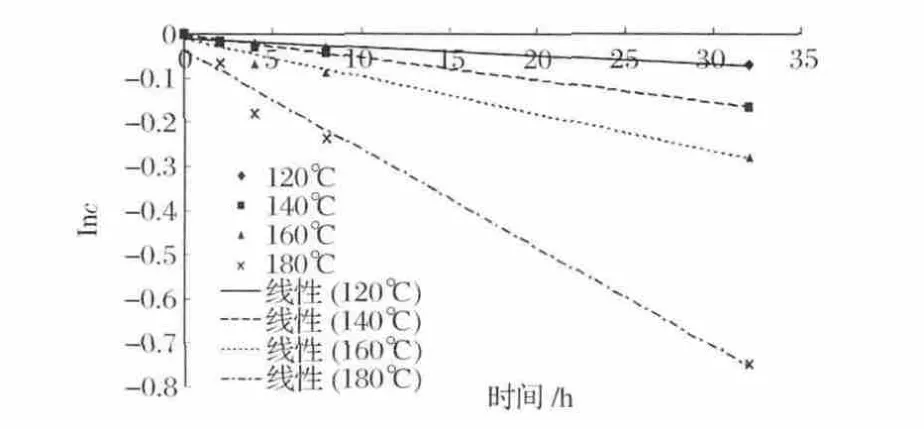
圖2 As(Ⅲ)濃度的對數值—時間的線性關系Fig.2 Linear relation of logarithm of concentration of As(Ⅲ)and time
于是以As(Ⅲ)濃度的對數值為縱坐標,時間為橫坐標,按照上述速率方程進行擬合,結果如表4所示。各溫度的一級動力學擬合程度良好。而且隨著溫度的升高,反應速率常數k值也隨之增大,說明As(Ⅲ)的氧化反應是個吸熱反應,溫度的升高能使反應速率加快,這也符合Arrehenius方程的結論[11]。

表4 不同溫度下一級動力學擬合結果Table 4 Results fitted by first order kinetic model at different temperatures
2.2.3 穩定態ClO2、Na2SO3、H2O2對As(Ⅲ)氧化的影響
食品在工業生產過程中,除了物理加工外,往往還會接觸一些食品添加劑和食品工業用加工助劑,這些物質或多或少也會影響到As(Ⅲ)的氧化。穩定態ClO2和Na2SO3具有漂白、殺菌、保鮮等作用,作為食品添加劑,其應用歷史悠久[12-13]。而H2O2作為氧化劑、漂白劑和殺菌劑[14]也被最新國標 GB2760-2014重新納入了食品工業用加工助劑。加入這3種物質后,高壓蒸煮烹飪模型中As(Ⅲ)的氧化速率如圖4所示。從圖4中可以發現,穩定態ClO2和H2O2呈現出較強氧化性,尤其是H2O2,其最高氧化率達到了99.8%,幾乎將As(Ⅲ)完全氧化成了As(Ⅴ),穩定態 ClO2的最高氧化率只有 H2O2的一半為52.1%。而Na2SO3則呈現出還原性,會抑制As(Ⅲ)的氧化,加入Na2SO3后As(Ⅲ)的最大氧化速率由14.5%降低到了6.9%。
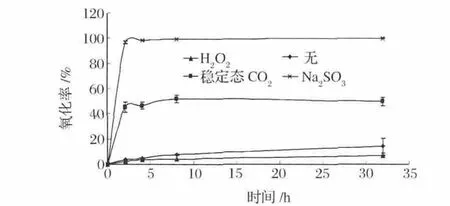
圖 3 ClO2、H2O2、Na2SO3對 As(Ⅲ)氧化的影響Fig.3 The effect of ClO2、H2O2、Na2SO3to As(Ⅲ)oxidation
3 結論
本試驗采用HPLC-ICP-MS方法檢測了高壓蒸煮烹飪模型中As(Ⅲ)和As(Ⅴ)的濃度,分別繪制出這2種物質的標準曲線圖,相關系數均在0.999以上。通過對120、140、160、180 ℃條件下 As(Ⅲ)的氧化速率進行一級動力學分析,算出反應速率常數k120℃、k140℃、k160℃、k180℃分別為 1.9 ×10-3、5.1 ×10-3、8.5×10-3、2.2 ×10-2h-1,說明升高溫度可以加快 As(Ⅲ)的氧化速率。食品中可能存在的ClO2和H2O2對As(Ⅲ)氧化有促進作用,而Na2SO3則會抑制As(Ⅲ)氧化。
[1] 齊慧,賈瑞琳,陳銘學.食品中砷形態分析研究進展[J].中國農學通報.2012,28(36):277-281.
[2] Ohno K,Yanase T,Matsuo Y,et al.Arsenic intake via water and food by a population living in an arsenic affected area of Bangladesh[J].Science of Total Environment,2007,381(1-3):68-76.
[3] FAO/WHO.Joint FAO/WHO Food Standards Programme Codex Committee Additives and Contaminants[S].1997.
[4] Eisler R.Arsenic hazards to humans,plants,and animals from gold mining[J].Reviews of Environmental Contamination and Toxicology.2004,180:133-165.
[5] 李莉.堿性體系下As(Ⅲ)的催化氧化[D].長沙:中南大學,2009:8-11.
[6] Van Elteren J T,?lejkovec Z.Ion-exchange separation of eight arsenic compounds by high performance liquid chromatography-UV decomposition hydride generation atomic fluorescence spectrometry and stability tests for food treatment procedures[J].Journal of Chromatography A,1997,789(1/2):339-348.
[7] Devesa V,Martinez A,Sú?er,M A,et al.Kinetic study of transformations of arsenic species during heat treatment[J].Journal of Agricultural and Food Chemistry.2001,49(5):2 267-2 271.
[8] GB2760-2014.食品安全國家標準食品添加劑使用標準[S].
[9] 云洪霄,張磊,李筱薇,等.大米中無機砷測定方法的研究[J].衛生研究,2010,39(3):316-320.
[10] 佟殿鑫.砷在針鐵礦表面的吸附和在水溶液中的均相氧化動力學[D].北京:北京化工大學.2011:39-45.
[11] 石朝周.物理化學[M].北京:中國醫藥科技出版社,2002:222-227.
[12] 李雪蓮,楊麗,陳鴻平,等.食品中亞硫酸鹽研究進展[J/OL].亞太傳統醫藥,2015(3).http://www.cnki.net/kcms/detail/42.1727.R.20150203.1639.014.html
[13] 陸清,莊建君.不同ClO2產品在食品工業中的應用與選擇[J].食品研究與開發,2012(33):231-233.
[14] 石晶,王金美,孟一娟,等.食品級H2O2及其在食品工業中的應用[J].中國食品添加劑,2009(4):62-64.

