華法林個體化劑量與CYP2C9/VKORC1基因組之間的關系
林善明,李增棋,王 航,陳 昆,余 毅,王長連
華法林是一類含有4-羥基香豆素基本結構的抗凝血藥,通過抑制維生素K依賴的相關凝血因子的合成而發揮作用,臨床上主要用于血栓栓塞的預防。但華法林治療安全范圍窄,個體用藥劑量差別大,用藥劑量很難掌握[1]。目前,臨床上主要通過定期監測凝血酶原時間(prothrombin time,PT)、國際標準化比值(international normalized ratio,INR)來調整華法林的用藥劑量。心外科換瓣手術后患者以INR波動于1.8~2.5時抗凝效果最佳,出血、栓塞等風險較低。近年來研究表明,華法林代謝相關的基因多態性如細胞色素氧化酶P450 2C9*1/*3(cytochrome P450 2C9*1/*3,CYP2C9*1/*3)、維生素K環氧化物還原酶復合體亞單位1-1639A/G(VKORC1-1639A/G)與個體間華法林維持劑量差異具有重要關系[2-5]。
本研究擬通過PCR-雜交技術對患者進行CYP2C9*1/*3、VKORC1-1639A/G 基因分型,評估年齡、性別、體質量指數(bady mass index,BMI)、VKORC1-1639A/G和CYP2C9*1/*3基因型等變量與華法林抗凝劑量之間的關系,建立一個適合福建人群的基因組學的華法林給藥模型預測劑量公式,指導華法林個體化用藥。
1 對象與方法
1.1 對象 收集2013年11月—2015年2月就診筆者醫院的患者119例,男性50例,女性69例,年齡(54.7±17.7)歲(12~80歲)。納入標準:規律服用相同劑量華法林鈉片(商品名:瑪爾維,芬蘭奧立安公司)3月,并且連續監測3次INR均波動于1.8~2.5的福建籍漢族患者,其中心臟瓣膜置換術后患者86例,心房顫動患者24例,血栓栓塞患者9例(表1)。
排除標準:嚴重肝功能不全[丙氨酸氨基轉移酶(alanine aminotransferase,ALT)>8~10ULN或者ALT>3ULN且血清總膽紅素>2ULN];嚴重腎功能不全(當內生肌酐清除率下降到20mL/min以下,血尿素氮水平17.9~21.4mmol/L,血肌酐≥442μmol/L);甲狀腺功能異常;腫瘤患者;結締組織疾病;心力衰竭患者(慢性心功能不全:心功能Ⅳ級);妊娠;同時服用與華法林藥效動力學及藥物動力學相互作用的藥物(詳見藥品說明書)。
1.2 試劑 血液基因組DNA提取試劑盒(DP333,北京天根生化公司);PCR產物測序(上海生工生物工程有限公司);PCR引物合成(上海百傲科技有限公司);CYP2C9和VKORC1基因多態性檢測試劑盒(PCR-芯片雜交法)(注冊號:3401328,上海百傲科技有限公司)。
1.3 儀器 全自動血凝分析儀(STA-R Evolution,北京思塔高診斷產品貿易有限責任公司);雙光束紫外可見分光光度計(TU1901,北京普析通用儀器有限責任公司);基因芯片圖像分析軟件(V2.0,上海百傲科技有限公司);生物芯片識讀儀(BE2.0,上海百傲科技有限公司);e-Hyb全自動雜交儀(BR-526-24型,上海百傲科技有限公司);PCR儀(Thermal cycler T100,美國Bio-Rad公司);高速離心機(Pico21,美國Thermo公司);電熱恒溫振蕩水槽(DKZ-2型,上海精宏實驗設備有限公司)。
1.4 方法 采集靜脈血用于檢測INR、VKORC1及CYP2C9基因型。記錄患者信息:年齡、性別、身高、體質量、肝腎功能及華法林穩態劑量。
1.4.1 INR值測定 采集空腹枸櫞酸鈉抗凝靜脈血2mL,用全自動血凝分析儀檢測PT(黏度法又稱磁珠法),自動計算得出INR值。
1.4.2 基因型測定
1.4.2.1 采樣及DNA擴增 入選患者采集全血于EDTA抗凝管中,24h內用吸附柱法提取DNA,以紫外法檢測DNA純度及濃度。精密吸取符合條件的DNA模板10μL,加入擴增液與反應液,在25μL體系中擴增:50℃預變性5min→94℃變性30s→72℃退火延伸30s→35次循環→72℃延伸5min。PCR反應后產物于2~8℃保存。
1.4.2.2 雜交反應和基因分型 以上PCR產物加入雜交緩沖液,與抗體和顯色劑交于基因芯片上進行圖像掃描與數據分析,輸出檢測結果。根據檢測結果,CYP2C9可分為下列6種基因型:*1/*1(*2CC/*3AA)、*1/*2(*2CT/*3AA)、*1/*3(*2CC/*3AC)、*2/*2(*2TT/*3AA)、*2/*3(*2CT/*3AC)、*3/*3(*2CC/*3CC);VKORC1可分為下列3種基因型 VKORC1-1639GG、VKORC1-1639GA、VKORC1-1639AA。
1.5 統計學處理 數據采用SPSS 18.0統計軟件處理,結果以±s表示,不同性別、不同基因型之間華法林劑量比較用兩樣本t檢驗,P<0.05為差別具有統計學意義。用Pearson相關系數來分析華法林劑量與年齡、BMI的相關關系。多元線性回歸用于分析華法林劑量與各變量之間的關系構建華法林劑量給藥模型,P<0.05為差別具有統計學意義。
2 結 果
2.1 性別與華法林劑量的關系 采用兩樣本t檢驗分析,男性華法林用量為(3.00±1.06)mg/d,女性為(2.80±0.96)mg/d,性別對華法林穩態劑量影響差別無統計學意義(t=0.735,P>0.05)。
2.2 年齡和BMI與華法林的劑量關系 采用Pearson線性相關初步分析,華法林劑量與年齡負相關(r=-0.276,P=0.030),而與 BMI正相關(r=0.142,P=0.029)。
2.3 CYP2C9和VKORC1基因多態性與華法林的劑量關系 在VKORC1基因型檢測結果中,GG基因型出現2例,華法林用量均為7.5mg/d,統計學上不能代表一個分組,所以剔除該值。由于在中國漢族人群的不存在CYP2C9*2型突變,CYP2C9*3型突變較少(1%~3%)[6-7],筆者在基因檢測過程中也未檢測到*3*3基因型。因此,所建立的模型中CYP2C9基因只包含了*1*3和*1*1基因型,VORC1基因只包含了AA和GA基因型。采用兩樣本t檢驗初步分析,尚不能認為CYP2C9和VKORC1不同基因型與華法林劑量之間差別存在統計學意義(P>0.05,表1)。
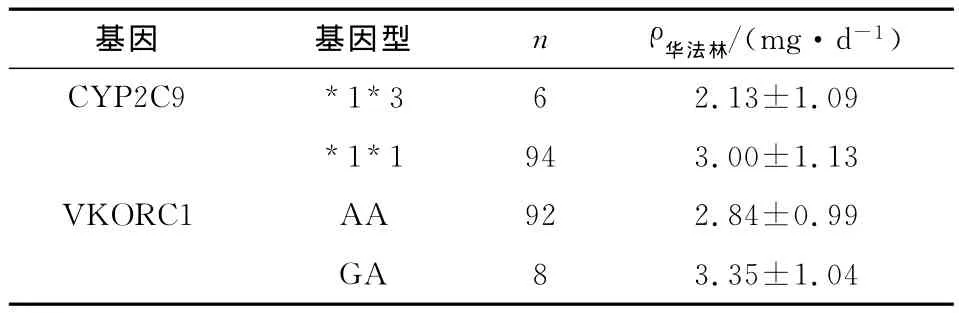
表1 不同基因型間華法林劑量差異比較Tab 1 Differences in warfarin dose for each genotype
2.4 建立多元線性回歸分析模型 經年齡、性別、BMI調整后的多變量模型,采用多元線性回歸分析,模型中包含年齡、BMI、CYP2C9和VKORC1基因型,多元線性回歸方程的建立采用逐步納入法,并進行驗證,可以將CYP2C9(P=0.039)和 VKORC1(P=0.023)基因型納入方程,納入后模型更穩定,預測力更強,排除了性別(P=0.254)與疾病種類(P=0.465)因素,該模型能夠最好的估計華法林劑量(r2=0.212,P=0.013,表2),得出最終回歸方程為:
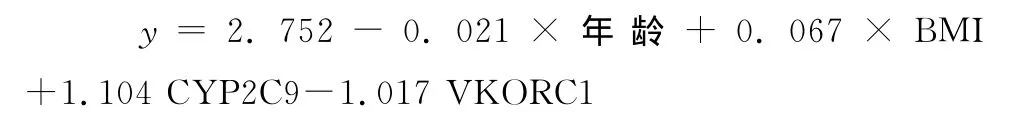
在方程中,年齡為歲數,BMI=體質量/身高^2(體質量為kg,身高為 m),CYP2C9基因型是*1*1為1,基因型是*1*3為0,VKORC1基因型是AA為1,基因型是GA為0。
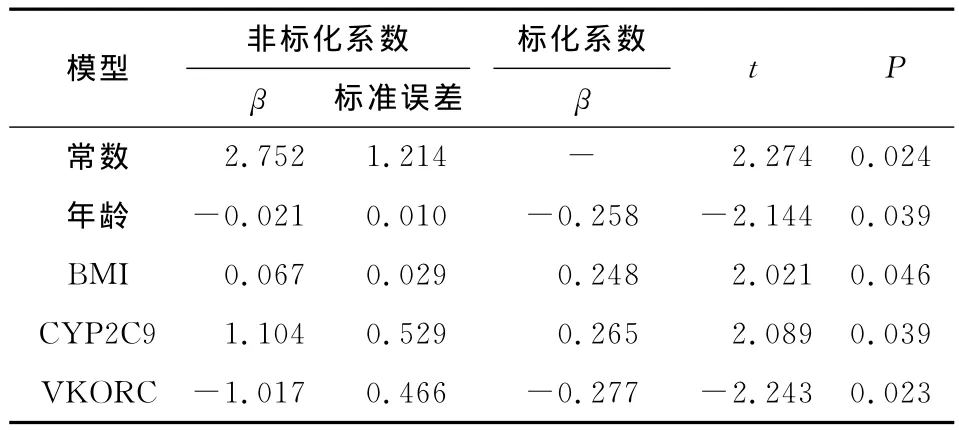
表2 多元線性回歸方程的系數Tab 2 The coefficients of multivariante equation of linear regression
3 討 論
華法林抗凝治療(特別是在抗凝治療初期)經常出現用藥過量導致出血的風險,并且很難預測給藥劑量。這項研究旨在結合患者年齡、BMI、CYP2C9和VKORC1基因型因素預測華法林穩態時給藥劑量,用以有效指導臨床用藥。
筆者采用兩樣本t檢驗,提示暫不能認為CYP2C9和VKORC1不同基因型與華法林劑量之間存在顯著差異,但采用逐步納入法建立的多元線性回歸模型,并對其進行驗證得知納入基因型后模型更穩定,預測力更強。在男性和女性患者中華法林穩態劑量無統計學意義,性別對多元線性回歸的統計學模型依舊沒有做出顯著貢獻。因此,所建立的多元線性回歸模型中包含了年齡、BMI、CYP2C9(*1/*3和*1/*1)和 VKORC1(AA和 GA)基因多態性,排除了性別因素,該模型能有效解釋了約21.2%的華法林個體間穩態劑量差異。
對映體S-華法林約比R-華法林抗凝有效5倍,原因主要是在肝臟經CYP2C9代謝。野生型CYP2C9*1兩個主要突變CYP2C9*2和CYP2C9*3,導致酶活性降低,華法林代謝減慢,最終個體抗凝所需的華法林劑量偏低[8],從建立的多元線性回歸方程可知,CYP2C9*1*3基因型的穩態劑量會相對低于*1*1基因型。
華法林通過抑制VKOR,從而阻止維生素K的反復利用,致使維生素K依賴的凝血因子停留于無凝血活性的前體階段而發揮抗凝作用。VKORC1是編碼VKOR的一個重要亞單位基因,其啟動子區的1639G>A基因多態性可導致華法林個體劑量差異[9]。由于VKORC1GA基因型的啟動子活性高于AA型,最終導致VKORC活性增高,表現為華法林抵抗,因此需要更大劑量的華法林來達到目標INR,所以VKORC1-1639GA比AA基因型所需華法林劑量高,這與筆者建立的模型是一致的。
本研究發現,大約有78.8%的個體劑量差異不能通過此模型解釋。其他的伴隨疾病、藥物影響、飲食結構、日常生活習慣(如吸煙、飲酒等)及超過30種與華法林代謝相關的基因等可能導致這種個體差異[10]。如編碼維生素K氧化酶CYP4F2的基因、編碼微粒體中維生素K環氧化物還原酶EPHX1的基因突變等,均能導致華法林用藥的個體差異[11-12],需要更進一步的研究。
由于心臟瓣膜術后患者較房顫、血栓栓塞等患者對華法林更為敏感[13],不能單純依靠所建立的模型和相關算法來指導華法林用藥,因此術后仍需反復監測PT及INR來幫助臨床醫生調整相應華法林用量。
[1]Anderson J L,Horne B D,Stevens S M.Randomized trial of genotype-guided versus standard warfarin dosing in patients initiating oral anticoagulation[J].Circulation,2007,116(22):2563-2570.
[2]Klein T E,Altman R B,Gage B F,etal.Estimation of the warfarin dose with clinical and pharmacogenetic data[J].N EnglJMed,2009,360(8):753-764.
[3]Ohno M,Yamamoto A,Ono A,etal.Influence of clinical and genetic factors on warfarin dose requirements among Japanese patients[J].EurJClinPharmacol,2009,65(11):1097-1103.
[4]Wen M S,Lee M T M,Chen J J,etal.Prospective study of warfarin dosage requirements based on CYP2C9and VKORC1 genotypes[J].ClinpharmacolTher,2008,84(1):83-89.
[5]Miao L Y,Yang J,Huang C R,etal.Contribution of age,body weight,and CYP2C9and VKORC1genotype to the anticoagulant response to warfarin:proposal for a new dosing regimen in Chinese patients[J].EurJClinPharmacol,2007,63(12):1135-1141.
[6]Yuan H Y,Chen J J,Lee M T,etal.A novel functional VKORC1promoter polymorphism is associated with inter-individual and inter-ethnic differences in warfarin sensitivity[J].HumMolGenet,2005,14(13):1745-1751.
[7]Huang S W,Chen H S,Wang X Q,etal.Validation of VKORC1and CYP2C9genotypes on interindividual warfarin maintenance dose:aprospective study in Chinese patients[J].PharmacogenetGenomics,2009,19(3):226-234.
[8]Wadelius M,Chen L Y,Eriksson N,etal.Association of warfarin dose with genes involved in its action andmetabolism[J].HumGenet,2007,121(1):23-34.
[9]Taube J,Halsall D,Baglin T.Influence of cytochrome P-450 CYP2C9polymorphisms on warfarin sensitivity and risk of over-anticoagulation in patients on long-term treatment[J].Blood,2000,96(5):1816-1819.
[10]Wadelius M,Chen L Y,Downes K,etal.Common VKORC1 and GGCX polymorphisms associated with warfarin dose[J].Pharmacogenomics,2005,5(4):262-270.
[11]McDonald M G,Rieder M J,Nakano M,etal.CYP4F2is a vitamin K1oxidase:an explanation for altered warfarin dose in carriers of the V433mvariant[J].MolPhar-macol,2009,75(6):1337-1346.
[12]Issac M S,El-Nahid M S,Wissa M Y,etal.Is there a role for MDR1,EPHX1and protein Z gene variants in modulation of warfarin dosage?A study on a cohort of the egyptian population[J].MolDiagnTher,2014,18(1):73-83.
[13]Rahman M,BinEsmael T M,Payne N,etal.Increased sensitivity to warfarin after heart valve replacement[J].Ann Pharmacother,2006,40(3):397-401.

