解酒保肝活菌飲料的發酵工藝*
洪金艷,李洪軍,2,賀稚非,2,鄧澤麗,陳康
1(西南大學食品科學學院,重慶,4007150)2(重慶市農產品加工技術重點實驗室,重慶,400715)
葛花(Flos puerariae)是豆科植物甘葛藤、野葛的花[1],是傳統的解酒醒脾中藥。葛花中含有黃酮類化合物、皂苷類化合物、揮發油類化合物、氨基酸、甾醇類化合物、生物堿等活性物質[2],具有解酒保肝[3]、保護胃腸道[4]、調節血糖血脂[5]、抗過敏[6]、消除活性氧和保護細胞[7]等作用。枳椇又稱拐棗、金鉤子、萬壽果等,為鼠李科(Rhamnaceae)枳椇屬(Hovenia thunb.)落葉喬木,枳椇子為枳椇的果實或種子,是傳統的解酒醒脾中藥[8]。國內外學者已經從枳椇子中分離出70多種成分,如黃酮類化合物、三萜皂苷類化合物、生物堿類化合物、多糖類化合物等[9-10]。并研究發現,枳椇子具有解酒保肝[11]、抗脂質過氧化[12]、抗突變抗腫瘤[13]、調理胃腸道[14]、抑制組胺釋放、增強綜合體能[12]等作用。本研究采用植物乳桿菌發酵葛花與枳椇子的提取液,優化發酵型解酒保肝活菌飲料的發酵工藝,為葛花與枳椇子的利用開發和發酵型解酒保肝活菌飲料的生產提供依據。
1 材料與方法
1.1 材料
1.1.1 材料與試劑
葛花,廣西玉林;枳椇子,湖北恩施;脫脂奶粉,內蒙古伊利實業集團股份有限公司;植物乳桿菌,韓國圃美多公食品有限司;葡萄糖,蔗糖,NaOH,蛋白胨,牛肉膏,酵母膏,K2HPO4·3H2O,檸檬酸二銨,CH3COONa,吐溫 -80,MgSO4·7H2O,MnSO4·4H2O,瓊脂,NaNO2,Al(NO3)3,蘆丁(98%)。
1.1.2 儀器設備
HH-W4型數顯恒溫水浴鍋,上海赫田科學儀器有限公司;SS-325型高壓滅菌鍋,日本 TOMY公司;DHP-9272型電熱恒溫培養箱,上海齊欣科學儀器有限公司;DHG-9240A型電熱恒溫鼓風干燥箱,上海齊欣科學儀器有限公司;UB-7型pH計,德國Sartorius AG公司;UV-2450型紫外可見分光光度計,日本島津公司;YP2001N型電子天平(感量2 000 g),上海舜宇恒平科學儀器有限公司;FA2004型分析天平(感量0.000 1 g),上海精密科學儀器有限公司;DL-1型萬用電爐,北京市中興偉業儀器有限公司;103B型高速中藥粉碎機,瑞安市永歷制藥機械有限公司;SW-CJ-1F型超凈工作臺,江蘇蘇凈安泰空氣技術有限公司。
1.2 實驗方法
1.2.1 工藝流程

1.2.2 操作要點
1.2.2.1 菌種的活化、馴化及發酵劑的制備[15-17]
在無菌環境下,分別將少量植物乳桿菌PMO菌種純菌粉接種于滅菌后的10%脫脂乳粉液中,在其最適生長溫度下活化,傳代3次,使其活力達到正常。將活化好的菌種接種于不同比例的脫脂乳粉與提取液的混合液中逐步馴化,馴化過程見表1。在提取液中加入6%的葡萄糖,殺菌后加入3%馴化后的菌種,在最適溫度下培養制成發酵劑。接種馴化后的菌種于MRS固體培養基,用液體石蠟液封,4℃保藏待用。
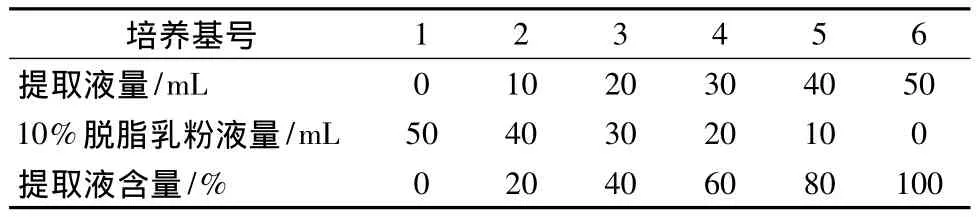
表1 馴化培養基的制備Table 1 The preparation of domestication culture medium
1.2.2.2 提取液的制備
挑取優質的葛花和枳椇子,按葛花與枳椇子質量比為2∶1,料液比1∶21稱取加水浸泡30 min后,在電爐上煮沸84 min,過濾得濾液,加同量的水再次提取,過濾得濾液,合并濾液待用。
1.2.2.3 混合、殺菌
在50 mL提取液中加入6%糖(蔗糖與葡萄糖為3∶2)作為碳源,混合均勻,70℃保溫30 min殺菌。
1.2.2.4 接種、發酵
按無菌操作要求,將馴化培養得到的發酵劑接入殺菌冷卻后的提取液中,然后于恒溫培養箱中發酵,16 h后取出放置在4℃低溫條件下冷藏。
1.2.3 發酵工藝條件的確定
1.2.3.1 發酵單因素試驗
葡萄糖與蔗糖比例的確定:稱取6%的糖(蔗糖與葡萄糖比例分別為 1∶3、2∶3、1∶1、3∶2、3∶1)加入 50 mL提取液中,70℃保溫30 min后,冷卻到35~40℃,在超凈工作臺上按照3%的比例將發酵劑接種于提取液中,于37℃的恒溫培養箱中培養16 h。每個比例做3個平行,然后對發酵飲料的活菌數對數值、總酸含量、pH、總黃酮含量及感官進行分析,以探討葡萄糖與蔗糖的添加比例對飲料發酵工藝的影響(以下每項單因素試驗均設3個平行,并進行同類項目檢測及分析。)。
接種量的確定:稱取6%的糖(蔗糖與葡萄糖比例為3∶2)加入50 mL提取液中,70℃保溫30 min后,冷卻到35~40℃,在超凈工作臺上分別按照2%、3%、4%、5%、6%的比例將發酵劑接種于提取液中,然后放置在37℃的恒溫培養箱中培養16 h。
發酵溫度的確定:稱取6%的糖(蔗糖與葡萄糖比例為3∶2)加入50 mL提取液中,70℃保溫30 min后,冷卻到35~40℃,在超凈工作臺上按照3%的比例將發酵劑接種于提取液中,然后分別放置在35、37、39、41、43 ℃的恒溫培養箱中培養 16 h。
發酵時間的確定:稱取6%的糖(蔗糖與葡萄糖比例為3∶2)加入50 mL提取液中,70℃保溫30 min后,冷卻到35~40℃,在超凈工作臺上按照3%的比例將發酵劑接種于提取液中,然后放置在37℃的恒溫培養箱中分別培養 2、4、6、8、10、12、14、16、18、20 h。
糖添加量的確定:分別稱取4%、5%、6%、7%、8%、9%的糖(蔗糖與葡萄糖比例為3∶2)加入50 mL提取液中,70℃保溫30 min后,冷卻到35~40℃,在超凈工作臺上按照3%的比例將發酵劑接種于提取液中,然后放置在37℃的恒溫培養箱中培養16 h。
1.2.3.2 發酵工藝優化正交試驗
根據單因素試驗結果,選取接種量、發酵溫度、發酵時間、糖添加量4個因素設計L9(34)正交試驗,以活菌數對數值和感官為評價指標,確定工藝條件。
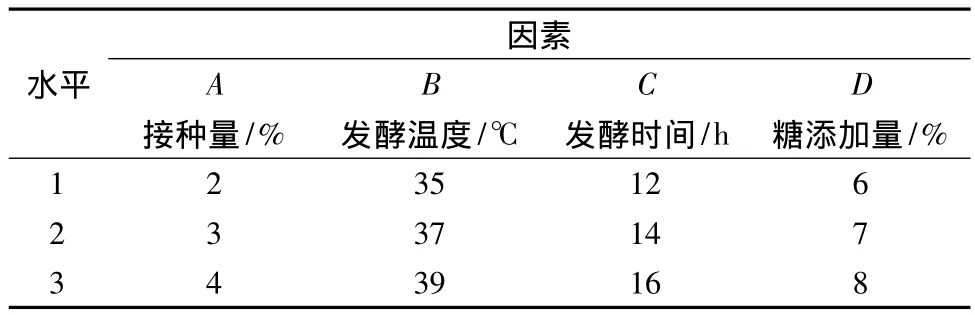
表2 植物乳桿菌PMO菌種發酵工藝L9(34)正交試驗因素水平表Table 2 L9(34)arrangement of orthogonal test of the fermentation process of L.plantarum PMO
1.2.4 檢測方法
(2)過度地迎合市場預期以及二級市場的炒作造成的管理舞弊。這種過度地迎合市場預期以及二級市場的炒作的主要目的就是通過利用虛假的財務信息來操縱股票市場的價格,因為股價的上升和下降會直接受到公司財務情況的影響。因此有一些公司就為了讓股價達到自己預想的波動水平就會進行管理舞弊,以虛假的財務信息來對股價進行有效的操縱。例如,某物業公司為了讓股價達到自己預想的波動水平,蓄意提供一些不實的財務信息,從而導致股價暫時下跌,這種股價暫時下跌的現象會在很大程度上有利于操縱者低價買入來獲得更大的控制權或者待價而沽。這也是我國上市公司管理舞弊成因的主要原因[3]。
1.2.4.1 總酸的測定
總酸參考《GB/T 12456—2008》[20]中的電位滴定法;乳酸菌活菌數按《GB 4789.35—2010》[21]中的規定;總黃酮含量測定按《DB13/T385—1998》[22]中的規定;感官檢測參考《GB/T 12315—2008》[23]中的檢驗項目、要求和方法,對發酵飲料進行感官品評綜合打分。感官品評打分標準見表3。
1.2.4.2 正交試驗指標的歸一化計算[22-23]
正交試驗以活菌數對數值和感官為指標,需對正交試驗各指標數據進行歸一化處理,按式(1)計算各指標觀測值的評分值,然后按照加權平均的方法綜合指標值,權值分配均為0.5。
設各個指標的最大值yjmax對應yjmax'=100分,最小值yjmin對應yjmin'=0分。

表3 發酵飲料感官評分標準Table 3 Standards of sensory evaluation of fermented beverages

式中:yij是指標觀測值的評分值。
1.2.5 數據處理
數據采用SPSS 19.0軟件進行統計分析,結果以平均值±標準偏差表示,以P<0.05為差異顯著性判斷標準;Origin軟件繪制圖表。
2 結果與討論
2.1 菌種的馴化
從圖1可以看出,隨著馴化培養基中提取液比例的增加,總酸含量和活菌數對數值逐漸下降。脫脂奶粉中含有乳酸菌生長需要的乳糖[15-17],而提取液中含糖較少,所以乳酸菌在提取液中的產酸量和活菌數量均不能達到脫脂乳中的水平。當培養基中提取液含量達到60%時,乳酸菌在培養基中的總酸量和活菌數量已高于馴化前,當培養基中提取液含量為100%時,乳酸菌在培養基中的總酸量均比馴化前高出了1倍,活菌數對數值比馴化前高了1~1.5 lgCFU/mL。乳酸菌經過馴化,在提取液中的總酸量和活菌數量都得到了改善,以適應純提取液發酵體系。
2.2 乳酸菌發酵工藝的單因素實驗條件研究
2.2.1 蔗糖與葡萄糖比例的單因素實驗
糖作為微生物生長的碳源,純蔗糖或純葡萄糖都不利于乳酸菌的生長和發酵風味的形成。葡萄糖利于乳酸菌的生長繁殖,蔗糖利于優質發酵風味的形成,所以用部分葡萄糖代替蔗糖對發酵飲料的品質更有利[17,24]。由圖2(a)可知,隨著蔗糖比例的增加,活菌數對數值呈下降趨勢,在蔗糖與葡萄糖比例為3∶2時出現拐點,活菌數急劇下降。隨著蔗糖比例的增加,總黃酮含量變化不明顯,蔗糖與葡萄糖的比例對總黃酮含量無影響。
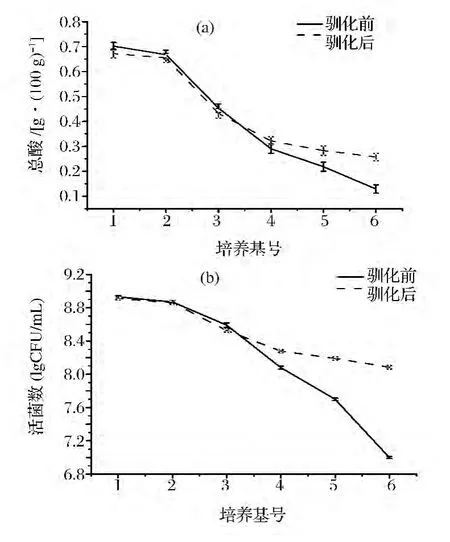
圖1 植物乳桿菌PMO菌種馴化培養基中的總酸(a)和活菌數對數值(b)Fig.1 Total acid medium(a)and the viable count of the value(b)of domesticated species of L.plantarum PMO
由圖2(b)可知,隨著蔗糖比例的增加,總酸呈逐漸下降的趨勢,pH呈逐漸上升的趨勢。
由圖2(c)可知,隨著蔗糖比例的增加,感官評分呈先升高后下降的趨勢,在蔗糖與葡萄糖比例為3∶2時,感官最好。因此選擇蔗糖與葡萄糖比例為3∶2。
2.2.2 乳酸菌接種量的單因素實驗
不同接種量的乳酸菌會使發酵后的飲料中活菌數、總酸、pH和感官差異很大,影響了飲料的品質[15,17,24]。由圖 3(a)可知,隨著菌種接種量的增加,發酵后活菌數對數值呈先增加后減少的趨勢,接種量從2%到4%,活菌數對數值增加明顯,接種量從4%到6%,活菌數對數值下降趨勢緩慢;隨著接種量的增加,總黃酮含量變化不明顯,可見菌種接種量對飲料的總黃酮的含量無影響。
由圖3(b)可知,隨著接種量的增加,發酵后總酸含量呈逐漸增加的趨勢,接種量從2%到3%,總酸含量增加明顯,而接種量從3%到6%,總酸含量增加較少,含量無明顯差異;pH呈逐漸下降的趨勢,接種量從2%到3%下降明顯,從3%到6%下降趨勢平緩。
由圖由圖3(c)可知,隨著菌種接種量的增加,發酵飲料感官評分呈先上升后下降的趨勢,在接種量為3%時感官評分最高。本實驗選擇接種量為3%。
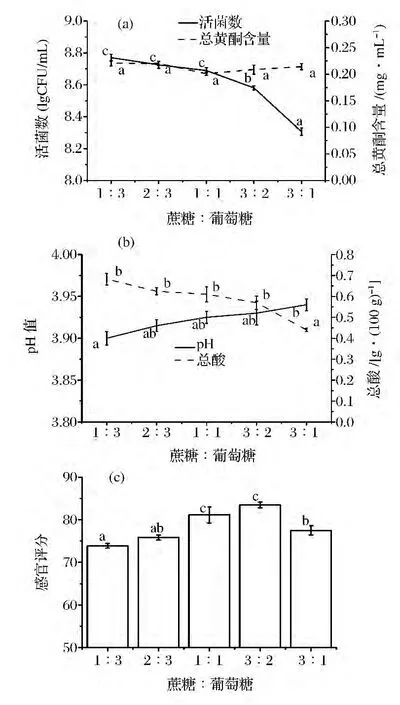
圖2 蔗糖與葡萄糖比例對植物乳桿菌PMO菌種發酵飲料的影響Fig.2 Effect of the ratio of sucrose and glucose for the fermented beverages of L.plantarum PMO
2.2.3 乳酸菌發酵溫度的單因素實驗
不同的發酵溫度會導致發酵飲料的品質差異很大。有的發酵溫度適合乳酸菌的生長繁殖,稱為最適生長溫度,有的發酵溫度適合乳酸菌積累代謝產物,稱為最適發酵溫度。有些乳酸菌會在不同的發酵溫度積累不同的代謝產物[24-26]。由圖4(a)可知,隨著發酵溫度的升高,發酵后活菌數對數值呈逐漸減少的趨勢,發酵溫度從35℃到37℃,活菌數對數值減少程度不明顯,而發酵溫度從37℃到43℃,活菌數減少程度明顯;隨著發酵溫度的升高,總黃酮含量變化不明顯,可見菌種發酵溫度對飲料的總黃酮的含量無影響。

圖3 菌種接種量對植物乳桿菌PMO菌種發酵飲料的影響Fig.3 Effect of the amount of inoculated for the fermented beverages of L.plantarum PMO
由圖4(b)可知,隨著菌種發酵溫度的升高,發酵后總酸含量呈先增加后下降的趨勢,發酵溫度從35℃到37℃,總酸含量增加,而發酵溫度從37℃到43℃,總酸含量逐漸降低,降低趨勢明顯;pH呈先下降后逐漸升高的趨勢,發酵溫度從35℃到37℃ pH略有下降,而發酵溫度從37℃到43℃,pH上升明顯。
由圖由圖4(c)可知,隨著菌種發酵溫度的升高,發酵飲料感官評分呈先上升后下降的趨勢,在發酵溫度為37℃時感官評分最高。綜合以上可見37℃時菌種產酸最多,且產生的酸有利于發酵風味的形成,因此菌種的最適發酵為37℃。
2.2.4 乳酸菌發酵時間的單因素實驗
由圖5(a)可知,隨著發酵時間的延長,活菌數對數值呈先增加,再趨于平穩后下降的趨勢,即在12~16 h期間,菌種處于生長穩定期,活菌數量最高。隨著發酵時間的延長,總黃酮含量呈減少的趨勢,但減少的趨勢較弱,可能是隨著時間的延長,黃酮被氧化,但黃酮在酸性環境中較穩定,乳酸菌代謝產生的酸對黃酮起了一定的保護作用。

圖4 發酵溫度對植物乳桿菌PMO菌種發酵飲料的影響Fig.4 Effect of fermentation temperature for the fermented beverages of L.plantarum PMO
由圖5(b)可知,隨著時間的延長,總酸逐漸增加,在0~12 h時,乳酸菌處于延滯期和對數期,產酸較少,在12~16 h時乳酸菌處于穩定期,產酸較多,在16~20 h時,乳酸菌開始衰亡,產酸較少,總酸增加較少。由于酸的含量越來越多,pH則與總酸相反,呈逐漸下降的趨勢。
由圖5(c)可知,隨著時間的延長,由于乳酸菌的代謝產物種類和含量的不同,發酵飲料的感官評分呈先升高后降低的趨勢,在發酵14 h時感官評分最高。綜合以上,選擇發酵時間為14 h。
2.2.5 糖添加量的單因素實驗
由圖6(a)可知,隨著糖添加量的增加,活菌數對數值呈先增多再減少的趨勢,在糖添加比例為7%時活菌數量較高。總黃酮含量不隨糖添加比例的變化而變化。
由圖6(b)可知,隨著糖添加量的增加,總酸逐漸增加,在糖添加量為7%時增加較少,后趨于平穩。pH逐漸降低,在糖添加量為7%時降低較少,后趨于平穩。
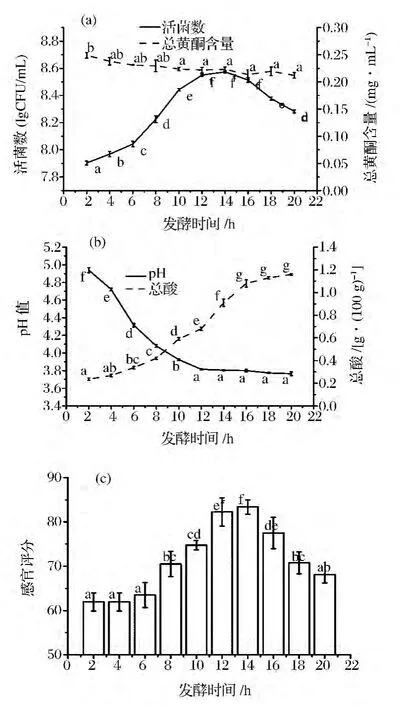
圖5 發酵時間對植物乳桿菌PMO菌種發酵飲料的影響Fig.5 Effect of fermentation time for the fermented beverages of L.plantarum PMO
由圖6(c)可知,發酵飲料的感官評分隨糖添加量的增加呈先升高后降低的趨勢,在糖添加量為6%和7%時都較高,在7%時最高。綜合考慮,糖添加量為7%時最優。
2.3 正交試驗
由于總酸含量會影響發酵飲料的感官品質,總酸含量并非越高越高,pH變化與總酸含量變化呈負相關,總黃酮含量變化不明顯,所以選擇活菌數對數值和感官評分為正交試驗測定指標。試驗結果見表4。在影響活菌數對數值和感官評分的4個因數中,按主次順序排列為B>D>C>A,即溫度對活菌數的影響最為重要,糖添加量次之,時間和接種量影響較小。最優組合為A2B2C1D2,即在接種量為3%,發酵溫度為37℃,發酵時間為12 h,糖添加量為7%時發酵飲料的活菌數最高。
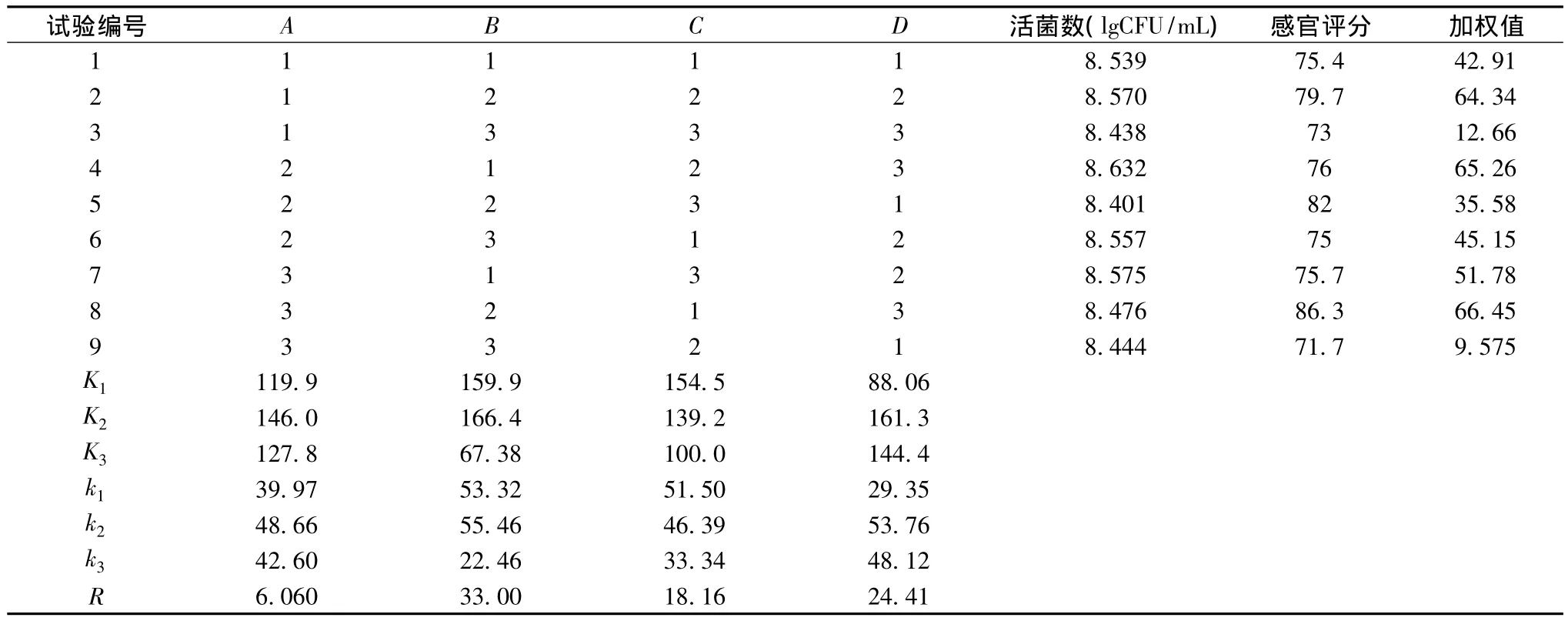
表4 正交試驗結果Table 4 The results of orthogonal experiment
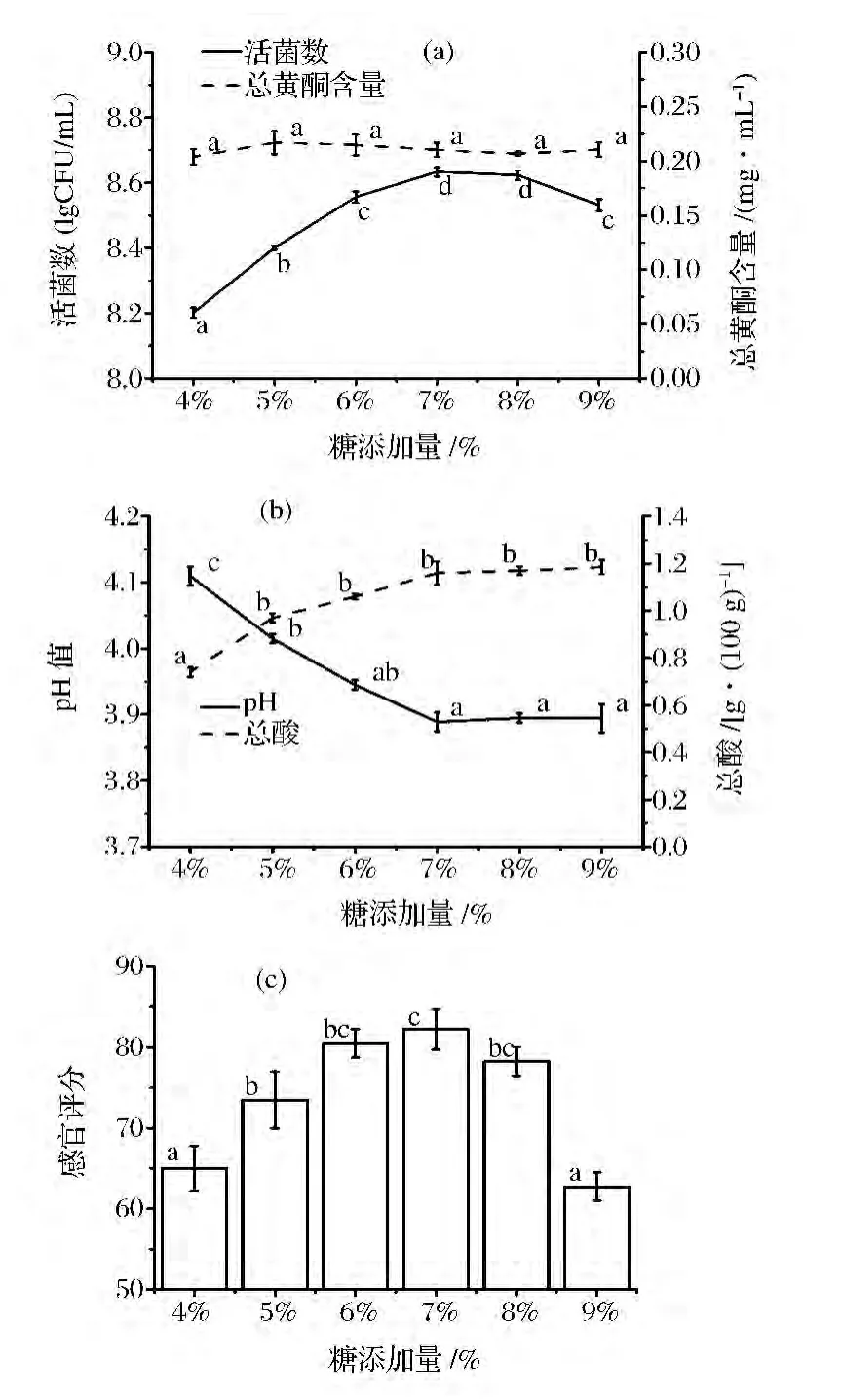
圖6 糖添加量對植物乳桿菌PMO菌種發酵飲料的影響Fig.6 Effect of the amount of sugar for the fermented beverages of L.plantarum PMO
2.4 驗證實驗
根據正交試驗優化得到的最優組合A2B2C1D2,即在接種量為3%,發酵溫度為37℃,發酵時間為12 h,糖添加量為7%進行驗證實驗,測定活菌數對數值為8.584,感官評分為88,此時加權值為90。因此最優組合為A2B2C1D2,最佳發酵條件為:接種量3%,發酵溫度37℃,發酵時間12 h,糖添加量7%。
3 結論
從綜合分析的結果得出,影響活菌數對數值和感官評分的因素的主次順序為:發酵溫度>糖添加量>發酵時間>菌種接種量。植物乳桿菌PMO菌種發酵飲料的發酵條件為:接種量為3%,發酵溫度為37℃,發酵時間為12 h,糖添加量為7%。
[1] 中華人民共和國衛生部藥典委員會編.衛生部藥品標準中藥材分冊(第一冊)[S].中華人民共和國衛生部藥典委員會,1991:901.
[2] Kim C,Shin S,Ha H,et al.Study of substance changes in flowers of Pueraria thunbergiana Benth.during storage[J].Archives of Pharmacal Research,2003,26(3):210-213.
[3] Han Y O,Han M J,Park S H,et al.Protective effects of kakkalide from Flos puerariae on ethanol-induced lethality and hepatic injury are dependent on its biotransformation by human intestinal microflora[J].Journal of Pharmacological Sciences,2003,93(3):331-336.
[4] Lee H W,Choo M K,Bae E A,et al.β-Glucuronidase inhibitor tectorigenin isolated from the flower of Pueraria thunbergiana protects carbon tetrachloride-induced liver injury[J].Liver International,2003,23(4):221-226.
[5] Min S W,Kim D H.Kakkalide and irisolidone:HMG-CoA reductase inhibitors isolated from the flower of Pueraria thunbergiana[J].Biological & Pharmaceutical Bulletin,2007,30(10):1 965-1 968.
[6] Park E K,Shin Y W,Lee H U,et al.Passive cutaneous anaphylaxis-inhibitory action of tectorigenin,a metabolite of tectoridin by intestinal microflora[J].Biological& Pharmaceutical Bulletin,2004,27(7):1 099-1 102.
[7] Kapiotis S,Hermann M,Held I,et al.Genistein,the dietary-derived angiogenesis inhibitor,prevents LDL oxidation and protects endo-thelial cells from damage by atherogenic LDL[J].Arterioscler Thromb Vase Biol,1997,17:2868.
[8] 謝宗萬,余友岑.全國中草藥名鑒(上冊)[M].北京:人民衛生出版社,1996:464-472.
[9] WANG M,JIANG C,MA L,et al.Preparation,Preliminary characterization and immunostimulatory activity of polysaccharide fractions from the peduncles of Hovenia dulcis[J].Food Chemistry,2013,138(1):41-47.
[10] WANG M,ZHU P,JIANG C,et al.Preliminary characterization,antioxidant activity in Vitro and hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles of Hovenia dulcis[J].Food and Chemical Toxicology,2012,50(9):2 964-2 970.
[11] Hase K,Ohsugi M,Xiong Q,et al.Hepatoprotective effect of Hovenia dulcis thunb.on experimental liver injuries induced by carbon tetrachloride or D-galactosamine/lipopolysaccharide[J].Biol Pharm Bull,1997,20(4):381-385.
[12] 王艷林,韓玉,錢金萍.枳椇子抗脂質過氧化作用的實驗研究[J].中草藥,1994,25(6):306-307.
[13] 嵇揚.枳椇子水提取物細胞毒作用與抑瘤功效的研究[J].中醫藥學刊,2003,21(4):538-539.
[14] 陳泉生.枳椇皂甙的藥理性質[J].國外醫學.藥學分冊,1980,1(1):45.
[15] Lin P P,Hsieh Y M,Tsai C C.Antagonistic activity of Lactobacillus acidophilus RY2 isolated from healthy infancy feces on the growth and adhesion characteristics of enteroaggregative Escherichia coli[J].Anaerobe,2009,15:122-126.
[16] Hickson M,D'Souza A L,Muthu N,et al.Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics:randomised double blind placebo controlled trial[J].Brit Med J,2007,335(7610):80.
[17] 王子娜.核桃乳酸菌發酵飲料的工藝研究[D].北京林業大學,2012.
[18] 朱新術.發酵黃芪的乳酸菌選育與發酵參數優化研究[D].蘭州:蘭州畜牧與獸藥研究所研究院,2008.
[19] 姚娜.輪葉黨參乳酸發酵飲料的研制[D].吉林:吉林農業大學,2007.
[20] 中國食品發酵工業研究院.GB/T 12456-2008中國標準書號[S].北京:中國標準出版社,2008.
[21] 中國疾病預防控制中心營養與食品安全所.GB 4789.35-2010中國標準書號[S].北京:中國標準出版社,2010.
[22] 河北省技術監督局.DB13/T385-1998食品中總黃酮(蘆丁)的測定[S].河北:河北省技術監督局,1998.
[23] 中國標準化研究院,北京工商大學,中國人民解放軍總后勤部軍需裝備研究所,今麥郎食品有限公司.GB/T 12315-2008中國標準書號[S].北京:中國標準出版社,2010.
[24] 張仲欣,杜雙奎.食品實驗設計與數據處理[M].鄭州:鄭州大學出版社,2011:43-44.
[25] 羅磊,支梓鑒,劉云宏,等.正交試驗優化蘋果片低氧熱泵干燥工藝[J].食品科學,2014,35(4):1-5.
[26] 范麗平,王麗娟,張海松.植物乳桿菌的分離鑒定及生長特性研究[J].安徽農業科學,2012,40(35):17311-17313.
[27] 周德慶.微生物學教程第3版[M].高等教育出版社,2002:160.
[28] 周蕾,魯緋,汪建明.脫脂豆粉乳酸發酵的研究[J].中國釀造,2010(3):40-44.

