豆豉中抗氧化芽孢桿菌的多樣性分析和鑒定
謝昕,呂曉騰,楊英歌,黃繼翔
1(徐州生物工程職業(yè)技術(shù)學(xué)院生物工程系,江蘇徐州,221006)
2(德州昂立達(dá)生物技術(shù)有限公司,山東德州,253000)
機(jī)體在氧化過(guò)程中會(huì)產(chǎn)生多種自由基和其他活性氧,當(dāng)自由基產(chǎn)生過(guò)多,超過(guò)機(jī)體對(duì)自由基的清除能力時(shí),多余的自由基會(huì)導(dǎo)致DNA、脂質(zhì)、蛋白質(zhì)等生物分子的氧化損傷,與機(jī)體衰老和多種疾病的發(fā)生與發(fā)展有密切聯(lián)系[1]。以大豆或豆粕為原料經(jīng)微生物發(fā)酵提高其抗氧化能力或分離鑒定抗氧化成分已有較多研究,所使用的微生物種類(lèi)包括霉菌、酵母、細(xì)菌等[2]。以枯草芽孢桿菌為代表的芽孢桿菌是研究較多的微生物類(lèi)群之一,其種類(lèi)多樣且不同來(lái)源菌株的代謝多樣性高,可產(chǎn)生抗氧化肽[3]、異黃酮類(lèi)[4]、維生素 E[5]、糖蛋白[6]、胞外多糖[7]、硫醇類(lèi)化合物[8]、多酚[9]等多種類(lèi)型的抗氧化物質(zhì),是一類(lèi)有良好應(yīng)用前景的微生物類(lèi)群。
芽孢桿菌是自然發(fā)酵豆豉中的優(yōu)勢(shì)菌群[10],我們從不同來(lái)源的自然發(fā)酵豆豉中分離純化芽孢桿菌菌株,使用多種抗氧化性評(píng)價(jià)方法對(duì)菌株發(fā)酵豆粕上清液的抗氧化能力進(jìn)行測(cè)量,對(duì)菌株及其抗氧化特性的多樣性進(jìn)行分析,為基于大豆或豆粕的功能性成分的開(kāi)發(fā)提供菌株資源。
1 材料和方法
1.1 菌株的分離純化
本試驗(yàn)室保存的43份自然發(fā)酵豆豉樣品,稱取10 g樣品,分散在90 mL無(wú)菌生理鹽水中,劇烈振蕩并梯度稀釋后涂布LB平板,37℃培養(yǎng)48 h,挑取形態(tài)有差異的不同菌落在LB平板上多次劃線純化,鏡檢確認(rèn)產(chǎn)生芽孢后將菌株接種至LB斜面保存?zhèn)溆谩?/p>
1.2 菌株篩選
1.2.1 發(fā)酵上清液制備
本地市售豆粕(凱氏定氮法測(cè)含氮量7.46%,含水量8.72%)粉碎并過(guò)100目篩。豆粕培養(yǎng)基:豆粕粉0.1 g/mL,蒸餾水余量,300 mL錐形瓶裝液量75 mL,1×105Pa滅菌15 min。所保存菌株在LB液體培養(yǎng)基活化48 h后以體積比為3%的接種量接種,37℃,180 r/min振蕩液培養(yǎng)24 h。發(fā)酵液12 000 r/min離心10 min,取上清用于后續(xù)試驗(yàn)。
1.2.2 初篩1,1-二苯基-2-苦肼基(DPPH·)清除率測(cè)定
[11]有改動(dòng)。發(fā)酵上清液1.0 mL與0.04 mol/mL DPPH乙醇溶液3.0 mL混合,避光靜置30 min,12 000 r/min離心10 min,測(cè)517 nm吸光度。以無(wú)水乙醇為空白對(duì)照。每個(gè)菌株重復(fù)測(cè)定3次。

1.3 復(fù)篩
1.3.1 羥基自由基(·OH)清除率測(cè)定
按參考文獻(xiàn)[6]有改動(dòng),稀釋10倍的發(fā)酵上清液1.0 mL,與6 mmol/L FeSO40.3 mL、6 mmol/L 水楊酸1.5 mL、雙蒸水2.0 mL混合并搖勻,加入6 mmol/L H2O20.3 mL啟動(dòng)反應(yīng),室溫靜置10 min測(cè)510 nm吸光度。以雙蒸水為空白對(duì)照。每個(gè)菌株重復(fù)測(cè)定3次。

1.3.2 超氧陰離子自由基(·O2-)清除率測(cè)定
按參考文獻(xiàn)[6]有改動(dòng)。取pH 8.2的0.05 mol/L Tris-HCl緩沖液3.0 mL,置于25℃水浴中預(yù)熱20 min,與稀釋10倍的發(fā)酵上清液1.0 mL和30 mmol/L鄰苯三酚溶液0.6 mL混勻后,25℃水浴中保溫5 min,加入1 mol/L HCl 0.5 mL終止反應(yīng),于420 nm處測(cè)定吸光值。以雙蒸水為空白對(duì)照。每個(gè)菌株重復(fù)測(cè)定3次。

1.3.3 總抗氧化力測(cè)定
使用鉬酸銨法[12]。稀釋10倍的發(fā)酵上清液1.0 mL,與 0.6 mol/L H2SO4、28 mmol/L Na3PO4、4 mmol/L鉬酸銨溶液各1.0 mL混勻,95℃水浴60 min,冷卻至室溫,12 000 r/min離心10 min后取上清液,測(cè)695 nm處吸光值,吸光值越大則樣品抗氧化能力越強(qiáng)。每個(gè)菌株重復(fù)測(cè)定3次。
1.3.4 Fe3+還原能力測(cè)定
按參考文獻(xiàn)[12]有改動(dòng)。稀釋10倍的發(fā)酵上清液1.0 mL,加入pH 6.6的0.2 mol/L磷酸緩沖液2.0 mL、10 mg/mL鐵氰化鉀2.0 mL,混勻,50℃水浴20 min,加入100 mg/mL三氯乙酸2.0 mL和0.1%(W/V)FeCl3溶液1.0 mL,混勻,測(cè)700 nm吸光值,吸光值越高表明還原能力越強(qiáng)。每個(gè)菌株重復(fù)測(cè)定3次。
1.3.5 Fe2+螯合率測(cè)定
按參考文獻(xiàn)[13]有改動(dòng)。稀釋10倍的發(fā)酵上清液 1.0 mL,加入 1 mmol/L FeCl2溶液 2.0 mL,5 mmol/L Ferozine溶液1.0 mL,混勻,室溫下反應(yīng)10 min,測(cè)562 nm吸光值。以雙蒸水為空白。每個(gè)菌株重復(fù)測(cè)定3次。

1.3.6 脂質(zhì)過(guò)氧化抑制率測(cè)定
使用硫代巴比妥酸法,稀釋10倍的發(fā)酵上清液1.0 mL,加入0.4%(W/V)大豆卵磷脂溶液7.0 mL,加入10 mmol/L FeSO41.0 mL,混勻,37℃保溫20 min,加入20%(W/V)三氯乙酸2.0 mL,5 000 r/min離心10 min,取上清液4.0 mL,加入0.8%(W/V)硫代巴比妥酸溶液2.0 mL,混勻,沸水浴15 min,測(cè)532 nm吸光值。以雙蒸水為空白。每個(gè)菌株重復(fù)測(cè)定3次。

1.3.7 多肽濃度測(cè)定
雙縮脲法[14]。
1.4 發(fā)酵上清液抗氧化穩(wěn)定性測(cè)定
按1.2.1方法制備的菌株發(fā)酵上清液,按1.3.3方法測(cè)總抗氧化力后,放入磨口玻璃瓶?jī)?nèi)并加滿至瓶口,具塞密封后在50℃恒溫靜置存放14 d,每隔2 d取樣測(cè)總抗氧化力。
1.5 數(shù)據(jù)分析
使用X-Cluster聚類(lèi)分析軟件[15],對(duì)各方法所得數(shù)據(jù)進(jìn)行聚類(lèi)分析。
1.6 菌株鑒定
通過(guò)革蘭氏染色和芽孢染色觀察菌體形態(tài),生理生化試驗(yàn)參照文獻(xiàn)[16]。16S rDNA序列測(cè)定由華大基因技術(shù)有限公司完成,擴(kuò)增用引物為細(xì)菌16S rDNA通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-GGTTACCTTGTTACGACTT-3')。測(cè)序結(jié)果使用balstn比對(duì)初步確定種,使用MEGA5.0對(duì)齊并做系統(tǒng)發(fā)育分析,參數(shù)為NJ法、Kimura2、Pairwise deletion。
2 結(jié)果和分析
2.1 菌株純化與初篩
從43份自然發(fā)酵豆豉樣品中分離純化產(chǎn)芽孢細(xì)菌247株,對(duì)其發(fā)酵豆粕上清液測(cè)定DPPH·清除率,除1株菌株的清除率為-1.8%外,其余246株菌株的清除率在35.4%~96.6%,分段統(tǒng)計(jì)見(jiàn)圖1。
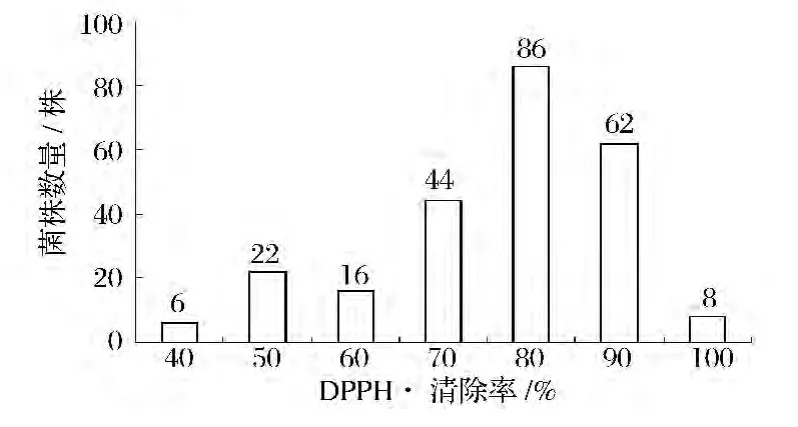
圖1 發(fā)酵上清液對(duì)DPPH·清除率的菌株數(shù)量分段計(jì)數(shù)Fig.1 Thedistribution of DPPH radical scavenging activity for fermented soybean meal supernate
未接種發(fā)酵的豆粕培養(yǎng)基上清的清除率為41.2%,與此相比,有97.2%(240株)的菌株發(fā)酵豆粕后可提高其對(duì)DPPH·的清除率,77.7%(192株)的菌株清除率在60%~90%。按5%的比例挑選清除率最高的 12個(gè)菌株,其清除率在 86.2%~96.6%,進(jìn)行復(fù)篩。
2.2 復(fù)篩結(jié)果分析
12株對(duì)DPPH·有高清除率的復(fù)篩菌株在另外5種抗氧化性評(píng)價(jià)方法中表現(xiàn)出不同的抗氧化能力,發(fā)酵上清液中多肽質(zhì)量濃度在1.94~10.46 mg/mL,提示12株菌株在抗氧化能力和有效成分組成上存在差異,抗氧化能力并不完全來(lái)自發(fā)酵過(guò)程中降解豆粕蛋白質(zhì)產(chǎn)生的多肽。
7種抗氧化性評(píng)價(jià)方法結(jié)果及與多肽濃度間的簡(jiǎn)單相關(guān)系數(shù)見(jiàn)表2,僅有總抗氧化力與·OH清除率、·O2-清除率之間具有顯著、極顯著線性正相關(guān),脂質(zhì)過(guò)氧化抑制率與多肽濃度間有極顯著線性負(fù)相關(guān)[17]。對(duì)表2數(shù)據(jù)使用X-Cluster的UPGMA(線性)算法的聚類(lèi)分析結(jié)果見(jiàn)圖2,·OH清除率、·O2-清除率、總抗氧化力、脂質(zhì)過(guò)氧化抑制率因所得結(jié)果具有較高相關(guān)性而聚為一群,而DPPH·清除率、Fe2+螯合率、Fe3+還原能力3種方法的測(cè)試結(jié)果聚為一群,多肽濃度與此群在相關(guān)性上更高,但無(wú)統(tǒng)計(jì)意義。各方法和多肽濃度間的線性相關(guān)性表明,對(duì)于此12株菌株,發(fā)酵上清液中多肽濃度并不是決定其抗氧化能力的關(guān)鍵性因素。
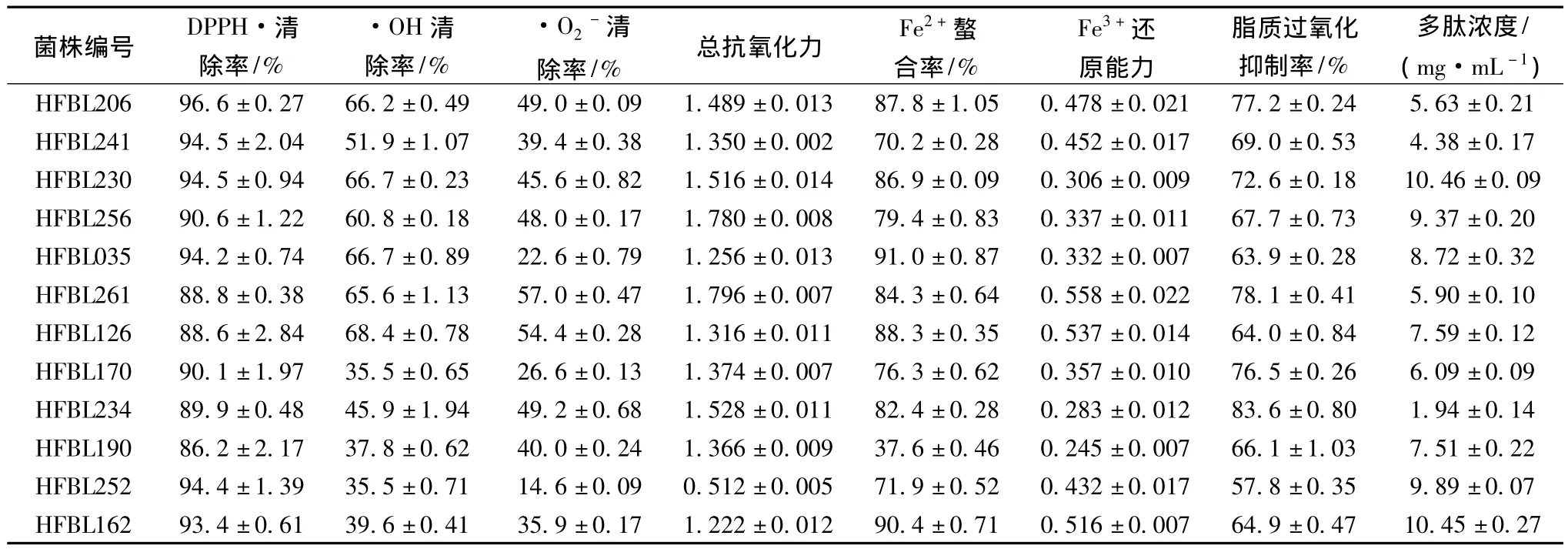
表1 復(fù)篩菌株的抗氧化評(píng)價(jià)方法測(cè)量結(jié)果Table 1 The results of antioxidant capacity methods used for secondary screening strains

表2 不同抗氧化性測(cè)試方法及多肽濃度之間的相關(guān)系數(shù)Table 2 The coefficient of correlation between different antioxidant capacity methods and peptide concentration
根據(jù)表1數(shù)據(jù)使用X-Cluster對(duì)菌株進(jìn)行聚類(lèi)分析,算法參數(shù)為標(biāo)準(zhǔn)差標(biāo)準(zhǔn)化、夾角余弦系數(shù)、UPGMA(線性),結(jié)果見(jiàn)圖3。在夾角余弦系數(shù)為0(表示無(wú)任何相關(guān)性)水平上分為4個(gè)類(lèi)群。類(lèi)群1包括HFBL206、HFBL241兩個(gè)菌株,特點(diǎn)是 DPPH·清除率相對(duì)較高,·OH清除率、·O2-清除率、總抗氧化力、多肽濃度中等,類(lèi)群2包括 HFBL230、HFBL126等4株菌株,分為a、b兩個(gè)小群,HFBL126所在小群a的·O2-清除率、總抗氧化力、Fe3+還原能力高于HFBL230所在小群b,但DPPH·清除率和多肽濃度低。類(lèi)群3、類(lèi)群4與類(lèi)群1、類(lèi)群2的主要差別為·OH清除率、·O2-清除率較低。類(lèi)群3與類(lèi)群4相比,DPPH·清除率、Fe3+還原能力、多肽濃度較高,而·O2-清除率、總抗氧化力較低。菌株的分群結(jié)果提示不同類(lèi)群的菌株所產(chǎn)生的抗氧化成分在抗氧化機(jī)制和種類(lèi)上具有多樣性。
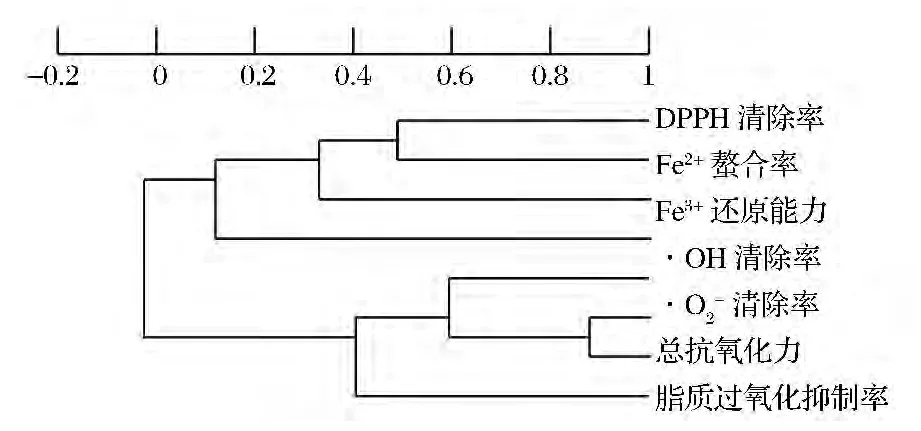
圖2 不同抗氧化評(píng)價(jià)方法所得結(jié)果和多肽濃度的聚類(lèi)分析Fig.2 Cluster analysis for results of different antioxidant capacity methods and peptide concentration
2.3 抗氧化穩(wěn)定性
12株菌株發(fā)酵上清液密封后在50℃環(huán)境存放14d內(nèi)的總抗氧化力均呈下降趨勢(shì)(表3),活性保存率(%)在69.1%~90.4%,其中HFBL234菌株活性保存率最高,而HFBL261菌株的發(fā)酵上清存放14 d后的總抗氧化力數(shù)值為1.141,在12株菌株中最高。
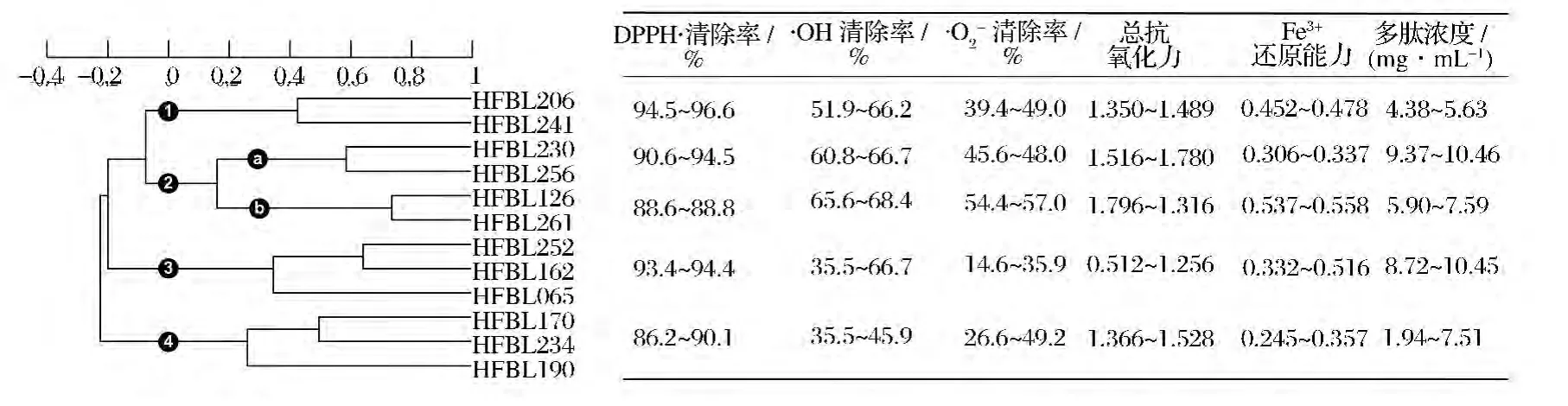
圖3 菌株的聚類(lèi)分析結(jié)果和各類(lèi)群在測(cè)試方法上的數(shù)值范圍Fig.3 The results of cluster analysis for strains and the scales of different antioxidant assay methods

表3 菌株上清液在50℃下存放14 d前后總抗氧化力變化Table 3 The change of total antioxidant capacity for fermented soybean meal supernate stored in 50℃for 14 days
2.4 菌株鑒定
選擇50℃存放14d后總抗氧化力殘留最高的HFBL261菌株進(jìn)行鑒定,其表型特性見(jiàn)表4,16S rDNA序列分析結(jié)果見(jiàn)圖4,與Bacillus subtilis的相似度在99.5%以上。鑒定HFBL261為B.subtilis。

表4 Bacillus sp.HFBL261表型性狀Table 4 The phenotypic traits of Bacillus sp.HFBL261
3 討論
已有多項(xiàng)研究稱大豆或豆渣經(jīng)芽孢桿菌發(fā)酵后,其抗氧化能力有顯著提高[11,18-19]。本研究中,經(jīng)初篩發(fā)現(xiàn)97%的菌株發(fā)酵豆粕后可提高其對(duì)DPPH·的清除率,提示以大豆及其加工產(chǎn)品為底物發(fā)酵產(chǎn)生抗氧化成分可能是芽孢桿菌的普遍特性。
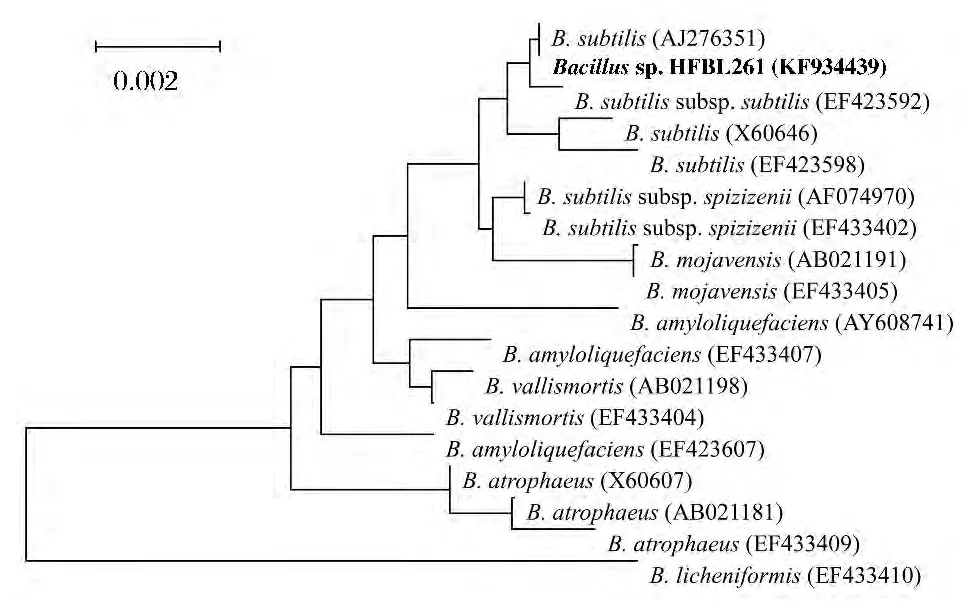
圖4 基于16S rDNA序列構(gòu)建的Bacillus sp.HFBL261與相關(guān)菌株的系統(tǒng)發(fā)育樹(shù)Fig.4 Based on the 16S rDNA sequence to build the Bacillus sp.HFBL261 and phylogenetic tree of related strains
目前已報(bào)道的抗氧化評(píng)價(jià)方法眾多,但受限于生物體代謝系統(tǒng)的復(fù)雜性和成分多樣性,并未有公認(rèn)的、可準(zhǔn)確反映一種樣品在體內(nèi)抗氧化能力的標(biāo)準(zhǔn)方法,真實(shí)反映其抗氧化能力非常困難[20]。一般認(rèn)為應(yīng)同時(shí)使用多種不同機(jī)制的方法進(jìn)行檢測(cè),以提高結(jié)果的客觀性。在眾多抗氧化能力評(píng)價(jià)方法中,總氧自由基清除能力(oxygen radical absorbance capacity,ORAC)法與體內(nèi)抗氧化性有較高相關(guān)性[21],但該方法對(duì)設(shè)備要求高且試劑較貴,不易普及。對(duì)ORAC法和其他方法進(jìn)行的比較研究顯示,ORAC法與DPPH法具有較高的相關(guān)性[22],因此選擇更易操作的DPPH法對(duì)菌株進(jìn)行初篩,復(fù)篩采用多種方法進(jìn)行綜合評(píng)價(jià)。復(fù)篩結(jié)果表明同一菌株在不同抗氧化評(píng)價(jià)方法中性能差異明顯,如HFBL252菌株,對(duì)DPPH·的清除率為94.4%,對(duì)·OH、·O2-清除率僅為35.5%、14.6%。其他研究也報(bào)道了類(lèi)似結(jié)果,例如YANG等[23]發(fā)現(xiàn)不同家族的抗氧化肽對(duì)不同類(lèi)型自由基的清除率存在明顯差異。復(fù)篩結(jié)果中,僅有總抗氧化力與·OH、·O2-清除率之間有顯著、極顯著線性正相關(guān),脂質(zhì)過(guò)氧化抑制率與多肽濃度間有極顯著線性負(fù)相關(guān),其他方法所測(cè)結(jié)果間無(wú)顯著的線性相關(guān)性。一種樣品在不同抗氧化評(píng)價(jià)方法中的差異源于各方法在反應(yīng)機(jī)制和底物選擇性等方面的差異,導(dǎo)致不同方法所得結(jié)果缺乏可比性,需要使用多種評(píng)價(jià)方法來(lái)盡可能客觀地評(píng)價(jià)一種樣品的抗氧化能力。
芽孢桿菌是一個(gè)蛋白酶活力較高的類(lèi)群,以富含蛋白質(zhì)的大豆、豆粕等為底物,發(fā)酵產(chǎn)物中富含多種功能性肽,因此多肽濃度與功能性間可能存在相關(guān)性。陳潔梅等[24]使用 Bacillus sp.JM3固態(tài)發(fā)酵豆粕,認(rèn)為多肽濃度與總抗氧化活性間有良好相關(guān)性(r2=0.8604)。但在本研究中,多肽濃度與任何一種抗氧化評(píng)價(jià)方法結(jié)果均無(wú)顯著正相關(guān)。如HFBL234菌株,發(fā)酵上清液中多肽濃度僅為1.94 mg/mL,但對(duì)DPPH·、·OH、·O2-的清除率為89.9%、45.9%、49.2%,脂質(zhì)過(guò)氧化抑制率為83.6%。該現(xiàn)象與芽孢桿菌類(lèi)群的代謝多樣性有關(guān)。芽孢桿菌是一個(gè)代謝多樣性較高的類(lèi)群,除抗氧化肽外,還可產(chǎn)生異黃酮類(lèi)、維生素E、糖蛋白、胞外多糖、硫醇類(lèi)化合物、多酚等多種抗氧化成分。多肽濃度與抗氧化性的低相關(guān)性也與自抗氧化肽在總肽中的比例有關(guān)。并非所有的多肽都具有抗氧化性,只有具有特定氨基酸序列的多肽才具有抗氧化性,例如CHEN等[25]純化所得抗氧化肽在N端富含Val、Leu、Ile、Pro等特定氨基酸殘基。抗氧化肽在總肽中的比例會(huì)影響多肽(總肽)濃度與抗氧化性之間的相關(guān)性。
對(duì)篩選的12株菌株的聚類(lèi)分析將其在0~0.2水平上分為4~5個(gè)類(lèi)群,不同類(lèi)群在多肽濃度和不同的抗氧化性評(píng)價(jià)方法上表現(xiàn)各異,提示其發(fā)酵豆粕產(chǎn)生的抗氧化成分在作用機(jī)制和類(lèi)型上的多樣性,認(rèn)為一些菌株產(chǎn)生非多肽類(lèi)抗氧化成分的可能性很大,對(duì)其中活性成分的分離鑒定將是今后的研究方向。
參考文獻(xiàn)
[1] 黎觀紅,晏向華.食物蛋白源生物活性肽-基礎(chǔ)與應(yīng)用[M].北京:化學(xué)工業(yè)出版社,2010:134-144.
[2] 劉海燕,邱玉郎,魏炳棟,等.微生物發(fā)酵豆粕研究進(jìn)展[J].動(dòng)物營(yíng)養(yǎng)學(xué)報(bào),2012,24(1):35-40.
[3] Gibbs B F,Zougman A,Masse R,et al.Production and characterization of bioactive peptides from soy hydrolysate and soy-fermented food[J].Food Research International,2004,37(2):123-131.
[4] KUO LC,CHENG WY,WU RY,et al.Hydrolysis of black soybean isoflavone glycosides by Bacillus subtilis natto[J].Applied Biochemistry and Biotechnology,2006,73(2):314-320.
[5] Rebeca F O,Juana F,Rosario M,et al.Fermentation as a bio-process to obtain functional soybean flours[J].Journal of Agricultural and Food Chemistry,2007,55(22):8 972-8 979.
[6] 袁建鋒,蔡恒,單咸旸,等.一株芽孢桿菌胞外多糖的分離純化及其抗氧化性測(cè)定[J].微生物學(xué)通報(bào),2009,36(10):1 466-1 470.
[7] Kodali V P,Perali R S,Sen R.Purification and partial elucidation of the structure of an antioxidant carbohydrate biopolymer from the probiotic bacterium Bacillus coagulans RK-02[J].Journal of Natural Products,2011,74(8):1 692-1 697.
[8] Newton G L,Rawat M,Clair J J L,et al.Bacillithiol is an antioxidant thiol produced in Bacilli[J].Nature Chemical Biology,2009,5(9):625-627.
[9] WEN Y,WU X,TENG Y,et al.Identification and analysis of the gene cluster involved in biosynthesis of paenibactin,a catecholate siderophore produced by Paenibacillus elgii B69[J].Environmental Microbiology,2011,13(10):2 726-2 737.
[10] 秦禮康,曾海英,丁霄霖.陳窖豆豉粑傳統(tǒng)工藝剖析及優(yōu)勢(shì)菌群鑒定[J].食品科學(xué),2006,27(6):118-123.
[11] ZHU YP,F(xiàn)AN JF,CHENG YQ,et al.Improvement of the antioxidant activity of Chinese traditional fermented okara(Meitauza)using Bacillus subtilis B2[J].Food Control,2008,19(7):654-661.
[12] 周方,趙宏飛,楊洋,等.高叢藍(lán)莓品種花青素含量與抗氧化能力比較[J].西南林業(yè)大學(xué)學(xué)報(bào),2011,31(5):53-57.
[13] 許淑真,黃易楷,鐘冠麟,等.植物來(lái)源乳酸菌應(yīng)用于抗敏化妝品之先期評(píng)估[J].遠(yuǎn)東學(xué)報(bào),2013,29(2):153-161.
[14] 蔡武成,袁厚積.生物物質(zhì)常用化學(xué)分析法[M].北京:科學(xué)出版社,1982:95-96.
[15] 黃繼翔,惠明,齊東梅等.新型數(shù)值分類(lèi)軟件X-Cluster的開(kāi)發(fā)及應(yīng)用[J].微生物學(xué)通報(bào),2006,33(1):118-121.
[16] 東秀珠,蔡妙英.常見(jiàn)細(xì)菌系統(tǒng)鑒定手冊(cè)[M].北京:科學(xué)出版社,2001:349-398.
[17] 袁志發(fā),周靜芋.試驗(yàn)設(shè)計(jì)與分析[M].北京:高等教育出版社,2000:171-175.
[18] YANG XJ,CHEN J,ZHANG CX,et al.Evaluation of antioxidant activity of fermented soybean meal extracts[J].African Journal of Pharmacy and Pharmacology,2012,6(24):1 774-1 781.
[19] Moktan B,Saha J,Sarkar P K.Antioxidant activities of soybean as affected by Bacillus-fermentation to kinema[J].Food Research International,2008,41(6):586-593.
[20] Ishige K,Sehubert D,Sagara Y.Flavonoids protect neuronal cells from oxidant stress by three distinct mechanisms[J].Free Radieal Biology and Medieine,2001,30(4):433-446.
[21] Prior R L,Wu X,Schaich K.Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements[J].Journal of Agriculuural and Food Chemistry,2005,53(10):4 290-4 302.
[22] Ichiho M,Minako Y,Hiroshi S,et al.Development and validation of a microplate-based β-carotene bleaching assay and comparison of antioxidant activity(AOA)in several crops measured by β-carotene bleaching,DPPH and ORAC assays[J].Food Science and Technology Research,2009,15(2):171-178.
[23] YANG HL,WANG X,LIU XH,et al.Antioxidant peptidomics reveals novel skin antioxidant system[J].Molecular& Cellular Proteomics,2009,8(3):571-583.
[24] 陳潔梅,徐聰聰,常磊,等.響應(yīng)面分析法優(yōu)化豆粕固態(tài)發(fā)酵工藝生產(chǎn)大豆抗氧化肽的研究[J].中國(guó)生物工程雜志,2012,32(12):59-65.
[25] CHEN HM,Muramoto K,Yamauchi F.Structural analys is of antioxidative peptides from soybean β-conglycinin[J].Journal of Agricultural and Food Chemistry,1995,43(3):575-578.

