程序性死亡分子1及其配體在口腔鱗狀細胞癌患者外周血中的表達及臨床意義
張鵬 歐陽少波 王軍 黃自坤 王嬌龍 廖嵐
1.南昌大學附屬口腔醫院修復科;2.南昌大學第二附屬醫院口腔頜面外科;3.南昌大學第一附屬醫院檢驗科,南昌 330006
口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC,以下簡稱口腔鱗癌)是頭頸部最常見的惡性腫瘤之一,近年來其發病率有逐年增高的趨勢[1]。研究證實,腫瘤細胞可通過免疫逃逸使腫瘤免受宿主防御機制的殺傷[2]。近年來,共刺激分子在腫瘤免疫應答中的作用備受關注[3-5],其中,新近發現的B7家族共刺激分子程序性死亡分子配體1(programmed death ligand-1,PD-L1)已被證實是介導腫瘤免疫逃逸的重要分子之一。PD-L1與其受體程序性死亡分子1(programmed death-1,PD-1)結合后介導的負性信號可抑制T淋巴細胞的激活、增殖及細胞因子的分泌,消弱宿主的抗腫瘤免疫反應,從而參與腫瘤的發生、發展過程[6]。Tsushima等[7]及Cho等[8]研究發現,口腔鱗癌細胞上PD-L1的表達升高。隨后的研究[9]中,PD-1/PD-L1與口腔鱗癌的相互關系倍受關注,但口腔鱗癌患者外周血中PD-1/PD-L1變化情況及其與口腔鱗癌諸多臨床病理特征的關系尚不清楚。本研究通過流式細胞術檢測口腔鱗癌患者及健康對照者外周血T淋巴細胞亞群數量及CD4+、CD8+T淋巴細胞表面PD-1/PD-L1的表達水平,通過酶聯免疫吸附方法檢測血清中可溶性PD-1(soluble PD-1,sPD-1)和可溶性PD-L1(soluble PD-L1,sPD-L1)的表達水平,從而探討PD-1/PD-L1途徑在口腔鱗癌中的臨床意義。
1 材料和方法
1.1 研究對象
選取2010年8月—2013年10月南昌大學第二附屬醫院口腔頜面外科收治的口腔鱗癌患者82例為口腔鱗癌組,其中,男48例,女34例;年齡30~72歲,中位年齡57歲。納入要求:口腔鱗癌患者術前未進行過化療、放療或其他生物治療,且無全身性免疫系統疾病。鱗癌原發灶及頸淋巴結轉移灶均由南昌大學第二附屬醫院病理科確診,其中舌癌36例,牙齦癌22例,頰黏膜癌13例,唇癌7例,腭癌4例;TNM分期,Ⅰ+Ⅱ期52例,Ⅲ+Ⅳ期30例;伴淋巴結轉移21例,無淋巴結轉移61例。對照組為同期本院體檢中心性別、年齡匹配的健康體檢者25例,其中男15例,女10例;年齡28~70歲,中位年齡54歲。本研究中所有研究對象均知情同意并簽署知情同意書。
1.2 試劑和儀器
異硫氰酸熒光素標記的CD4抗體(fluorescein isothiocyanate-CD4,FITC-CD4)、藻紅蛋白(phycoerythrobilin,PE)-Cy5標記的CD8抗體(PE-Cy5-CD8)、藻紅蛋白-得克薩斯紅(energy coupled dye,ECD)標記的CD3抗體(ECD-CD3)(Beckman Coulter公司,美國),PE標記的鼠抗人PD-1(PE-PD-1)、PD-L1(PE-PD-L1)抗體及各種同型對照IgG抗體(eBioscience公司,美國),酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)檢測試劑盒Human-sPD-1 Kit和Human-sPD-L1 Kit(R&D公司,美國),Cytomics FC 500流式細胞儀(Beckman Coulter公司,美國),酶標儀(Bio-Tek公司,美國)。
1.3 方法
1.3.1 標本的收集及處理 所有研究對象均為清晨空腹采血,用普通促凝真空采血管和EDTA-K2抗凝真空采血管采靜脈血(外周血)各2 mL。EDTA-K2抗凝血標本置4 ℃保存,6 h內送檢;促凝血室溫靜止30 min,3 000 r·min-1離心5 min后取上清液,-80 ℃凍存備用。
1.3.2 T淋巴細胞亞群檢測 取2支流式細胞分析管,其中一支加入熒光素標記單抗ECD-CD3、FITC-CD4和PE-Cy5-CD8各5 μL,另外一支加入相應同型對照IgG抗體。在兩支試管中各加入EDTA-K2抗凝血50 μL,室溫避光孵育15 min,加入經10倍稀釋的溶血素200 μL,靜置10 min后,1 500 r·min-1離心5 min,棄上清,加生理鹽水洗滌細胞2次,棄上清,用生理鹽水重懸經Cytomics FC 500流式細胞儀檢測。
1.3.3 T淋巴細胞表面PD-1、PD-L1表達的檢測 取3支流式細胞分析管,其中一支加入熒光素標記單抗FITC-CD4、PE-Cy5-CD8和PE-PD-1各5 μL,一支加入FITC-CD4、PE-Cy5-CD8和PE-PD-L1各5 μL,另外一支中加入相應同型對照 IgG 抗體。兩支試管中各加EDTA-K2 抗凝血50 μL,室溫避光孵育15 min,加入經10倍稀釋的溶血素200 μL,靜置10 min后,1 500 r·min-1離心5 min,棄上清,加生理鹽水洗滌細胞2次,棄上清,用生理鹽水重懸經Cytomics FC 500流式細胞儀檢測。
1.3.4 血清sPD-1、sPD-L1表達的檢測 采用ELISA法檢測血清sPD-1、sPD-L1的含量,操作步驟參照試劑盒說明書進行。簡要操作步驟如下:將sPD-1、sPD-L1標準品依次稀釋,在96孔板中分別加入100 μL血清樣品或標準品,室溫孵育2 h,清洗液洗2次,然后加入100 μL酶標二抗室溫孵育2 h,清洗液洗2次,加入100 μL顯色劑避光孵育20 min,反應結束后加入50 μL終止液,酶標儀讀取450 nm吸光度值,根據標準品吸光度繪制標準曲線,然后計算血清sPD-1、sPD-L1的濃度。
1.4 統計學分析
采用SPSS 17.0軟件對計量資料進行方差齊性檢驗和正態性檢驗,各組檢測值均符合正態分布且方差齊,兩組間比較用獨立樣本t檢驗進行統計分析,三組間用單因素方差分析,兩兩間比較采用SNK-q檢驗。口腔鱗癌患者CD4+/CD8+T淋巴細胞亞群百分數比值與外周血CD4+、CD8+T淋巴細胞表面PD-1陽性表達率的相關性應用Pearson相關進行分析。將口腔鱗癌患者按臨床病理參數(性別、年齡、腫瘤部位、大小、臨床分期、分化程度及頸淋巴結是否轉移)進行分組,應用Pearson相關分析口腔鱗癌患者血清中sPD-L1水平、PD-1的陽性T細胞百分率與臨床病理特征的關系。P<0.05表示差異有統計學意義。
2 結果
2.1 口腔鱗癌組與對照組外周血T淋巴細胞亞群的比較
口腔鱗癌組與對照組外周血T淋巴細胞亞群的比較結果見表1。口腔鱗癌組外周血CD3+、CD4+T淋巴細胞亞群百分數及CD4+/CD8+T淋巴細胞亞群百分數比值均低于對照組,差異有統計學意義(P<0.05);口腔鱗癌組CD8+T淋巴細胞亞群百分數則高于對照組,差異有統計學意義(P<0.05)。
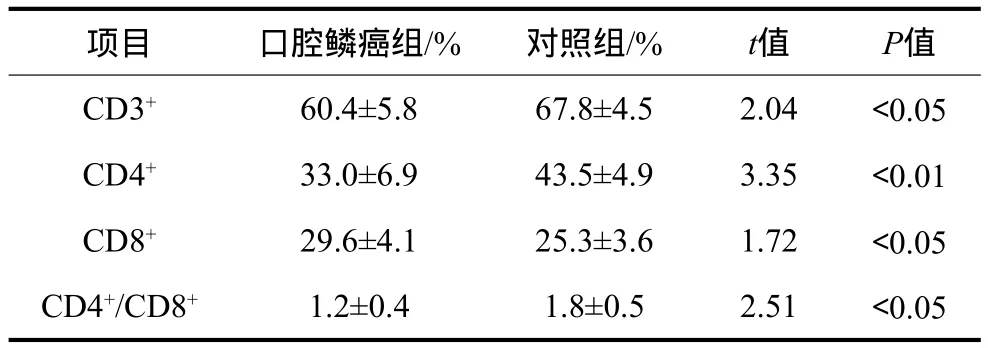
表1 口腔鱗癌組與對照組外周血T淋巴細胞亞群的水平Tab 1 The expression of peripheral blood T lymphocyte subsets from OSCC group and control group
2.2 口腔鱗癌組與對照組外周血T淋巴細胞表面PD-1、PD-L1的表達水平
口腔鱗癌組與對照組CD4+、CD8+T淋巴細胞表面PD-1及PD-L1的表達水平見表2。口腔鱗癌患者外周血CD4+、CD8+T淋巴細胞表面PD-1、PD-L1的表達水平均高于對照組,差異具有統計學意義(P<0.01)。
2.3 口腔鱗癌患者CD4+/CD8+ T淋巴細胞亞群百分數比值與外周血CD4+、CD8+ T淋巴細胞表面PD-1陽性表達率的相關性
相關分析結果顯示,口腔鱗癌患者CD4+/CD8+T淋巴細胞亞群百分數比值與外周血CD4+T淋巴細胞表面PD-1的陽性表達率相關(r=0.446,P<0.01),與CD8+T淋巴細胞表面PD-1的陽性表達率不相關(P>0.05)。
2.4 口腔鱗癌組與對照組血清中sPD-1、sPD-L1的表達水平
口腔鱗癌組與對照組血清中sPD-1、sPD-L1的表達水平見表3。口腔鱗癌組血清sPD-L1水平高于對照組,差異有統計學意義(P<0.05),而sPD-1水平二者的差異無統計學意義(P>0.05)。對口腔鱗癌患者CD4+/CD8+T淋巴細胞亞群百分數比值與患者血清sPD-L1水平進行相關性分析,結果顯示,口腔鱗癌患者CD4+/CD8+T淋巴細胞亞群百分數比值與患者血清sPD-L1水平相關(r=0.353,P<0.01)。
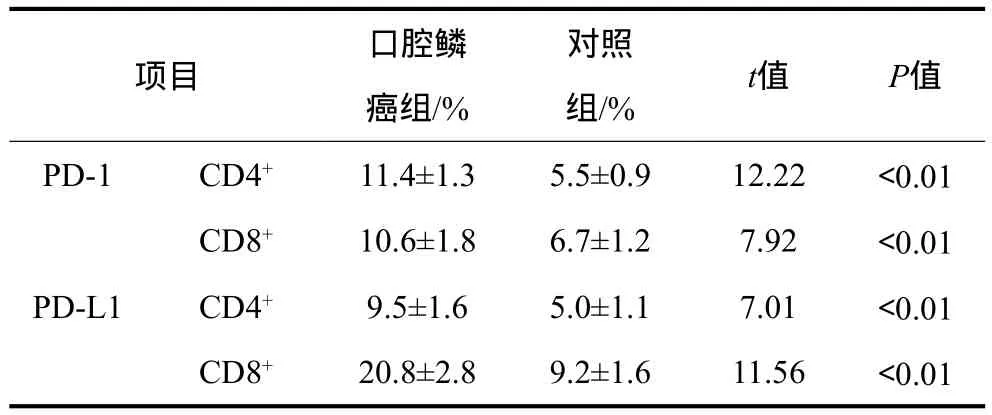
表2 口腔鱗癌組與對照組CD4+、CD8+ T淋巴細胞表面PD-1及PD-L1的水平Tab 2 The expression of PD-1 and PD-L1 in CD4+, CD8+T cells from OSCC group and control group
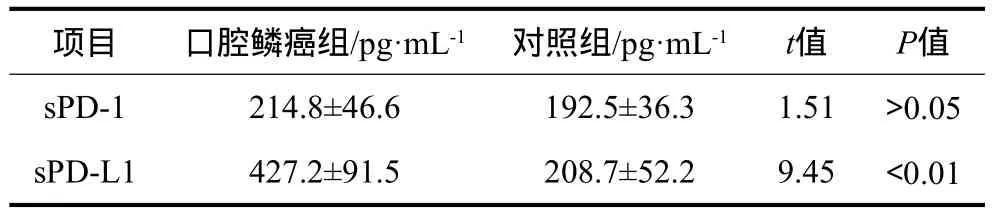
表3 口腔鱗癌組與對照組血清中sPD-1、sPD-L1的水平Tab 3 The expression of sPD-1 and sPD-L1 in serum from OSCC group and control group
2.5 口腔鱗癌患者血清中sPD-L1含量與患者臨床病理特征的關系
相關性分析結果顯示,sPD-L1的表達與臨床分期、細胞分化程度以及淋巴結轉移狀態相關(P<0.05)。Ⅲ+Ⅳ期患者血清sPD-L1水平(450.2 pg·mL-1±85.2 pg·mL-1)高于Ⅰ+Ⅱ期患者(414.0 pg·mL-1±83.4 pg·mL-1)(P<0.05);有淋巴結轉移患者血清sPD-L1水平(483.3 pg·mL-1±79.3 pg·mL-1)高于無淋巴結轉移患者(399.7 pg·mL-1±84.8 pg·mL-1)(P<0.01);低分化患者血清sPD-L1水平(495.8 pg·mL-1±86.5 pg·mL-1)高于中高分化患者(382.4 pg·mL-1±82.6 pg·mL-1)(P<0.01)。血清sPD-L1含量與性別、年齡、腫瘤部位及大小無相關性(P>0.05)。
2.6 口腔鱗癌患者PD-1的陽性T細胞百分率與患者臨床病理特征的關系
相關性分析表明,口腔鱗癌患者外周血CD4+、CD8+T淋巴細胞表面PD-1的表達水平均與腫瘤分化程度及淋巴結轉移狀態相關。低分化患者的外周血CD4+、CD8+T淋巴細胞表面PD-1的表達水平高于中高分化患者(P<0.05);有淋巴結轉移患者外周血CD4+、CD8+T淋巴細胞表面PD-1的表達水平高于無淋巴結轉移患者(P<0.05)。口腔鱗癌患者外周血CD4+、CD8+T淋巴細胞表面PD-1的表達水平與臨床分期、性別、年齡、腫瘤大小、腫瘤部位無關(P>0.05)。
3 討論
腫瘤免疫主要依靠細胞免疫,其中,T淋巴細胞處于核心地位,在免疫監視、殺傷靶細胞及免疫調節方面具有極重要的作用。由于T淋巴細胞各亞型在抗腫瘤免疫中所起作用不同,因此,檢測外周血T淋巴細胞亞群是反映機體抗腫瘤狀態的重要指標之一。本研究表明,口腔鱗癌患者外周血淋巴細胞免疫亞型比例與健康人相比存在異常,CD3+、CD4+及CD4+/CD8+百分率較對照組降低,CD8+較對照組升高,與李向春等[10]報道結果一致,說明口腔鱗癌患者體內存在細胞免疫功能失衡的微環境。
在T細胞的活化和增殖過程中,除了需要T細胞受體與表達在抗原遞呈細胞表面的主要組織相容性復合體(major histocompatibility complex,MHC)-抗原肽復合物結合產生的第一信號外,還需要共刺激分子與受體結合產生的第二信號的參與[6]。PD-1及其配體PD-L1是新近發現的負性共刺激信號分子,PD-L1與PD-1結合后可有效抑制T淋巴細胞的增殖和活化,負向調控免疫應答,從而減弱機體抗腫瘤免疫反應,該信號途徑在腫瘤免疫中的地位已經備受關注。劉書漫等[11]報道PD-L1和PD-1在胃癌組織中表達升高,且PD-L1表達與胃癌的浸潤深度、周圍淋巴結轉移、遠處轉移及TNM分期有關。Hua等[12]研究發現,PD-L1在人結腸癌組織中高表達,主要表達于腫瘤細胞的胞質和胞漿中,結腸癌患者外周血調節性T細胞上PD-1表達升高,其推測阻斷 PD-1/PD-L1途徑可作為治療結腸癌的一個新靶點。近年來,在口腔鱗癌免疫逃逸機制的諸多研究中,有研究結果表明口腔鱗癌的發生發展可能與PD-1/PD-L1信號途徑有密切關系。Chen等[9]研究發現,γ-干擾素(interferon-γ,IFN-γ)可通過蛋白激酶D2(protein kinase D isoform 2,PKD2)信號途徑對人舌鱗狀細胞癌細胞Tca8113上PD-L1表達有明顯促進作用。盧禮兵等[13]研究發現,腫瘤微環境中炎癥細胞因子可以促進Tca8113表達PD-L1。為深入研究PD-1/PD-L1信號途徑與口腔鱗癌的關系,本研究采用流式細胞術檢測了82例口腔鱗癌患者外周血CD4+、CD8+T淋巴細胞表面PD-1及PD-L1的表達,結果顯示,與對照組相比,口腔鱗癌患者CD4+、CD8+T淋巴細胞表面PD-1及PD-L1的表達均明顯升高(P<0.05),與Malaspina等[14]的結果一致,說明PD-1/PD-L1信號途徑與口腔鱗癌的發生及發展關系密切。此外,本研究還發現,口腔鱗癌患者CD4+/CD8+T淋巴細胞百分數比值與外周血CD4+T淋巴細胞表面PD-1的陽性表達有關(P<0.01)。進一步分析患者PD-1陽性T細胞百分率與性別、年齡、腫瘤部位、病理、大小、臨床分期、分化程度及頸淋巴結是否轉移的關系,結果顯示,口腔鱗癌患者外周血CD4+、CD8+T淋巴細胞表面PD-1的表達水平與腫瘤細胞分化程度及淋巴結轉移狀態相關(P<0.05),與臨床分期、性別、年齡、腫瘤大小、腫瘤部位無關(P>0.05)。
近年來研究發現,共刺激分子除了可以在細胞膜上表達(膜型)外,還可以呈可溶性形式存在于血清中,即可溶性共刺激分子。現已證明,這類可溶性的共刺激分子能夠像細胞膜表面的分子一樣以相同的方式與受體相互作用發揮一定的生物學功能。研究顯示,可溶性的共刺激分子能夠像細胞因子一樣參與血液循環,不但可以影響鄰近細胞,而且也能和遠端細胞表面的受體相互結合從而發揮廣泛的抑制效應,其發揮作用的廣度和深度可能遠遠超過細胞膜表面的膜型共刺激分子,因此,可溶性共刺激分子在疾病發生和發展過程中的作用引起了研究者的高度關注[15-16]。臨床研究顯示,人血清中也同樣存在sPD-1和sPD-L1分子,其中,sPD-L1是由金屬蛋白酶剪切細胞表面膜型PD-L1而成,人外周血中存在的sPD-L1能促進PD-1/PD-L1負性信號,從而參與腫瘤細胞的免疫逃逸。邢玉斐等[17]研究發現,肺癌患者外周血清中sPD-L1的表達異常增高,且與肺癌的分期、轉移和療效有關,這有助于判斷肺癌患者的預后。
迄今為止,尚未有關于口腔鱗癌可溶性共刺激分子表達情況的報道,為進一步深入研究sPD-1/sPDL1與口腔鱗癌發生發展的關系,本研究采用ELISA技術檢測了口腔鱗癌患者和健康對照人群血清中sPD-1和sPD-L1的表達水平,結果顯示,口腔鱗癌患者血清中sPD-L1異常增高。對口腔鱗癌患者CD4+/CD8+T百分數比值與患者血清sPD-L1水平的相關性進行分析,結果顯示,口腔鱗癌患者CD4+/CD8+T百分數比值與患者血清sPD-L1水平有關(P<0.01)。在分析sPD-L1表達水平與口腔鱗癌多種臨床病理特征的關系中可以發現,sPD-L1的表達與臨床分期、腫瘤細胞分化程度及淋巴結轉移狀態相關。Ⅲ+Ⅳ期患者血清中的sPD-L1表達水平明顯高于Ⅰ+Ⅱ期患者,低分化患者的sPD-L1表達水平高于中、高分化患者,有淋巴結轉移患者的sPD-L1表達水平高于無淋巴結轉移者。本研究中未發現sPD-L1表達與患者性別、年齡、腫瘤大小、腫瘤部位有關。
綜上所述,口腔鱗癌患者體內T細胞免疫處于抑制狀態,外周血CD4+、CD8+T淋巴細胞表面PD-1/PD-L1的表達上調,口腔鱗癌患者血清中sPD-L1異常升高,且與臨床分期、腫瘤細胞分化程度及淋巴結轉移狀態有關。本研究表明,特異性阻斷PD-1/PD-L1抑制途徑有望成為腫瘤靶向治療的策略之一。
[1]劉思玉, 李宏衛. 微RNA在口腔鱗狀細胞癌中表達的研究進展[J]. 中華口腔醫學雜志, 2013, 48(6):376-380.
[2]Dawson MA, Kouzarides T, Huntly BJ. Targeting epigenetic readers in cancer[J]. N Engl J Med, 2012, 367(7):647-657.[3]Callahan MK, Wolchok JD. At the bedside: CTLA-4- and PD-1-blocking antibodies in cancer immunotherapy[J]. J Leukoc Biol, 2013, 94(1):41-53.
[4]Hamid O, Carvajal RD. Anti-programmed death-1 and antiprogrammed death-ligand 1 antibodies in cancer therapy[J].Expert Opin Biol Ther, 2013, 13(6):847-861.
[5]Atanackovic D, Luetkens T, Kr?ger N. Coinhibitory molecule PD-1 as a potential target for the immunotherapy of multiple myeloma[J]. Leukemia, 2014, 28(5):993-1000.
[6]Pedoeem A, Azoulay-Alfaguter I, Strazza M, et al. Programmed death-1 pathway in cancer and autoimmunity[J].Clin Immunol, 2014, 153(1):145-152.
[7]Tsushima F, Tanaka K, Otsuki N, et al. Predominant expression of B7-H1 and its immunoregulatory roles in oral squamous cell carcinoma[J]. Oral Oncol, 2006, 42(3):268-274.
[8]Cho YA, Yoon HJ, Lee JI, et al. Relationship between the expressions of PD-L1 and tumor-infiltrating lymphocytes in oral squamous cell carcinoma[J]. Oral Oncol, 2011, 47(12):1148-1153.
[9]Chen J, Feng Y, Lu L, et al. Interferon-γ-induced PD-L1 surface expression on human oral squamous carcinoma via PKD2 signal pathway[J]. Immunobiology, 2012, 217(4):385-393.
[10]李向春, 張素欣, 程立軍, 等. 口腔癌患者手術前后細胞免疫功能變化的檢測及臨床意義[J]. 河北醫科大學學報,2010, 31(11):1329-1332.
[11]劉書漫, 孟青, 張欽憲, 等. B7-H1及其受體PD-1在胃癌組織中的表達與意義[J]. 中華腫瘤雜志, 2008, 30(3):192-195.
[12]Hua D, Sun J, Mao Y, et al. B7-H1 expression is associated with expansion of regulatory T cells in colorectal carcinoma[J]. World J Gastroenterol, 2012, 18(9):971-978.
[13]盧禮兵, 陳嬌, 馮云, 等. 炎癥細胞因子誘導Tca8113細胞表達PD-L1的作用研究[J]. 四川大學學報: 醫學版, 2013,44(1):42-45.
[14]Malaspina TS, Gasparoto TH, Costa MR, et al. Enhanced programmed death 1 (PD-1) and PD-1 ligand (PD-L1) expression in patients with actinic cheilitis and oral squamous cell carcinoma[J]. Cancer Immunol Immunother, 2011, 60(7):965-974.
[15]Pan XC, Li L, Mao JJ, et al. Synergistic effects of soluble PD-1 and IL-21 on antitumor immunity against H22 murine hepatocellular carcinoma[J]. Oncol Lett, 2013, 5(1):90-96.
[16]Song MY, Park SH, Nam HJ, et al. Enhancement of vaccineinduced primary and memory CD8+T-cell responses by soluble PD-1[J]. J Immunother, 2011, 34(3):297-306.
[17]邢玉斐, 張增利, 施敏驊, 等. 肺癌患者外周血中可溶性程序性死亡配體-1的表達及其臨床意義[J]. 中華結核和呼吸雜志, 2012, 35(2):102-106.

