探討甲狀腺激素與慢性心力衰竭患者心房顫動發生率的相關性
劉晨,袁曉晨,張振剛,駱秋平,嚴俊峰,龔開政,秦建華,周桂建
探討甲狀腺激素與慢性心力衰竭患者心房顫動發生率的相關性
劉晨,袁曉晨,張振剛,駱秋平,嚴俊峰,龔開政,秦建華,周桂建
目的:探討甲狀腺激素與慢性心力衰竭(心衰)患者心房顫動(房顫)發生率的相關性。
方法:為回顧性研究。選取2011-01-01至2012-10-01期間收住我院的非瓣膜性心臟病致慢性心衰患者共322例,根據既往有無房顫史及入院后心電圖檢查分為房顫組187例和竇性心律組135例。入院后24 h內記錄患者病史,測定血清游離甲狀腺素(FT4)、游離三碘甲狀腺原氨酸(FT3)、促甲狀腺激素(TSH)、低密度脂蛋白膽固醇(LDL-C)水平;并行十二導聯心電圖及超聲心動圖檢查,分析影響心衰患者發生房顫的相關因素。
結果:與竇性心律組比較,房顫組的FT4水平明顯增加[以中位數(M)及四分位數間距(Q1,Q3)表示,14.52(12.74,15.85) pmol/L vs 13.11(11.68,14.85) pmol/L,P<0.001],差異有統計學意義;而FT3水平兩組比較[4.06(3.76,4.44)pmol/L vs 4.1(3.80,4.52)pmol/L,P=0.250],差異無統計學意義。Spearman秩相關性分析發現:FT4水平與左心房內徑呈正相關(r= 0.134,P= 0.016),FT3與LDL-C水平呈正相關(r=0.235,P<0.001),FT3與年齡呈負相關(r= -0.268,P<0.001)。將FT4以連續變量引入Logistic回歸方程結果顯示:FT4水平[比值比(OR):1.227,95%可信區間(CI)1.112~1.354,P<0.001]、左心房內徑[OR:1.154,95%CI (1.105~1.205), P<0.001]、年齡[OR:1.038,95%CI(1.012~1.064),P=0.003]、心衰持續時間[OR:1.111,95%CI (1.021~1.209),P=0.015]、LDL-C水平[OR:0.689,95%CI (0.493~0.963),P=0.029]與心衰患者房顫的發生率相關。
結論:高FT4水平可能增加了慢性心衰患者發生房顫的風險。
甲狀腺激素;慢性心力衰竭;心房顫動
(Chinese Circulation Journal, 2015,30:749.)
慢性心力衰竭(心衰)是各類心臟病的最終歸宿,而心房顫動(房顫)是心衰患者的常見并發癥,有研究顯示約20%慢性心衰患者并發房顫[1]。盡管有研究表明房顫并非心衰患者的獨立危險因素,但房顫常誘發心功能惡化,且易出現外周動脈栓塞,而心衰則是房顫患者發生死亡的獨立危險因素[2]。甲狀腺功能異常無論甲狀腺功能亢進或甲狀腺功能減退均可導致心衰,且心衰患者中亦可出現甲狀腺功能異常,多表現為甲狀腺功能減退以及亞臨床型甲狀腺功能減退。甲狀腺激素對心血管系統直接的作用可表現為誘發心律失常,特別是室上性心律失常。房顫是甲狀腺功能亢進的并發癥之一,約10%~15%的甲狀腺功能亢進患者合并房顫[3]。而有研究顯示在甲狀腺激素水平正常者中,較高的甲狀腺激素水平常提示有較高的房顫發生率[4],有關慢性心衰患者中房顫發生率是否與甲狀腺素水平的差異相關,目前研究尚不多見。本文旨在通過回顧性研究慢性心衰合并房顫和心衰保持竇性心律患者是否存在甲狀腺激素水平的差異,為心衰并發房顫的病理生理機制研究及干預靶點的拓展提供依據。
1 資料與方法
對象:選取揚州市第一人民醫院心內科2011-01-01至2012-10-01期間收住院的非瓣膜性心臟病致慢性心衰患者共322例,其中女性155例(48.13%),男性167例(51.87%);年齡31~96歲,中位年齡75歲。入選標準:(1)入院診斷包括高血壓心臟病、缺血性心肌病、擴張型心肌病任一種;(2)紐約心臟病協會(NYHA)心功能分級Ⅲ級,左心室射血分數(LVEF)≤50%;(3)NYHA心功能分級Ⅲ級,LVEF>50%且有相關結構性心臟病存在的證據(如左心室肥大,左心房擴大)和(或)舒張功能不全;超聲心動圖檢查無心臟瓣膜病、心包疾病、肥厚型心肌病、限制型心肌病。排除標準:(1)原發甲狀腺疾病(甲狀腺功能亢進、亞臨床型甲狀腺功能亢進、甲狀腺功能減退、亞臨床型甲狀腺功能減退);(2)住院前曾服用有可能影響甲狀腺功能的藥物,如胺碘酮等;(3)入院前規則服用血管緊張素轉換酶抑制劑、血管緊張素Ⅱ受體拮抗劑、利尿劑、β受體阻滯劑、洋地黃、他汀類藥物中的任一種。
方法:(1)入院后記錄患者一般情況、慢性心衰病因和病史、房顫病史、住院前治療情況。(2)入院后24 h內以選擇抑制法(Roche model DPP分析儀,瑞士)測定血清低密度脂蛋白膽固醇(LDL-C),電化學發光法(Beckman DXI800電化學發光免疫分析儀,美國)測定血清游離甲狀腺素(FT4)、游離三碘甲狀腺原氨酸(FT3)、促甲狀腺激素(TSH)。(3)入院后24 h內行十二導聯心電圖及超聲心動圖(SIEMENS ACUSON Sequoia c512彩色多普勒超聲診斷儀,德國)檢查,檢查LVEF、左心房內徑、左心室舒張末期內徑(LVEDD)、左心室收縮末期內徑(LVESD)。(4)根據既往有無房顫史及入院后心電圖檢查分為房顫組187例(58.07%,包括陣發性房顫和持續性房顫患者)和竇性心律組135例(41.93%)。
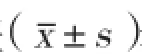
2 結果
兩組臨床特征比較(表1):322例慢性心衰患者中,LVEF>50%患者240例(74.53%)。與竇性心律組比較,房顫組的年齡、心衰持續時間、FT4、左心房內徑均明顯增加,而LDL-C降低,差異均有統計學意義(P<0.05或<0.001)。其余各項指標兩組間比較差異均無統計學意義(P>0.05)。
甲狀腺激素與其他臨床特征的相關性:Spearman秩相關性分析發現:FT4水平與左心房內徑呈正相關(r=0.134,P=0.016),與TSH呈負相關(r= -0.202,P<0.001);FT4水平與LDL-C水平無明顯相關性(r=0.013,P=0.822)。FT3水平與年齡呈負相關(r=-0.268,P<0.001), 與LDL-C水平呈正相關(r=0.235,P<0.001),而與左心房內徑無明顯相關性。
相關因素對慢性心衰患者房顫發生率的影響(表2):以慢性心衰患者的房顫發生率為因變量,相關臨床特征為自變量的Logistic多因素逐步回歸分析提示:年齡、心衰持續時間、左心房內徑、LDL-C水平、FT4水平對慢性心衰患者房顫的發生有一定的影響(P<0.05)。為進一步了解FT4對房顫發生率的影響,將所有患者的FT4水平按照四分位數轉換為有序變量,以房顫發生率為因變量的Logistic多因素逐步回歸分析,結果提示,FT4水平>14.121 pmol/L后,房顫發生率增加趨勢明顯[TQ3:比值比(OR)3.306,95%可信區間(CI)1.538~7.108,P=0.002; TQ4:OR:4.018,95%CI (1.886~8.561),P<0.001]。LDL-C水平>2.622 mmol/L 時,TQ4:OR:0.413,95%CI(0.189~0.906),P=0.027(因LDL-C的OR<1,提示過低的LDL-C水平反而增加房顫的發生率,顯示LDL-C<2.62 mmol/L對應著房顫發生率的增加有統計學意義)。
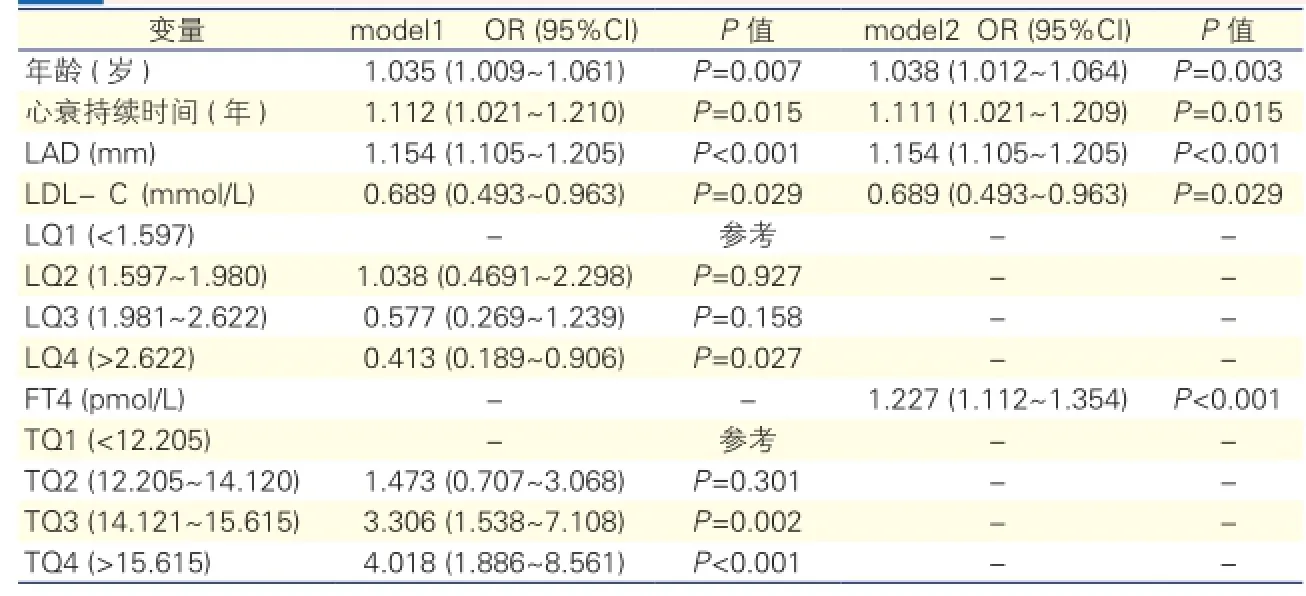
表2 相關因素對慢性心衰患者房顫發生率的影響
3 討論
目前研究表明神經體液內分泌激素是參與形成慢性心衰的重要病理生理機制,心衰及房顫的發病有一些共同的危險因素。國楊等[5]研究發現FT4水平升高可作為冠心病患者房顫發生的獨立危險因素。甲狀腺激素與心衰及房顫均有密切的關系。甲狀腺功能亢進或甲狀腺功能減低均可直接導致心衰,同時甲狀腺激素與心律失常的發生發展關系密切,在甲狀腺功能亢進患者中房性心律失常非常多見,許多患者以房顫為首發癥狀而就診,有研究表明射頻消融治療房顫的復發率與患者基礎甲狀腺激素水平呈正相關[6]。甲狀腺是否參與了心衰患者發生房顫的病理生理機制?Calvo-Romero 等[7]將109例慢性失代償心衰患者納入研究,結果顯示,是否患房顫對血清FT4及TSH水平并無明顯影響。本研究在排除了原發甲狀腺疾病所致心衰及藥物的影響下顯示房顫患者的FT4水平高于竇性心律患者,在本院的檢測標準下,FT4水平高于14.121 pmol/L后,心衰并發房顫的比例明顯增加,而FT3和TSH對房顫
的發生無明顯的影響。此結果與Calvo-Romero 等研究結果的差異可能與入選研究的標準不同有關。該研究同時顯示LVEF、心功能級別及性別對FT4和TSH無明顯影響。本研究結果與其相同,而且這些因素未對心衰患者房顫發生率產生影響。但先有研究顯示低T3綜合征多提示更低的LVEF及更差的預后[8]。
房顫的病因普遍認為源于心房的結構重構以及電重構。左心房的結構重構在房顫發生機制中起到很重要的作用[9]。本研究中房顫和竇性心律患者左心室內徑存在著顯著的差異,左心房的擴大提示心房的結構重構,進一步驗證了結構重構在心衰患者房顫發生機制的重要性,本研究中發現心衰患者中左心室內徑大小與FT4水平有一定的相關性,有研究表明過高的甲狀腺激素直接興奮腺苷酸環化酶,增加環磷酸腺苷(CAMP),增加心肌細胞對兒茶酚胺的敏感性[10]。而CAMP的增加可導致心肌細胞膜通透性增加,心肌細胞小灶性壞死,亦可致心肌間質水腫、纖維化。結合我們的研究提示FT4可能直接參與了心衰患者左心房的結構重構,但其又不是僅僅通過左心房的結構重構來影響房顫的發生。此前一些研究表明甲狀腺激素通過對Na+-K+泵,Na+-Ca2+交換體和多種電壓門控K+通道以及縫隙連接蛋白的影響,最終影響心房動作電位時程,即影響心房的電重構觸發房顫的發生[11]。
甲狀腺激素的代謝常影響脂質代謝,有研究表明亞臨床甲狀腺功能亢進可出現低LDL-C水平[12],而近期的研究發現較低的LDL-C增加正常人群發生房顫的風險[13],在本研究中同樣發現在心衰患者中LDL-C水平與房顫的發生率呈負相關,相關性分析提示LDL-C與FT3水平呈正相關,但并未發現LDL-C與FT4水平的相關性。最近有研究在甲狀腺功能正常的老年2型糖尿病患者中也發現了LDL-C與甲狀腺功能的這種相關性[14],即LDL-C與FT3水平呈正相關,而與FT4水平無明顯相關性。對于FT3水平 與LDL-C水平的這種相關性,究其原因,上世紀80年代一些動物實驗中已發現三碘甲狀腺原氨酸有促進肝細胞中膽固醇的合成的作用。臨床上他汀類藥物被廣泛應用,且有研究認為他汀類藥物有預防房顫復發的作用,本研究中,我們將LDL-C值按照四分位數轉換為有序變量,行以是否發生房顫為因變量的Logistic多因素逐步回歸分析,結果提示LDL-C<2.62 mmol/L對應著房顫發生率的增加有統計學意義,與Lopez等[13]報道一致。但我們認為LDL-C與房顫的關系仍需更多的研究加以證實。
年齡同樣是影響房顫發生的重要因素,Rotterdam研究的一個亞組分析表明85歲以上的老年人群,房顫發生率約17.8%,明顯高于低齡人群[15]。Gammage 等[16]的研究表明在>65歲以上的甲狀腺功能正常老年人群中,FT4水平仍是發生房顫的一項獨立危險因素。而在Calvo-Romero 等[7]的研究結果中,年齡>70歲的失代償慢性心衰患者有較高的FT4水平。在本研究中同樣發現年齡及心衰時間亦影響了心衰患者房顫的發生率,且FT3與年齡呈負相關,但本研究中并未發現FT3水平對心衰房顫律的影響,且未見FT4水平與年齡及心衰時間有明顯的相關性。
本研究的局限性是回顧性的研究。結合本研究的結果,慢性心衰患者中較高的FT4水平與房顫的發生相關,下一步我們擬針對甲狀腺激素與慢性心衰房顫發生率的關系進行隨訪性研究。另外,本研究中房顫組和竇性心律組中FT4絕對值差異不大,這與我們將甲狀腺功能明顯異常的患者排除在入選標準以外有關。而如何將研究的結果用于臨床實際是對我們今后工作的新的挑戰。
[1] De Ferrari GM, Klersy C, Ferrero P, et al. Atrial fibrillation in heart failure patients: prevale-nce in daily practice and effect on the severity of symptoms. Data from the ALPHA study re-gistry. Eur J Heart Fail, 2007 , 9: 502-509.
[2] 張晗, 張朝陽, 楊艷敏, 等. 心衰與非心衰的心房顫動患者現狀及死亡風險分析. 中國循環雜志, 2013, 28: 95-96.
[3] Frost L, Vestergaard P, Mosekilde L. Hyperthyroidism and risk of atrial fibrillation or flutter: a population-based study. Arch Intern Med, 2004, 164: 1675-1678.
[4] Heeringa J, Hoogendoorn EH, van der Deure WM, et al. High-normal thyroid function and risk of atrial fibrillation: the Rotterdam study. Arch Intern Med, 2008, 168: 2219- 2224.
[5] 國楊, 徐予, 唐熠達, 等. 冠心病合并房顫患者的甲狀腺激素水平變化及臨床意義. 中國循環雜志, 2013, 28: 133-134.
[6] Tang RB, Liu DL, Dong JZ, et al. High-normal thyroid function and risk of recurrence of atrial fibrillation after catheter ablation. Circ J, 2010 , 74: 1316-1321.
[7] Calvo-Romero JM, Rodríguez EM. Serum-free thyroxine and thyrotropin concentrations in euthyroid patients with decompensated congestive heart failure. Int J Cardiol, 2005, 102: 367-368.
[8] Frey A, Kroiss M, Berliner D, et al. Prognostic impact of subclinical thyroid dysfunction in heart failure. Int J Cardiol, 2013, 168: 300-305.
[9] Nattel S, Burstein B, Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications. Circ Arrhythm Electrophysiol, 2008, 1: 62-73.
[10] Carvalho-Bianco SD, Kim BW, Zhang JX, et al. Chronic cardiacspecific thyrotoxicosis incr- eases myocardial beta-adrenergic responsiveness. Mol Endocrinol, 2004, 18: 1840-1849.
[11] Watanabe H, Ma M, Washizuka T, et al. Thyroid hormone regulates mRNA expression and currents of ion channels in rat atrium. Biochem Biophys Res Commun, 2003, 308: 439-444.
[12] Peppa M, Betsi G, Dimitriadis G. Lipid abnormalities and cardiometabolic risk in patients with overt and subclinical thyroid disease. J Lipids, 2011, 2011: 575840.
[13] Lopez FL, Agarwal SK, Maclehose RF, et al. Blood Lipid Levels, Lipid Lowering medicatio-ns, and the Incidence of Atrial Fibrillation: The Atherosclerosis Risk in Communities (ARIC) Study. Circ Arrhythm Electrophysiol, 2012, 5: 155-162.
[14] Strollo F, Carucci I, Morè M, et al. Free Triiodothyronine and Cholesterol Levels in Euthyro- id Elderly T2DM Patients. Int J Endocrinol, 2012, 2012: 420370.
[15] Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atr-ial fibrillation: the Rotterdam study. Eur Heart J, 2006, 27: 949-953.
[16] Gammage MD, Parle JV, Holder RL, et al. Association between serum free thyroxine concentration and atrial fibrillation. Arch Intern Med. 2007, 167: 928-934.
Relationship Between Thyroid Hormone and Atrial Fibrillation Prevalence in Patients With Chronic Heart Failure
LIU Chen, YUAN Xiao-chen, ZHANG Zhen-gang, LUO Qiu-ping, YAN Jun-feng, GONG Kai-zheng, QIN Jian-hua, ZHOU Gui-jian.
Department of Cardiology, Yangzhou First People’s Hospital, Yangzhou (225000), Jiangsu, China
Objective: To investigate the impact of thyroid hormone on atrial fibrillation (AF) prevalence in patients with chronic heart failure (CHF).Methods: A total of 322 non-valvular heart disease CHF patients treated in our hospital from 2011-0-01 to 2012-10-01 were retrospectively studied. Based on previous history and the ECG at admission, the patients were divided into 2 groups: AF group, n=187 and Sinus rhythm group, n=135. The profile of serum levels of free thyroxine (FT4), free triiodothyronine (FT3), hyroid stimulating hormone (TSH) and LDL-C were examined within 24 hours of admission; 12 lead ECG and echocardiography were conducted to analyze the related factor for AF occurrence.Results: Compared with Sinus rhythm group, AF group had increased FT4 level as 14.52 (12.74, 15.85) pmol/L vs 13.11 (11.68, 14.85) pmol/L, P<0.001, while FT3 level was similar between 2 groups as 4.06 (3.76, 4.44) pmol/L vs 4.1(3.80, 4.52) pmol/L, P=0.250. Spearman related analysis indicated that FT4 level was positively related to left atrial dimension (LAD) (r=0.134, P=0.016), FT3 level was positively related to LDL-C (r=0.235, P<0.001) and negatively related to age (r=-0.268, P<0.001). Taking FT4 as the continuous variable, Logistic regression analysis indicated that FT4 level [OR=1.227, 95% CI (1.112-1.354), P<0.001], LAD [OR=1.154, 95% CI (1.105-1.205), P<0.001], age [OR=1.038, 95% CI (1.012-1.064), P=0.003], CHF duration [OR=1.111, 95% CI (1.021-1.209), P=0.015], LDL-C level [OR=0.689, 95% CI (0.493-0.963), P=0.029] wererelated to AF prevalence in CHF patients.Conclusion: High serum level of FT4 may increase the risk AF occurrence in CHF patients.
Thyroid hormone; Chronic heart failure; Atrial fibrillation
2014-08-25)
(編輯:梅 平)
225000 江蘇省,揚州市第一人民醫院 心內科
劉晨 主治醫師 碩士 主要從事心力衰竭的發病機制相關研究 Email:liuchen007@163.com 通訊作者: 劉晨
R541
A
1000-3614(2015)08-0749-04
10.3969/j.issn.1000-3614.2015.08.008

