基于線粒體COⅡ基因序列的中華蜜蜂地理種群的遺傳多樣性研究
劉振國,吉 挺*,沈 芳,梁 勤,羅岳雄
(1.揚州大學動物科學與技術學院,江蘇揚州 225009;2.福建農林大學蜂學院,福州 350002;3.廣東昆蟲研究所,廣州 510260)
蜜蜂遺傳多樣性是研究蜜蜂遺傳資源的重要組成部分,遺傳多樣性的研究對于了解中華蜜蜂的起源和品種分化具有重要的參考價值,是品種資源評價、保護與利用必不可少的內容。我國是世界上蜜蜂遺傳資源最為豐富的國家之一,擁有多樣性豐富的中華蜜蜂資源。和西方蜜蜂相比,中華蜜蜂具有抗病、抗逆性強、授粉植物種類多、養殖成本低和產品質量優等特點,是適應于我國山地丘陵養殖的優良蜂種(殷玲,2013)。然而由于長期以來保存不當以及對外來品種的引進,造成許多地區中華蜜蜂滅絕或群體規模急劇下降,很多中華蜜蜂的有利基因丟失。同時對于中華蜜蜂的起源與遺傳分化,學術界有著不同的結論(姜玉鎖,2007)。因此研究認識中華蜜蜂遺傳多樣性及親緣關系是保護和利用中華蜜蜂種質資源的前提,對于中華蜜蜂的起源進化、種質資源保護以及科學開發利用等研究都有重要的指導意義。
線粒體DNA(mtDNA)是細胞內染色體以外唯一存在的遺傳物質,分布于細胞胞質中。mtDNA 作為分子標記具有分子結構簡單、嚴格的母系遺傳、無重組、與核基因無共同序列、進化速率快、多拷貝及堿基替換率低等特點,可以從母系起源上確定品種間的遺傳關系(Gyllensten et al.,1991)。而蜜蜂作為一種群居的社會性昆蟲,蜂群內所有工蜂均是同一個蜂王的后代,所以蜜蜂是mtDNA 研究中最好的模式生物之一。中華蜜蜂mtDNA 中tRNAleu-COⅡ區段包含有一個tRNAleu基因和一個非編碼區,其中后者為蜜蜂屬特有(Cornuet and Garnery,1991)。近年來利用mtDNA 的tRNAleu-COⅡ區段遺傳多態性來研究蜜蜂的起源分化受到更為廣泛的關注,成為研究蜜蜂遺傳變異的最佳手段之一。
本研究應用mtDNAtRNAleu-COⅡ區段變異對我國境內不同地區中華蜜蜂的遺傳多樣性和彼此之間的親緣關系進行較全面的研究,分析中華蜜蜂資源的遺傳結構,為中華蜜蜂地理種群遺傳多樣性提供分子數據資料,以期對這些群體間的遺傳分化有更好地了解。
1 材料與方法
1.1 試驗材料
本研究所涉及的中華蜜蜂不同地理種群共20個,分布于我國18個省、市、自治區,基本涵蓋了現有中華蜜蜂的主要聚居區。樣本采集時間為2006年6月-2008年8月。采集蜂群呈野生或半野生狀態,每一個種群均隨機采集30 群樣本,其中隨機選擇10 群作為研究對象;每一個蜂群采集成年工蜂30 頭,隨機1 只工蜂作為試驗材料。樣本采集后用無水乙醇殺死并浸泡于2 mL 離心管中,各種群采樣數及采樣地點見表1。
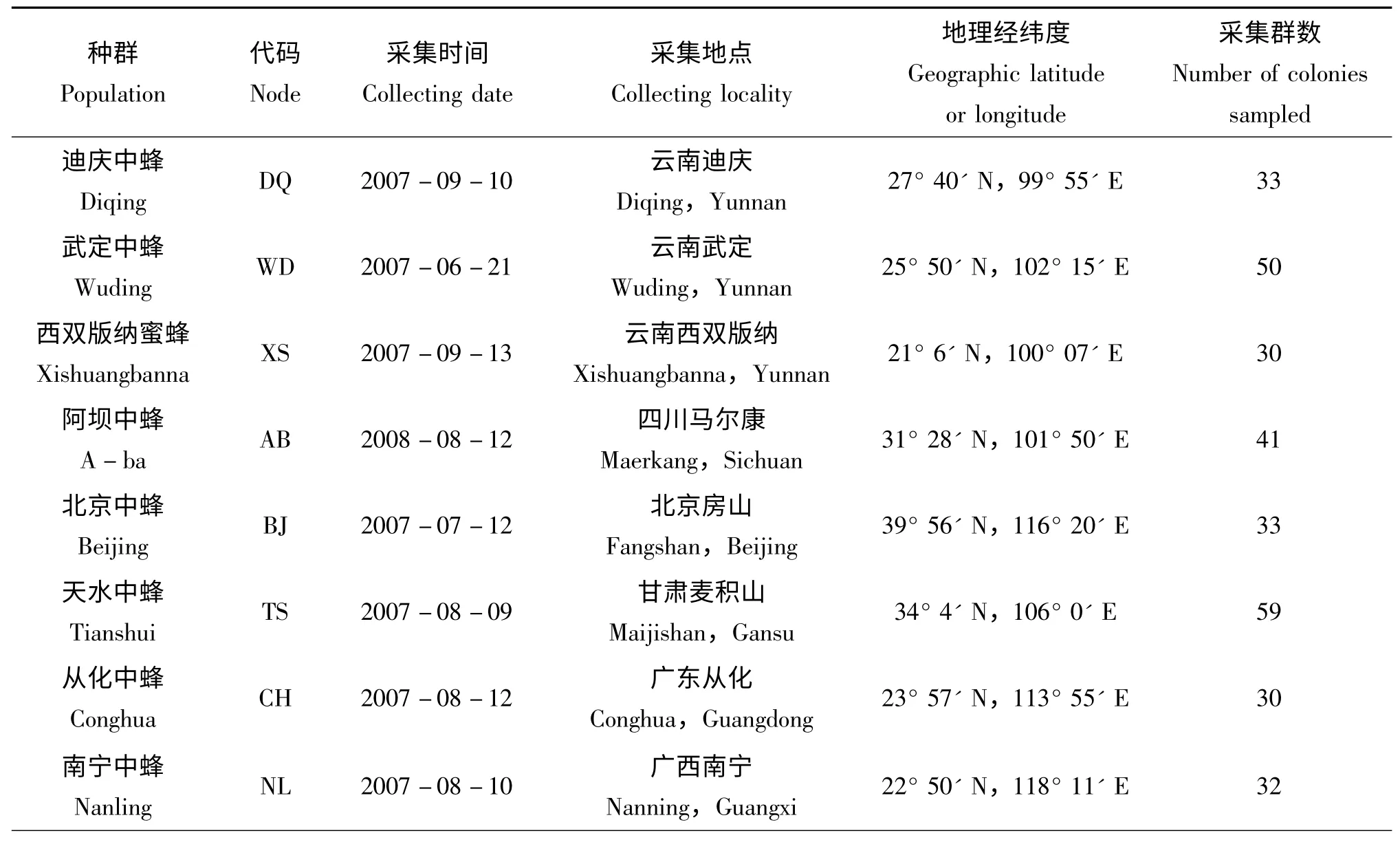
表1 20個中華蜜蜂地理種群樣本采集資料Table 1 Collecting data of 20 populations of Apis cerana cerana sampled from China
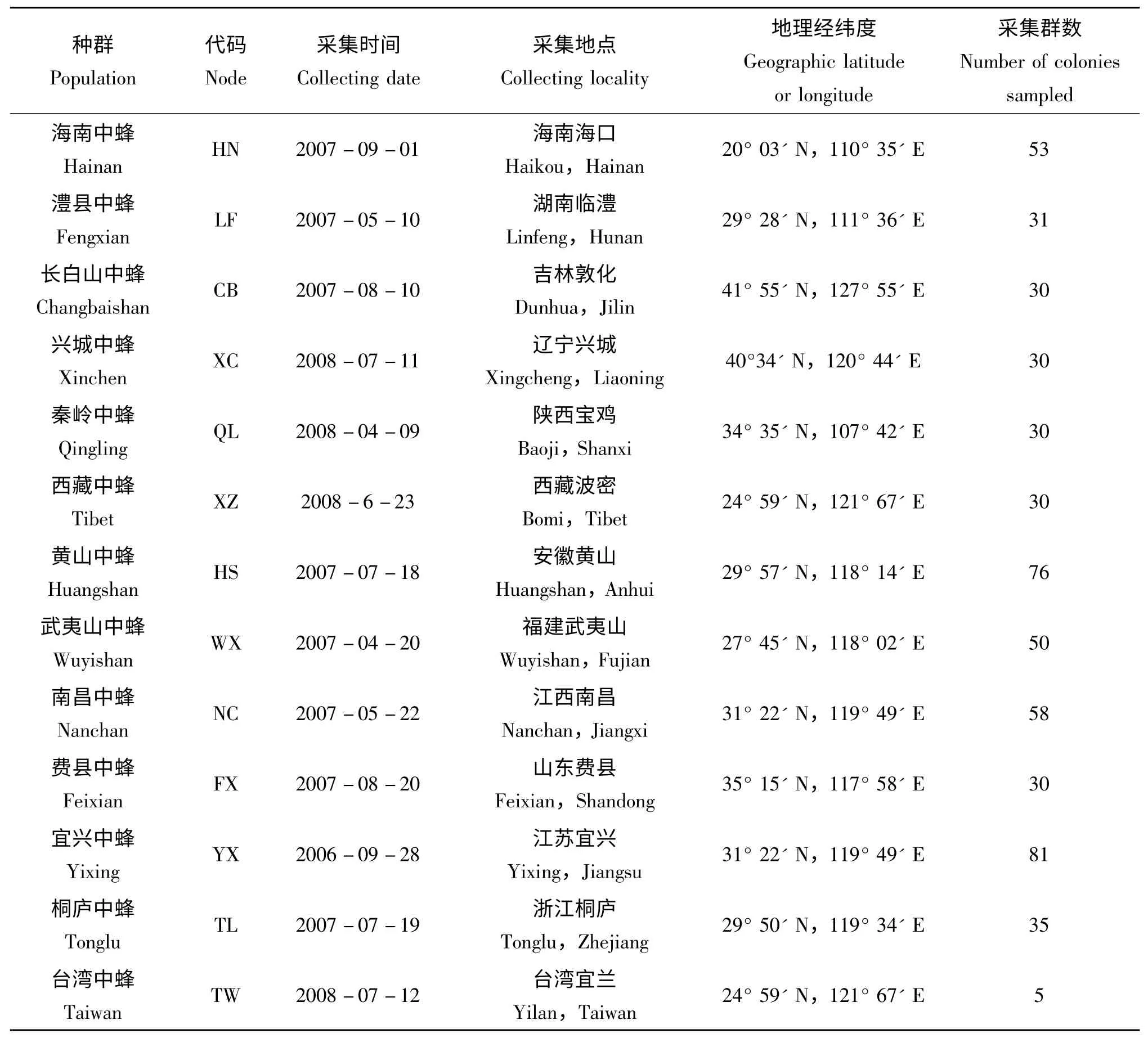
(續上表)
1.2 試驗方法
1.2.1 基因組DNA 提取
基因組DNA 提取參照吉挺等(2009)所建立的方法,提取的基因組DNA 用微量紫外可見光度計(NanoDrop ND-1000)測定其含量與純度,-20℃保存備用。
1.2.2 PCR 擴增
PCR 擴增采用了50 μL 的反應體系,其中含有約200 ng 的基因組DNA,10×buffer 5.0 μL,200 μmol/L dNTPs 每種2 μL,10 pmol 正向引物1 μL,10 pmol 反向引物1 μL,5 U Taq DNA 聚合酶0.5 μL,加ddH2O 補足50 μL,最后用石蠟油1 滴封閉反應系統。反應程序如下:96℃預變性3 min,然后94℃變性60 s,退火60 s,72℃延伸60 s,進行35個循環后,再72℃延伸5 min。采用2%的瓊脂糖(美國FMC 公司)經小量膠回收試劑盒(BBI,Canada)回收目的片段。
1.2.3 測序
分別取2.5-5.0 μL 回收產物用PCR 引物做測序反應,測序試劑采用Thermo Sequenase Cycle Squencing Kit(美國USB 公司),按公司推薦的方法進行,反應產物經Sephadex G250 柱(Sigma 公司)純化,真空干燥和變性后,使用LICOR 4200 DNA 自動分析儀(LI-COR Biotechnology Division,Lincoln,NE)進行序列分析。
1.3 統計方法及軟件應用
1.3.1 核苷酸序列多態性分析
核苷酸多樣性(nucleotide diversity,π)是衡量一個給定群體的mtDNA 多態性的更好的指標,其定義為:給定群體內隨機選取的mtDNA 序列間的平均每個位點的核苷酸差異數目。π 值越小,群體的多樣性程度越低。利用DnaSP 4.0 軟件(Rozas et al.,2003)分析序列的多態性,并估計序列的變異程度、核苷酸替代率等。
1.3.2 單倍型間的系統進化分析
對原始序列利用LI-COR Align IR 軟件進行多重比對后,利用 DnaSP 4.0 軟件(Badiou,2008)提取變異位點序列,合并單倍型;利用MEGA 3.1(Kumar et al.,2004)構建COⅡ序列的NJ(neighbor-joining method,鄰結法)、ME(minimum evolution method,最小進化法)及UPGMA(unweighted pair group method with arithmetric means,類平均法)分子系統樹;利用MEGA 3.1 計算基于Kimura 雙參數模型的遺傳距離,分析它們的起源及系統進化。用Arlequin 3.0軟件(Excoffier et al.,2005)中的AMOVA 計算群體間的分化水平(Fst)。
2 結果與分析
2.1 COⅡ基因片段的測序和序列分析
用751GD 型紫外可見分光光度計檢測提取的DNA 濃度和純度,根據檢測的DNA 濃度將提取的DNA 稀釋到100 ng/μL。PCR 擴增產物經1.5%瓊脂糖凝膠電泳檢測,片斷大小為480 bp 左右,部分PCR 擴增產物檢測結果見圖1。
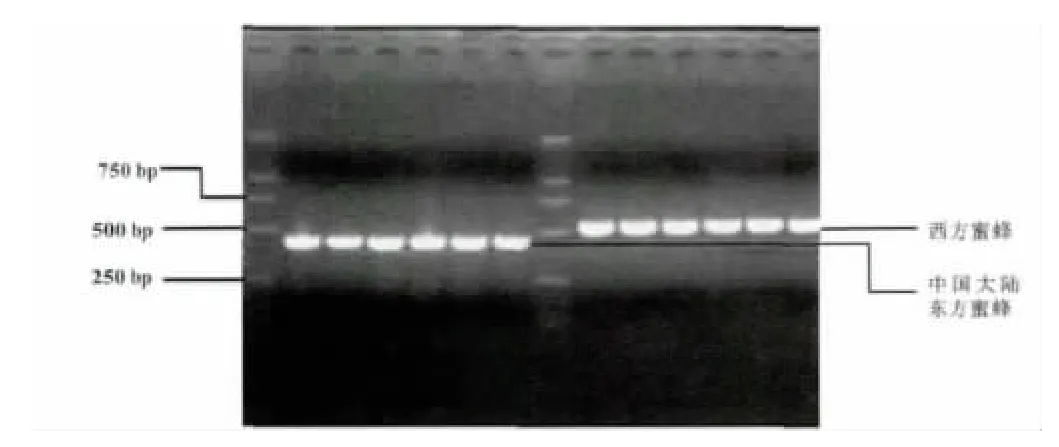
圖1 PCR 擴增產物在1.5%瓊脂糖凝膠上的檢測結果Fig.1 The result of detecting production of PCR by 1.5% agarose gel
本次試驗測定了20個中華蜜蜂地理種群共200個體的線粒體tRNAleu-COⅡ之間部分序列。對COⅡ基因序列截取1-259 bp 進行分析比較,變異位點為16個,變異率為6.18%,突變總數為18。其中單一多肽位點5個,簡約信息位點11個。16個變異位點中,轉換位點為15個,顛換位點為1個,沒有發現缺失和插入想象。在堿基組成上,A、C、G、T 這4種核苷酸的平均比例分別為38.2%(37.8%-38.6%)、10.0%(9.7%-10.4%)、4.6%(4.2%-5.0%)和 47.1%(46.7%-47.5%)。A+T 含量85.6%,G+C 含量14.6%。A+T 含量明顯高于G+C 含量,說明中華蜜蜂線粒體DNA COⅡ基因部分序列富含A+T,表現出堿基組成的偏倚性。
2.2 單倍型、核苷酸多樣度及中性檢驗分析
20個群體中共檢測到 18種單倍型(Haplotypes),分別命名為H1-H18。18種單倍型中,H1、H2、H6、H7、H13 等5種為共享單倍型,H2 包含的個體數最多,共出現120 次,分布于18個中華蜜蜂地理種群中,為各種群的主體單倍型,占個體樣本的60%。其余如下:H1 出現8 次(分布于3個中華蜜蜂地理種群中)、H6 出現21 次、H7 出現13 次、H13 出現11 次。其它13個單倍型均為各種群所特有。各種群之間單倍型類型和數目有差異,本次實驗測定的200 條序列中,武定中蜂和澧縣中蜂單倍型類型最多(4種),北京中蜂、天水中蜂和長白山中蜂單倍型類型最少(1種)。在20個中華蜜蜂地理種群中,迪慶中蜂、西雙版納蜜蜂、阿壩中蜂、從化中蜂、南寧中蜂興城中蜂、秦嶺中蜂、西藏中蜂、黃山中蜂、南昌中蜂和宜興中蜂與其他種群有2種共享單倍型,其余種群間有1種共享單倍型。
總種群單倍型多樣度(haplotype diversity,Hd)為 0.621,核苷酸多樣度(nucleotide diversity,Pi)為0.851%,核苷酸平均差異數(average number ofnucleotide differences,K)為0.939,核苷酸分歧度在0-0.965%變化。不同地理種群的單倍型多樣度在0-0.778,核苷酸多樣度在0-0.684%范圍內。
20個中華蜜蜂地理種群中性檢驗,對測定的20個中華蜜蜂地理種群CO Ⅱ基因序列采用Tajima's D 值進行中性檢驗,檢驗的前提是假設群體在長期進化過程中處于突變-漂移平衡狀態;所有的核苷酸都是等概率突變,而且受制于同一個群體動力學(Guez and Miller,2008)。20個群體中性檢驗的Tajima's D 值表明(表2),所有群體中性檢驗的Tajima's D 值介于:-1.63600 和1.46364 之間,經檢驗均不顯著(P>0.05),符合中性突變。
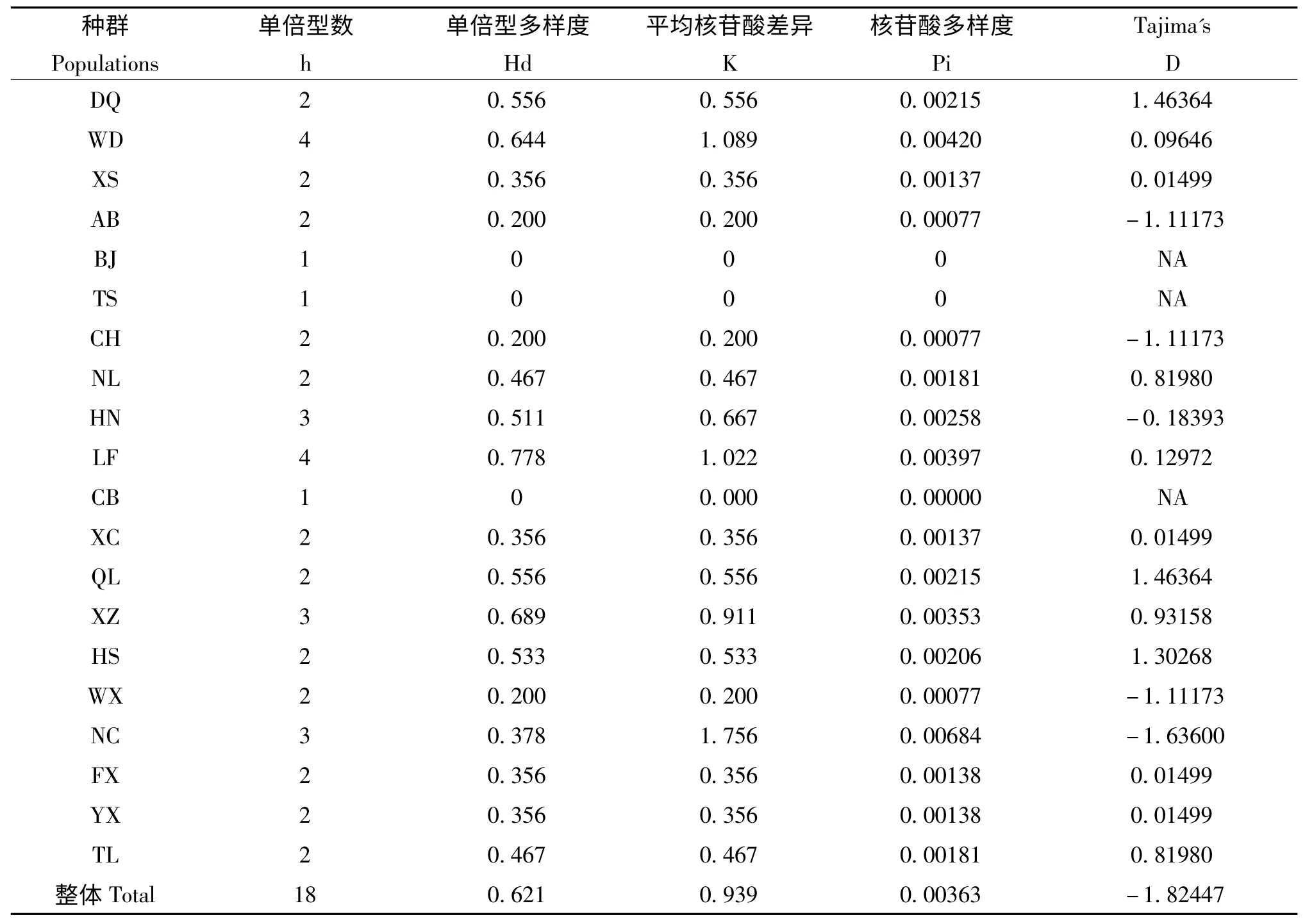
表2 20個中華蜜蜂種群體內COⅡ序列單倍型、核苷酸多樣性分析及Tajima's D 中性檢驗核苷酸多態性Table 2 COⅡhaplotype diversity,nucleotide diversity and Tajima's D neutrality test in different populations of 20 Apis cerena populations
2.3 COⅡ序列的分子系統樹
利用MEGA 3.1 軟件選擇Kimura 雙參數模型,分別構建了20個中華蜜蜂地理種群COⅡ基因的NJ、ME 和UPGMA 聚類圖(見圖2,3,4)。在所有的聚類圖中,UPGMA 分子系統樹與其他兩種分子系統樹的部分系統分枝存在差異,ME 和NJ聚類圖的結果完全一致。結果表明20個中華蜜蜂地理種群存在復雜的起源系統。
2.4 20個東方蜜蜂地理種群遺傳距離
東方蜜蜂地理種群間Kimura 雙參數距離見表3,可以看出各種群間遺傳距離變異范圍為0.000-0.011。阿壩中蜂與北京中蜂;天水中蜂、從化中蜂與長白山中蜂之間;北京中蜂與天水中蜂、長白山中蜂從化中蜂與武夷中蜂之間的遺傳距離最近,雙參數距離值為0;武定中蜂與海南中蜂和南昌中蜂之間的遺傳距離最遠,雙參數距離值均為0.011。從總體上,阿壩中蜂、北京中蜂等與其他品種的遺傳距離都較近,而武定中蜂與其它地方品種的遺傳距離都較遠。

圖2 20個中華蜜蜂地理種群mtDNA COⅡ序列NJ 分子系統樹Fig.2 NJ tree of mtDNA COⅡsequences in 20 Apis cerena populations

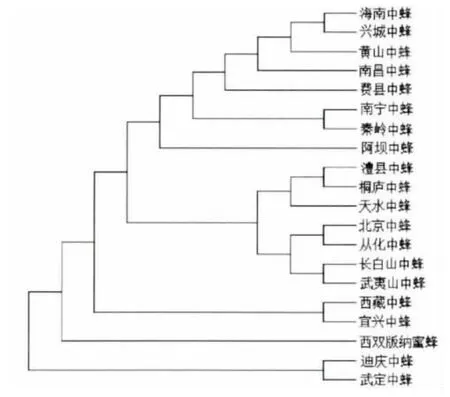
圖3 20個中華蜜蜂地理種群mtDNA COⅡ序列ME分子系統樹Fig.3 ME tree of mtDNA COⅡsequences in 20 Apis cerena populations
2.5 不同地理種群遺傳多樣性及遺傳分化分析
對mtDNA COⅡ序列的變異進行分子方差分析,總方差剖分為群體間的方差(Va)和群體內的方差(Vb),并進行顯著性檢驗,結果見表4。表4 所示,本試驗中,20個中華蜜蜂地理種群mtDNA COⅡ基因序列群體間的(Va)的方差組分占總變異的49.77%,群體內的方差組分(Vb)占總變異的50.22%。Fst=0.49788,差異極顯著(P<0.001),表明20個中華蜜蜂不同地理種群間存在顯著的遺傳分化。
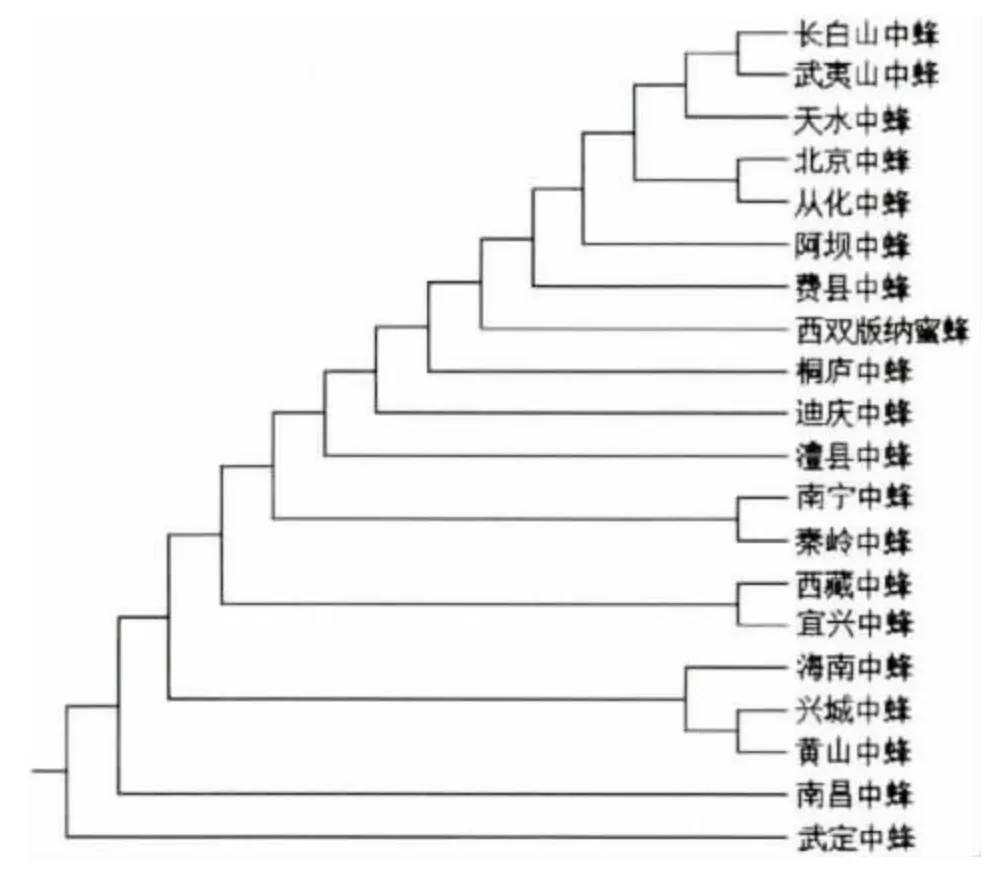
圖4 20個中華蜜蜂地理種群mtDNA COⅡ序列UPGMA 分子系統樹Fig.4 UPGMA tree of mtDNA COⅡsequences in 20 Apis cerena populations
對20個種群的遺傳分化作進一步分析,計算群體間的Fst 和相應的Fst P 值,結果見表3,武定中蜂與其他19個種群間Fst 值差異極顯著(P<0.01);宜興中蜂除與西藏中蜂間Fst 值差異不顯著(P=0.13514)外,與其他18個群體間Fst 值差異均極顯著(P<0.01);其余群體間Fst值差異均有分布。

表4 20個中華蜜蜂地理種群mtDNA COⅡ序列變異的分子方差分析Table 4 The hierarchical components of mtDNA variation analysis of Molecular Variance of COⅡamong 20 Apis cerena populations
3 結論與討論
3.1 20個地理種群mtDNA COⅡ的遺傳多態性
在使用mtDNA 對中華蜜蜂遺傳多樣性研究中,同類研究者均僅使用單倍型分析的方法對不同地理種群(型)進行聚類,普遍認為在同一采樣點的不同蜂群其mtDNA 中tRNAleu-COⅡ片段的核苷酸序列完全相同(王桂芝,2007),甚至認為地理位置相距遙遠的地區,如山西和河南,該片斷的核苷酸序列也是完全相同的(Excoffier et al.,2005)。本研究結果表明,即使在同一地區所采集的不同群體的樣本,有可能出現mtDNA 序列差異的情況,甚至部分地區樣本多態性較豐富,如武定中蜂和澧縣中蜂COⅡ基因單倍型類型就較多,達到4個。所以僅以判斷同一地理種群對應唯一單倍型進行聚類分析,結果必然是不全面的。
本研究測定了我國境內20個地理種群的mtDNA COⅡ片段的核在對COⅡ基因研究中,截取1-259 bp 進行分析發現中華蜜蜂mtDNA COⅡ部分序列富含A+T,表現出堿基組成的偏倚性,符合前人對mtRNA 的研究結果(謝進金等,2001)。蜜蜂mtDNA 中A+T 含量偏高的原因尚不清楚,但是有些自然突變進程有利于A+T 偏高的形成,例如鳥嘌呤傾向于通過堿化而轉變成O6-甲基鳥嘌呤,再與胸腺嘧啶錯配,導致GC 堿基對被AT 堿基對取代,線粒體內能產生內源性堿化劑,并且昆蟲的DNA 甲基修復轉移酶進入線粒體的效率比較低(譚墾等,2004)。
20個種群的核苷酸差異數為的平均值為0.939,核苷酸分歧度(Dxy)在0.1%-0.965%之間變化,說明不同種群之間核苷酸分歧度很大;核苷酸遺傳距離為-0.007%~1.489%,核苷酸遺傳距離差異也很大。20個中華蜜蜂地理種群COⅡ序列群體間的(Va)的方差組分占總變異為49.77%,Fst 分為0.4978,差異均極顯著(P<0.001),進一步表明20個中華蜜蜂不同地理種群間存在顯著的遺傳分化。
所測種群中共檢測到18種單倍型,其中5種為共享單倍型,其它13個單倍型均為各群體所特有,單倍型H2 包含的個體最多,共出現120 次,包含了本研究20個群體中的18個(武定中蜂與海南中蜂不在此列)。各群體之間單倍型類型和數目有差異,這是其它中華蜜蜂mtDNA 研究中沒有涉及的。結果表明,武定中蜂和醴縣中蜂單倍型類型最多,均各為4個,長白山中蜂的單倍型類型最少,分別為1個和2個。單倍型的類型也反映了群體的來源是否復雜,表明武定中蜂和醴縣中蜂具有較高的遺傳多樣性,而長白山中蜂的遺傳多樣性最低。
在對COⅡ基因研究中共發現16個變異位點,約占分析位點總數的6.18%,其中單一多態位點5個,簡約信息位點11個。沒有觀測到插入/缺失。核苷酸位點有兩種類型的變異,即轉換和顛換,16個變異位點中,其中轉換位點15個,占93.8%,顛換的位點1個,占6.2%,顛換和轉換之比為0.07。20個地理種群中只有武定中蜂、海南中蜂和南昌中蜂觀察到顛換現象。本研究結果與一些其他蜜蜂mtDNA 的報道也相符(Garnery et al.,1993;譚墾等,2004),這也與mtDNA 進化的特點一致。另外,本研究測定的變異率分別為6.18%,高于先前國內一些關于中華蜜蜂mtDNA 多態性的研究,這可能是由于本研究中涵蓋了我國境內絕大多數地理種群,相對他們的研究更為系統與全面。
3.2 地理距離與群體間mtDNA 遺傳距離的關系
mtDNA 是母系遺傳和非重組的,分子的各部分均共享同一祖先的相同歷史模式,因此可以在一定層次上了解蜜蜂不同地理種群的遺傳多樣性,還可以探討形成特定遺傳結構的歷史原因和地理原因(張亞平和施立明,1992)。很多研究結果都表明種群地理分布格局同地理隔離存在一定的相關性。
地理地貌的隔離一般會使地理種群間基因流動受到限制,從而促使地理種群的形成。但本研究選擇Kimura 雙參數模型構建的我國20個中華蜜蜂地理種群COⅡ區的NJ、ME 和UPGMA 聚類圖中,聚類結果并沒有依照地理位置的遠近而相應聚在一起,也充分說明了群體間遺傳距離與地理距離之間并不存在顯著關聯,各自的地理分布并不是影響其群體遺傳結構的決定因素。可能的原因是由于自然的選擇使不同地區蜜蜂間基因交流頻繁,從而使地理因素的影響微乎其微。
3.3 中華蜜蜂種群的起源
雖然對中華蜜蜂的分類多有爭論,但一般都認為中華蜜蜂包括了4-5個不同的亞種及多個不同的生態型,同時也認為中華蜜蜂都屬于亞洲大陸類型,相對于海島類型(日本蜜蜂、菲律賓蜜蜂等),與印度蜜蜂同一個起源(龔一飛和張其康,2000;陳盛祿,2001)。姜玉鎖通過對部分中華蜜蜂mtDNA tRNAleu-COⅡ片段的核苷酸序列的分析,將長白山中蜂與海南中蜂列入新的亞種之列(姜玉鎖等,2007)。但本研究選擇Kimura 雙參數模型構建的20個中華蜜蜂COⅡ區的NJ、ME和UPGMA 聚類圖中,聚類結果與已有研究大相徑庭,不能支持各蜜蜂分類學家的現有的結論。
從本研究結果分析,各地理種群間顯示出多個復雜的起源,可以推斷中華蜜蜂的來源應是多樣的,并且在種群形成的過程中,多個起源相互融合。具體分析有以下幾點原因:
中華蜜蜂多是以野生或半野生為主,大規模的商業育王和轉地飼養從未進行,這使得各地的中華蜜蜂都保持了相對原始的狀態;蜜蜂普遍具有較強的遷徙能力,特別是中華蜜蜂,所以在遺傳分化過程中,不同類群間的基因交流甚至基因融合都完全是可能的。
對于蜜蜂而言,mtDNA 相對要保守的多,mtDNA 上的變異主要體現在種與亞種上的變化,而對于亞種下的地理種群,變異并不明顯,這也是王桂芝(2007)、姜玉鎖(2007)得出同一地點采樣,單倍型完全相同的原因之一。所以通過對mtDNA 序列多態性的聚類往往不能反映群體間真實的親緣關系。
相對某些研究而言,本研究取樣廣泛,同時每個地區都采集相當數量的樣并對其中的10個樣本進行測序分析,但是否樣本量仍嫌不夠,尚需進一步分析。同時,本研究選擇的是蜜蜂mtDNA中一小段核苷酸進行分析,并不能完全代表整個線粒體變異水平,如果要得到全面的結論,蜜蜂線粒體全基因測序應是更好的選擇。
本研究認為,線粒體遺傳差異的結果往往是由于某些地理種群在獨特的生態環境下發生的。遺傳分化僅僅是地理種群間的差異,并沒發生亞種水平的分化,中華蜜蜂存在著復雜的起源。任何定義某一地區中華蜜蜂種群為亞種的結論很難成立。正因為遺傳差異是各地理種群在獨特生態環境下不斷適應和進化而產生的,這也就提醒我們在中華蜜蜂資源保護與利用時,一定要重視挖掘各地理種群存在的有益基因。
References)
Badiou A,Meled M,Belzunces LP.Honeybee Apis mellifera acetylcholinesterase-a biomarker to detect deltamethrin exposure[J].Ecotoxicol.Environ.Saf.,2008,69(2):246-53.
Chen SL.Chinese Bee[M].Beijing:China Agriculture Press[M].2001,687-688.[陳盛祿.中國蜜蜂學[M].北京:中國農業出版社,2001,687-688]
Cornuet JM,Garnery L.Mitochondrial DNA variability in honeybees and its phylogeographic implications[J].Apidoloqie,1991,22(6):627-628.
Excoffier L,Laval G,Schneider S.Arlequin(Ver.3.0):An integrated software package for population genetics data analysis[J].Evolutionary Bioinformatics Online,2005,1:47-50.
Garnery L,Solignac M,Celebrano G,et al.A simple test using restricted PCR-amplied mitochondrial DNA to study the genetic structure of Apis mellifera L.[J].Experientia,1993,49:1016-1021.
Gong YF,Zhang QK.Classification and Evolution of Bee[M].Fuzhou:Fujian Science and Technology Press,2000,231-232.[龔一飛,張其康.蜜蜂分類與進化[M].福州:福建科學技術出版社,2000,231-232]
Guez D,Miller RR.Blocking and pseudoblocking:the reply ofrattus norvegicus to Apis mellifera[J].Quarterly Journal of Experimental Psychology,2008,61(8):1186-98.
Gyllensten U,Wharton D,Josefsson A,et al.Paternal inheritance of mitochondrial DNA in mice[J].Nature,1991,352:255-257.
Jang YS,Liu WZ,Zhang CX,et al.AFLP analysis of genetic diversity of Apis cerana Fabricius distributed in different geographic areas in China[J].Acta Entomologica Sinica,2007,50(2):144-152.[姜玉鎖,劉文忠,張春香,等.中國境內不同地理型東方蜜蜂遺傳多樣性的AFLP 分析[J].昆蟲學報,2007,50(2):144-152]
Jang YS,Zhao HT,Jang JB,et al.Studies on mtDNA tRNAleu-COⅡGene polymorphisms of apis cerana distributed in different geographic areas in China[J].Scientia Agricultura Sinica,2007,40(7):1535-1542.[姜玉鎖,趙慧婷,姜俊兵,等.中國境內不同地理型東方蜜蜂線粒體DNA tRNAleu-COⅡ基因多態性研究[J].中國農業科學,2007,40(7):1535-1542]
Ji T,Yin L,Liu M,et al.Genetic diversity and genetic differentiation of six geographic populations of Apis cerana(Hymenoptera:Apidae)in East China[J].Acta Entomologica Sinica,2009,52(4):413-419.[吉挺,殷玲,劉敏,等.華東地區中華蜜蜂六地理種群的遺傳多樣性及遺傳分化[J].昆蟲學報,2009,52(4):413-419]
Kumar S,Tamura K,Nei M.MEGA 3:Integratedsoftware for molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004,5(2):150-163.
Rozas J,Sanchez-DelBarrio JC,Messegue X,et al.DnaSP DNA polymorphism analyses by the coalescent and other methods[J].Bioinformatics,2003,19:2496-2497.
Tan K,Zhang X,Zhou DY,et al.Diversity of Asia Apis cerana mtDNA[J].Journal of Yunnan Agricultural University,2004,19(2):227-230.[譚墾,張炫,周丹銀,等.亞洲部分地區東方蜜蜂mtDNA 多態性研究[J].云南農業大學學報,2004,19(2):227-230]
Wang GZ.Research on Diversity and Classification of Apis cerana from North-China[D].Shandong:Shandong Agricultural University,2007.[王桂芝.中國華北地區東方蜜蜂多樣性及其分類研究[D].山東:山東農業大學,2007]
Xie JL,Sun LX,Huang ZY.Apis of mtDNA research[J].Journal of Quanzhou Normal College(Natural Science),2001,19(2):54-58.[謝進金,孫亮先,黃周英.蜜蜂線粒體DNA 研究進展[J].泉州師范學院學報(自然科學版),2001,19(2):54-58]
Yin L.Identification and Vertification of Genes Involved with Varroa Destructor Resistance in The Eastern Honeybee(Apis cerana)[D].Jiangsu:Yangzhou University,2013.[殷玲.東方蜜蜂抗螨相關基因的篩選及初步驗證[D].江蘇:揚州大學,2013]
Zhang YP,Shi LM.The research situation of animal mtDNA[J].Zoological Research,1992,13(3):289-298.[張亞平,施立明.動物線粒體DNA 多態性的研究概況[J].動物學研究,1992,13(3):289-298]

