枯草芽胞桿菌T122F內生定殖及對香蕉枯萎病的防治效果
石妞妞, 杜宜新, 阮宏椿, 楊留水, 甘 林, 楊秀娟*, 陳福如
(1. 福建省農業科學院植物保護研究所, 福州 350013;2. 福建浦城綠安生物農藥有限公司, 南平 353400)
?
枯草芽胞桿菌T122F內生定殖及對香蕉枯萎病的防治效果
石妞妞1, 杜宜新1, 阮宏椿1, 楊留水2, 甘 林1, 楊秀娟1*, 陳福如1
(1. 福建省農業科學院植物保護研究所, 福州 350013;2. 福建浦城綠安生物農藥有限公司, 南平 353400)
為了明確枯草芽胞桿菌T122F菌株對香蕉枯萎病的生防作用,對菌株在香蕉體內的定殖特性及對盆栽香蕉苗的防治效果進行了研究。結果表明,T122F能在香蕉體內定殖和傳導,在香蕉根部、球莖、假莖和第2葉、第4葉中,T122F菌量的高峰分別出現在接種后第10、7、3、7、7天,菌量峰值分別為1.33×104、3.09×103、1.62×104、1.99×104和2.35×103cfu/g鮮重,T122F菌株在香蕉體內的消長動態表現為先增長后下降的趨勢。在接種枯萎病菌前4 d和后2 d分別采用200億活芽胞/g枯草芽胞桿菌T122F可濕性粉劑300倍液灌根1次,對香蕉枯萎病的防治效果達66.00%。
香蕉枯萎病; 枯草芽胞桿菌; 定殖; 防治效果
由尖孢鐮刀菌古巴專化型(Fusariumoxysporumf.sp.cubense)侵染引起的香蕉枯萎病又稱香蕉巴拿馬病、黃葉病,是制約香蕉生產的一種毀滅性土傳病害,在我國海南、廣東、廣西、云南、福建和臺灣等地嚴重發生并造成巨大的經濟損失[1-2]。目前生產上尚無防治香蕉枯萎病的特效藥劑,利用品種的抗病性是控制該病害最為經濟有效的措施之一,然而,我國香蕉抗枯萎病品種資源十分匱乏,一些較為耐病的香蕉品種也因農藝性狀不足而不被農民接受。
已有研究表明生物防治對土傳病害具有較好的防治效果[3-5]。Mohandas等研究發現,熒光假單胞菌(Pseudomonasfluorescens)對香蕉枯萎病防治效果明顯,能誘導香蕉產生對枯萎病的系統抗性[6]。Thangavelu從香蕉根圍土壤中分離出的哈茨木霉對香蕉枯萎病菌的菌絲生長具有顯著的抑制作用,防病效果達48%~51%[7]。王振中從香蕉體內分離到一株對香蕉枯萎病菌1號和4號小種均有很強拮抗活性的地衣芽胞桿菌(Bacilluslicheniformis),其溫室防治效果為80%[8]。Lian等研究表明,香蕉組培苗接種內生細菌后,有效抑制了香蕉枯萎病菌對組培苗的侵染,且對植株有一定促長作用[9]。余超從香蕉植株體內分離到的銅綠假單胞菌(Pseudomonasaeruginosa)對香蕉枯萎病的盆栽防效和田間防效分別達83.67%和82.00%[10]。開展香蕉枯萎病生物防治的研究越來越受到國內外研究者的關注[11],但利用枯草芽胞桿菌及其菌劑進行香蕉枯萎病生物防治的研究較少,殷曉敏等采用浸根處理發現,枯草芽胞桿菌B215對香蕉枯萎病的盆栽防效為62.95%[12]。
本實驗室以香蕉枯萎病菌為指示菌篩選出一批具有抑菌活性的拮抗菌株,其中拮抗菌T122F經鑒定為枯草芽胞桿菌,為進一步了解該菌對香蕉枯萎病的生防潛力,本試驗研究了該菌在香蕉體內的定殖特性及其菌劑對香蕉枯萎病的防治效果,以期為香蕉枯萎病的生物防治提供理論依據。
1 材料與方法
1.1 材料
菌株:枯草芽胞桿菌(Bacillussubtilis)T122F和香蕉枯萎病菌4號生理小種(Fusariumoxysporumf.sp.cubenserace 4)由福建省農業科學院植物保護研究所植病室提供。枯草芽胞桿菌用20%甘油保存,香蕉枯萎病菌用PSA斜面培養基保存。
植株:供試香蕉苗為‘臺蕉2號’(MusaAAA),苗齡為6~7葉期,由福建省漳州市農科所生物中心提供。
培養基:馬鈴薯蔗糖培養基(PSA)和牛肉浸膏蛋白胨固體培養基(NA)。抗生素:利福平(rifampicin,RIF),成都錦華藥業有限責任公司生產,用無水乙醇配成50 mg/mL的母液。
菌劑:200億活芽胞/g枯草芽胞桿菌T122F可濕性粉劑由浦城綠安生物農藥有限公司提供;藥劑:45%咪鮮胺乳油由北京中農研創高科技有限公司生產;試驗土壤:采自福建省福州市新店鎮菜園土。
1.2 方法
1.2.1 抗RIF標記T122F突變株的誘導及篩選
參照吳藹民[13]的方法并略加改進,將活化好的T122F菌株轉入含1 μg/mL RIF的NA平板中培養,挑取生長好的突變體菌落,接入相同RIF濃度的NA平板中培養3 d,然后轉入相同RIF濃度的NB液體培養基中培養3 d,再轉入含2倍RIF濃度的NA平板中培養3 d,后采用逐步提高藥物濃度的方法誘導培養,必要時可在相同藥物濃度的NB液體培養基中適應2~3代,直至篩選出在含400 μg/mL RIF的NA培養基上能穩定生長,且菌落形態及對病原菌的拮抗作用等保持不變的菌株,即為抗RIF標記的T122F突變株。
1.2.2 抗RIF標記T122F突變株在香蕉體內的定殖能力測定
將突變株接入含RIF 400 μg/mL的150 mL NB培養液中,在30 ℃,140 r/min條件下振蕩培養48 h,培養液經5 000 r/min離心20 min后棄上清液,取沉淀(菌體),用滅菌水配制成(5±1)×106cfu/mL的菌懸液,澆灌于盆栽香蕉苗根部,每盆澆灌菌液100 mL,接菌后第1、3、5、7、10、15、22天取樣分離,以不接菌為空白對照,每次取5株(重復)蕉苗進行香蕉根、球莖、假莖和葉(近基部第2葉、第4葉)內部標記菌株的分離。
將香蕉植株用清水清洗3次,用吸水紙吸除根、球莖、假莖、葉表面的水分后剪下稱重,75%乙醇表面消毒30 s,用0.1%升汞浸泡1.5~2.0 min,再用無菌水沖洗3次,無菌吸水紙吸除水分后,將表面消毒好的組織材料放入無菌研缽中研磨成糊狀,并加入鮮重10倍量的無菌水靜置15 min,浸出液用無菌水按10倍稀釋2個梯度,取稀釋液200 μL均勻涂抹于含400 μg/mL RIF的NA培養基平板上,每稀釋梯度3次重復,28 ℃黑暗條件下培養48 h后,記錄每皿單菌落數,并計算各部位平均每克鮮重組織的含菌量,用cfu/g鮮重表示。
1.2.3 T122F菌劑對香蕉枯萎病的防治效果測定
采用傷根灌菌法接種,香蕉枯萎病菌接種用分生孢子濃度為5×106cfu/mL,每株蕉苗灌菌液50 mL。T122F菌劑施用濃度為1∶100、1∶200、1∶300和1∶400倍液,設置7種菌劑處理方式,處理①~④:接枯萎病菌后2 d分別施菌劑1∶100、1∶200、1∶300和1∶400倍液1次;處理⑤:接枯萎病菌前4 d和后2 d施菌劑1∶300倍液各1次;處理⑥:接枯萎病菌前12 d和前4 d施菌劑1∶300倍液各1次;處理⑦:接枯萎病菌后當天施菌劑1∶300倍液1次。以接枯萎病菌后2 d施用45%咪鮮胺乳油1∶1 000倍液1次為藥劑對照,以澆灌清水為空白對照。以上各處理菌劑灌根使用量為100 mL/株,每處理7株香蕉苗,試驗4次重復。香蕉苗正常肥水管理,接病菌30 d后參照楊秀娟[14]的香蕉枯萎病病情分級標準,記錄每株蕉苗發病的外部癥狀和內部癥狀,計算每處理的病情指數和病害防治效果。
1.2.4 數據統計與分析
數據統計繪圖用Excel,數據統計分析用DPS 6.85軟件進行。
2 結果與分析
2.1 抗RIF標記的T122F突變株的獲得及分離回收結果
經RIF由低到高濃度的逐步誘導篩選,最終獲得菌落形態與原始菌株相似的抗RIF 400 μg/mL的T122F突變株,即抗RIF標記的T122F菌株。該菌株分離回收結果表明,菌液接種后可從香蕉植株的根、球莖、假莖、第2葉和第4葉共5個不同部位分離到標記菌株,對照中未發現該菌株(圖1),說明采用RIF標記可以進行該菌株在香蕉體內的定殖檢測,菌株可通過香蕉根部進入植株體內,并向上傳導到植株不同部位進行定殖。

圖1 香蕉植株不同部位標記菌株的分離結果(接種后10 d)Fig.1 Isolation of the marked strains from different parts of banana plantlets(10 days after inoculation)
2.2 抗RIF標記的T122F菌株在香蕉體內的定殖與消長動態
RIF標記的T122F菌株在香蕉苗體內消長動態測定結果(圖2)表明,灌根接種后1~22 d,菌株在根、球莖、假莖和葉片內定殖的菌量均呈不同的變化趨勢,總體以根部、第2葉定殖菌量明顯高于假莖、球莖和第4葉。菌株在根部定殖的菌量在接種后的1~10 d內呈波浪式上升趨勢,第10天出現1次明顯高峰,峰值為1.33×104cfu/g鮮重,后逐漸下降。在球莖定殖的菌量一直處于較低水平,僅在接種后第3天和第7天出現一個高峰(峰值分別為2.72×103cfu/g鮮重和3.09×103cfu/g鮮重),隨后菌量下降至低水平。在假莖定殖的菌量在接種后第3天出現一個高峰(峰值為1.62×104cfu/g鮮重),隨后菌量快速下降至低水平。在第4葉定殖的菌量也一直處于較低水平,自接種后的1~7 d內呈現上升趨勢,在接種后第7天出現1次高峰(峰值為2.35×103cfu/g鮮重)后逐漸下降。菌株在第2葉定殖的菌量明顯高于第4葉,在接種第7天出現1次明顯高峰(峰值為1.99×104cfu/g鮮重)后逐漸下降。

圖2 T122F菌株在香蕉體內的消長動態Fig.2 Population fluctuation of T122F strain in banana plantlets
2.3 不同濃度的枯草芽胞桿菌T122F菌劑對香蕉枯萎病的防治效果
試驗結果表明,不同濃度的T122F菌劑及45%咪鮮胺乳油在接菌后2 d施用能明顯抑制香蕉苗枯萎病的發展,在枯草芽胞桿菌菌劑的4個濃度處理中,以菌劑100倍液處理對香蕉枯萎病的防治效果最好,為63.44%,其防效與45%咪鮮胺EC 1 000倍液處理的效果(64.62%)相當,兩者無顯著性差異;菌劑200倍液、300倍液和400倍液處理的防效分別為47.49%、47.32%和41.28%,三者之間無顯著性差異(表1)。
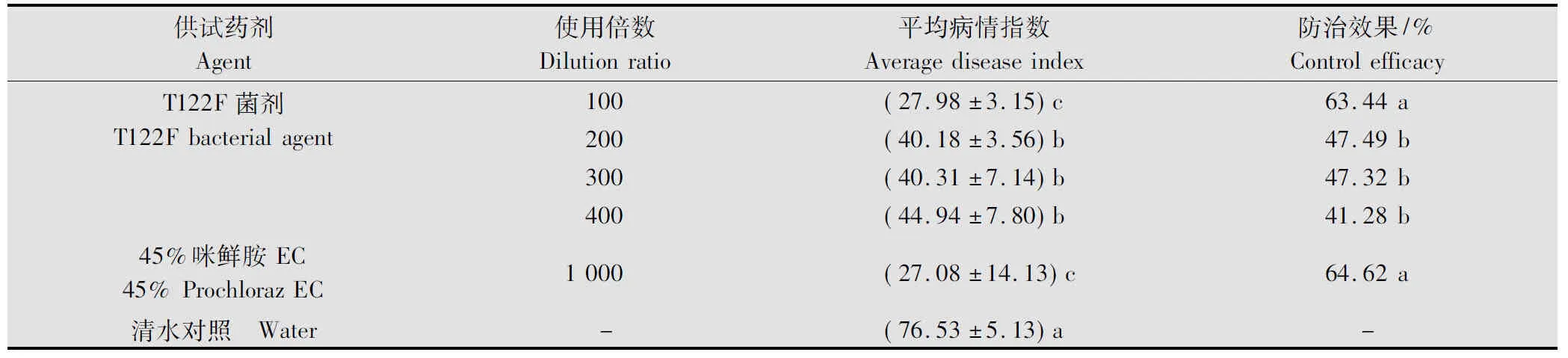
表1 不同濃度的T122F菌劑對香蕉枯萎病的防治效果1)
1) 同列數據后不同的小寫字母表示在 0.05水平差異顯著。下同。
Different lowercase letters in the same column indicate significant difference at 0.05 level. The same below.
2.4 不同時期施用枯草芽胞桿菌T122F菌劑對香蕉枯萎病的防治效果
在施用T112F菌劑的4個處理中,以接種病菌前4 d和后2 d各施用菌劑1次的防治效果最好,為66.00%,以接種病菌后2 d使用菌劑1次的處理防治效果最差,為47.32%,兩者之間有顯著差異。在接種病菌前或接種病菌后當天施用菌劑的防治效果均達60%以上(表2)。表明該菌劑宜在病菌侵入香蕉之前使用,對香蕉枯萎病的發生具有較好的預防作用。

表2 不同時期施用T122F菌劑對香蕉枯萎病的防治效果
3 小結與討論
香蕉枯萎病是一種難以根治的土傳病害,嚴重威脅香蕉產業的發展。目前,香蕉枯萎病的生物防治因其具有無公害和環境友好的特點而備受關注。在植物土傳病害的生物防治中,生防菌株能否在靶標植物體內定殖已成為篩選和評價土傳病害生防菌的重要指標之一。為此,一些研究者相繼開展了生防菌在香蕉根際及其體內的定殖研究,付業勤發現香蕉內生拮抗細菌在香蕉根、假莖、葉柄、葉片等組織中的定殖數量呈遞減趨勢[15];游春平研究發現拮抗細菌bio-d5在香蕉根際、根表和根內有較強的親和定殖能力[16];周林采用灌根法接種,發現枯草芽胞桿菌TR21標記菌株在香蕉根表和根際土壤中有較好的定殖能力,并能在香蕉體內定殖和傳導,定殖動態表現為“由升到降”的趨勢[17]。T122F菌株是本實驗室從健康香蕉根部分離出來的一株內生枯草芽胞桿菌,采用傷根接種,對其定殖能力測定表明,T122F菌株能在香蕉根、球莖、假莖及葉片內定殖,并以根內定殖的菌量最高,該菌株能通過香蕉根部向上傳導,但隨時間的推移,該菌在香蕉體內各部位的定殖數量明顯下降。研究結果預示適時補充香蕉根部的生防菌是保持香蕉體內一定的菌群數量、充分發揮生防菌防病功效的重要措施。
枯草芽胞桿菌由于能產生內生芽胞,具有很強的抗逆能力和抗菌防病的作用,國內外在農業領域中多以該菌制成菌劑,以生物農藥形式用于農業生產[18-20]。目前我國獲得農藥部登記注冊芽胞桿菌殺菌劑——百抗,其有效成分是枯草芽胞桿菌B908,通過營養競爭、位點占領等機制,對煙草、三七、小麥、白菜等作物土傳病害具有很好的防治效果,特別對水稻紋枯病的防治效果可達70%以上[21]。在前期試驗研究中,以芽胞量和發酵液抑菌活性為篩選指標,通過枯草芽胞桿菌T122F培養配方和培養條件優化,研制出200億活芽胞/g枯草芽胞桿菌T122F可濕性粉劑不僅含有抗逆性強的芽胞,還含有菌體發酵過程中產生的抑菌代謝產物。本研究采用人工傷根法接種,結果表明,該菌劑在病菌侵入香蕉前后各施用菌劑1次,對香蕉枯萎病的防治效果可達66%。張志紅等將腐熟的有機肥與3種生防細菌(枯草芽胞桿菌、膠質芽胞桿菌和巨大芽胞桿菌)混合,組合成生物復混肥和生物有機肥對香蕉枯萎病的防治效果分別可達61.5%和53.8%[22]。表明枯草芽胞桿菌T122F菌劑對香蕉枯萎病具有較好的防治效果。
研究還發現,T122F菌劑的施用濃度越高,對香蕉枯萎病的防治效果越好,但考慮到成本和田間菌源實際數量,建議以300倍液作為適宜的施用濃度。菌劑的施用時期對香蕉枯萎病的防效有明顯影響,在病菌侵入香蕉之前施用防效更好。生物防治具有無公害、無污染和防治作用專化性的特點,T122F菌劑的合理應用有望成為防治香蕉枯萎病的一種有效方法。
[1] 高喬婉.香蕉枯萎病[C]∥中國農業百科全書編輯部.中國農業百科全書.植物病理學卷.北京:中國農業出版社,1996:482-483.
[2] 陳厚彬. 從第九屆國際香蕉改良網絡亞太區咨詢委員會會議看亞太區和中國的香蕉研究與生產[J]. 柑桔與亞熱帶果樹信息, 2000, 16(3):6-8.
[3] 李長松. 拮抗性細菌生物防治植物土傳病害的研究進展[J]. 生物防治通報, 1992, 8(4):168-182.
[4] 董煒博, 宋協松. 植物土傳病害的生物防治[J]. 世界農業, 1992(11):40-41.
[5] 徐關娜, 王光華, 靳學慧. 土傳病害生物防治研究進展[J]. 吉林農業科學, 2005, 30(2):39-42.
[6] Mohandas S, Manamohan M, Rawal R D, et al. Interaction ofFusariumoxysporumf.sp.cubensewithPseudomonasfluorescensprecolonized to banana roots [J].World Journal of Microbiology & Biotechnology, 2004, 20(6):651-655.
[7] Thangavelu R, Palaniswami A, Velazhahan R. Mass production ofTrichodermaharzianumfor managing fusarium wilt of banana [J]. Agriculture,Ecosystems and Environment, 2004, 103(1):259-263.
[8] 王振中.香蕉枯萎病及其防治研究進展[J]. 植物檢疫, 2006, 20(3):198-200.
[9] Lian Jie, Wang Zifeng, Cao Lixiang, et al. Artificial inoculation of banana tissue culture plantlets with indigenous endophytes originally derived from native banana plants [J]. Biological Control, 2009, 51(3):427-434.
[10]余超, 肖榮鳳, 劉波, 等. 生防菌FJAT-346-PA的內生定殖特性及對香蕉枯萎病的防治效果[J]. 植物保護學報, 2010, 37(6):493-498.
[11]楊秀娟, 杜宜新, 甘林, 等. 香蕉枯萎病的生物防治和抗病育種研究進展[J]. 中國果樹, 2008(6):42-45.
[12]殷曉敏, 鄭服叢, 賀春萍, 等. 枯草芽孢桿菌B215生物學特性及對香蕉枯萎病的生防效果評價[J]. 熱帶作物學報, 2010, 31(8):1416-1419.
[13]吳藹民, 顧本康, 傅正擎, 等. 內生菌73a在不同抗性品種棉花體內的定殖和消長動態研究[J]. 植物病理學報, 2001, 31(4):289-294.[14]楊秀娟, 陳福如, 黃月英, 等. 接種枯萎病菌后香蕉苗病癥觀察及其組織病理特征[J]. 福建農林大學學報(自然科學版), 2006, 35(6):578-581.
[15]付業勤, 蔡吉苗, 劉先寶, 等. 香蕉內生細菌分離、活性評價及數量分布[J]. 熱帶作物學報, 2007, 28(4):78-83.
[16]游春平, 劉任, 肖愛萍, 等. 拮抗細菌bio-d5在香蕉根部定殖力的測定[J]. 華中農業大學學報, 2008, 27(3):363-366.
[17]周林, 程萍, 喻聞輝, 等. 枯草芽孢桿菌TR21在香蕉體內及根際的定殖動態[J].中國農學通報, 2010, 26(19):392-396.
[18]Stein T.Bacillussubtilisantibiotics:structures, syntheses and specific functions [J]. Molecular Microbiology, 2005, 56(4):845-857.
[19]姜莉莉, 陳彥闖, 辛明秀. 枯草芽孢桿菌在防治植物病害上的應用及研究進展[J]. 安徽農學通報,2009,15(7):37-39,110.
[20]王星云, 宋卡魏, 張榮意. 枯草芽孢桿菌菌劑的開發應用[J]. 廣西熱帶農業, 2007(2):32-35.
[21]徐欽.植物土傳病害的克星—百抗[J].當代農業,2002(11):34.
[22]張志紅, 李華興, 韋翔華, 等. 生物肥料對香蕉枯萎病及土壤微生物的影響[J]. 生態環境, 2008, 17(6):2421-2425.
(責任編輯:楊明麗)
Colonization and control efficacy ofBacillussubtilisT122F againstFusariumoxysporumf.sp.cubense
Shi Niuniu1, Du Yixin1, Ruan Hongchun1, Yang Liushui2, Gan Lin1, Yang Xiujuan1, Chen Furu1
(1. Institute of Plant Protection, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China; 2. Fujian Pucheng Lvan Biological Pesticide Co., Ltd., Nanping 353400, China)
To confirm the control efficacy ofBacillussubtilisT122F against banana wilt, the colonization and the control efficacy of T122F on banana plantlets were investigated in pot experiments. The results showed that the strain T122F could colonize and transmit in banana plantlets. The peaks of T122F concentration in the root, corm, pesudostem, the second leaf and the forth leaf appeared at 10, 7, 3, 7 and 7 d after inoculation with a peak number of 1.33×104, 3.09×103, 1.62×104, 1.99×104and 2.35×103cfu/g FW, respectively. The strain population showed a trend of “first increase and then decrease”. When banana plantlets were treated with 300 fold diluted solution of 2×1010cfu/g T122F wettable powder 4 days before and 2 days after pathogen inoculation, respectively, the control efficacy reached 66.00%.
Fusariumoxysporumf.sp.cubense;Bacillussubtilis; colonization; control efficacy
2014-06-08
2014-08-21
福建省發改委高新技術項目(2011-352);福建省自然科學基金(2011J01114)
S 436.681,S 482.292
A
10.3969/j.issn.0529-1542.2015.04.017
* 通信作者 E-mail:yxjzb@126.com

