APN1的原核表達及其與Cry1Ac蛋白體外結合
林慧巖, 周子珊, 束長龍, 高繼國, 張 杰*
(1. 東北農業大學生命科學學院, 哈爾濱 150030; 2. 中國農業科學院植物保護研究所,
植物病蟲害生物學國家重點實驗室, 北京 100193)
?
APN1的原核表達及其與Cry1Ac蛋白體外結合
林慧巖1,2, 周子珊2, 束長龍2, 高繼國1*, 張 杰2*
(1. 東北農業大學生命科學學院, 哈爾濱 150030; 2. 中國農業科學院植物保護研究所,
植物病蟲害生物學國家重點實驗室, 北京 100193)
本研究分析了Cry1Ac蛋白與棉鈴蟲BBMVs的結合情況;并將棉鈴蟲apn1基因的全長和片段在大腸桿菌Rosetta(DE3)中進行表達,利用Ligand blotting技術分析原核表達的APN1全長及4個片段與Cry1Ac蛋白的結合情況。結果表明:Cry1Ac蛋白可以與棉鈴蟲的BBMVs結合;在大腸桿菌中表達的棉鈴蟲受體蛋白APN1的全長、片段H1(33~257)、H2(258~547)和H3(548~798)可以與Cry1Ac蛋白結合,其中片段H3是首次發現可以與Cry1Ac蛋白結合。本研究的結果也為其他Bt蛋白受體的體外功能研究提供新的借鑒。
Cry1Ac蛋白; 棉鈴蟲; APN1; 原核表達; 結合位點
蘇云金芽胞桿菌(Bacillusthuringiensis,簡稱Bt)是目前世界上產量最大、使用最廣泛的微生物殺蟲劑。在菌體生長至芽胞期會產生殺蟲晶體蛋白,主要由cry和cyt兩大基因編碼[1],其中cry基因已被廣泛應用于轉基因植物的研究中,截至2014年,全球轉基因作物種植面積已達1.815億hm2,其中40%為抗蟲相關性狀[2]。由于cry1Ac基因表達產物對棉鈴蟲[Helicoverpaarmigera(Hübner)]、小菜蛾[Plutellaxylostella(Linnaeus)]、二化螟[Chilosuppressalis(Walker)]和亞洲玉米螟[Ostriniafurnacalis(Guenée)]等多種鱗翅目害蟲具有較好的殺蟲活性[3],已經在轉基因抗蟲棉花、玉米產業化中取得巨大成功[2]。
研究發現Cry毒素與昆蟲中腸上皮細胞刷狀緣膜囊(brush border membrane vesicles,簡稱BBMVs)上受體結合是對靶標害蟲產生活性的關鍵因素[4]。Cry1A類毒素可與多種鱗翅目昆蟲中腸蛋白結合,如氨肽酶N(aminopeptidase N,簡稱APN)、類鈣黏蛋白(cadherin-like protein,簡稱CAD)和堿性磷酸酶(alkaline phosphatase,簡稱ALP)[5-6],其中APN是研究較為廣泛的Cry蛋白的受體。APN屬于肽鏈端解酶,廣泛存在于動植物體內,在鱗翅目昆蟲中可以水解蛋白質或多肽N末端的氨基酸[7]。1994年,Sangadala等人首次證明煙草天蛾(ManducasextaLinnaeus)中120 kDa大小的蛋白具有氨肽酶的特點,并且可以與Cry1Ac蛋白結合[8]。隨后其他鱗翅目昆蟲如煙芽夜蛾[Heliothisvirescens(F.)]、小菜蛾、粉紋夜蛾(TrichoplusianiHübner)和棉鈴蟲的APN也相繼被鑒定為Cry毒素的受體[9-12]。近年來,也有研究發現鞘翅目昆蟲中腸上的APN可以作為Cry1B和Cry3Ba蛋白的受體[13-14]。2008年,常洪雷等人利用真核表達系統克隆了棉鈴蟲中腸APN1,并證明其可以與Cry1Ac蛋白結合[15]。
盡管大量研究表明昆蟲中腸APN1是Cry蛋白的重要受體之一,但APN1上Cry蛋白的識別位點相關報道較少。1999年Yaoi等人首次將家蠶(BombyxmoriLinnaeus)APN進行分段表達,并確定了APN與Cry1Aa的結合位點是135到198位氨基酸[16];2002年,Nakanishi等人發現,小菜蛾的APN和家蠶的APN有一個共有的Cry1Aa蛋白的結合區[17];2009年,Zhang等人將棉鈴蟲APN1的C端(892到982位氨基酸)進行體外表達,證明其可以與Cry1Ac蛋白結合[18],但棉鈴蟲APN1是否存在其他的結合位點仍不明確。由于Cry1Ac被廣泛應用于棉鈴蟲的生物防治中,因此分析Cry1Ac蛋白與棉鈴蟲BBMVs及APN1的結合情況,明確APN1與Cry1Ac蛋白的結合位點,將進一步揭示Cry蛋白與昆蟲受體APN1的互作方式,同時也為Cry蛋白受體的體外功能研究提供新的借鑒。
1 材料與方法
1.1 供試材料和試劑
pEB載體[19]、pET28a載體、大腸桿菌DH5α和Rosetta(DE3)菌株、蘇云金芽胞桿菌HD73菌株由本實驗室保存。室內棉鈴蟲標準試蟲由中國農業科學院植物保護研究所棉花害蟲組提供。Primer STAR HS、限制性內切酶和DNA連接試劑盒均購自TaKaRa公司;反轉錄試劑盒購自Thermo公司;PCR產物回收試劑盒與質粒小量提取試劑盒購自Axygen公司;NBT、BCIP和PVDF膜購自Promega公司。
1.2 Cry1Ac蛋白的制備
將HD73菌株于牛肉膏培養基中培養至50%晶體釋放,Cry1Ac蛋白提取、活化及純化參考文獻[3]的方法。以30∶1(生物素∶蛋白)的摩爾比對活化的Cry1Ac蛋白進行標記,室溫靜置1 h,置于脫鹽柱中離心除去過量的生物素。
1.3 棉鈴蟲中腸BBMVs的提取
棉鈴蟲BBMVs的提取參考文獻[20]。BBMVs經Bradford法定量后備用。
1.4 Cry1Ac毒素與棉鈴蟲BBMVs的體外結合
參照尹鳳翔等[21]的方法進行Cry1Ac毒素與棉鈴蟲BBMVs的結合分析。純化的Cry1Ac蛋白4 ℃ 12 000 r/min離心15 min,取上清備用;在棉鈴蟲BBMVs中加入適量標記好的Cry1Ac蛋白,以PBS binding buffer(含0.1% BSA和0.1 % Tween-20)補足至100 μL,室溫孵育1 h。30 000 r/min離心10 min,以100 μL PBS binding buffer洗滌2次。最后沉淀加入15 μL 1×上樣緩沖液后煮沸5 min,12 000 r/min離心5 min,吸取上清,進行SDS-PAGE分析及Western blotting檢測。
1.5 棉鈴蟲中腸RNA的提取
取棉鈴蟲中腸100 mg,加500 μL Trizol提取液和少量石英砂,研磨45 s;再加500 μL Trizol提取液,劇烈振蕩數次,室溫靜置5 min;加入約200 μL氯仿,劇烈振蕩幾次,室溫靜置10 min;4 ℃,12 000 r/min離心10 min;上清液轉移至新的離心管,加200 μL異丙醇,緩慢混勻,室溫靜置10 min;4 ℃,12 000 r/min離心10 min,棄上清;400 μL預冷的75%乙醇洗滌,4 ℃,12 000 r/min離心1 min,棄上清,自然干燥加20 μL DEPC水溶解。
1.6 cDNA的合成
cDNA的合成:取1 μg棉鈴蟲中腸RNA作為模板,按照Thermo公司反轉錄試劑盒操作說明進行cDNA第一條鏈的合成,反應體系如下:Olig (dT) Primer 2 μL,5×Reaction Buffer 4 μL,RiboLock Rnase Inhibitor 1 μL,10 mmol/L dNTP 2 μL,RevertAid M-MuLV 反轉錄酶 1 μL,RNA 1 μL,水(nuclease-free) 9 μL,至總體積20 μL。反應條件:42 ℃孵育1 h,然后70 ℃加熱5 min終止反應。
1.7 apn1全長及片段基因的克隆
根據GenBank公布的棉鈴蟲apn1基因的序列,用DNAMAN進行同源性分析,設計全長引物(表1),以RNA反轉錄產物cDNA稀釋1 000倍后作為模板,進行apn1全長基因的擴增,反應體系如下:2× Primer STAR HS 25 μL,引物對(APN1f/APN1r)各1 μL,模板0.5 μL,超純水補至50 μL。反應程序:94 ℃預變性5 min,然后按照以下條件進行30個循環:94 ℃,1 min;60 ℃,1 min;72 ℃,4 min;最終72 ℃延伸10 min。
首先利用DNAMAN軟件分析APN1氨基酸序列的保守區GAMEN和鋅指結構HEXXH。利用在線預測軟件SignalP 4.1 Server(http:∥www.cbs.dtu.dk/services/SignalP/)分析APN1的信號肽序列。通過在線分析軟件NetOGlyc 3.1和NetNGlyc 1.0 Server(http:∥www. cbs. dtu. dk/ services/)對APN1的糖基化位點進行預測。另有研究表明:APN1的N端(135~198)和C端(892~982)均可以與Cry1A類蛋白結合[16,18],根據氨基酸序列分析結果及已報道的Cry蛋白結合區,設計引物將棉鈴蟲APN1劃分為4個區域(表1),即片段H1(33~257)為去掉信號肽,但包含Yaoi等人報道的CryAa的結合區[16];片段H2(258~547)包含保守區GAMEN和鋅指結構HEXXH;H3(548~798);片段H4(799~1014)是富含蘇氨酸的區域,潛在的N連接的糖基化區域,包含Zhang等人報道的Cry1Ac的結合區[18]。
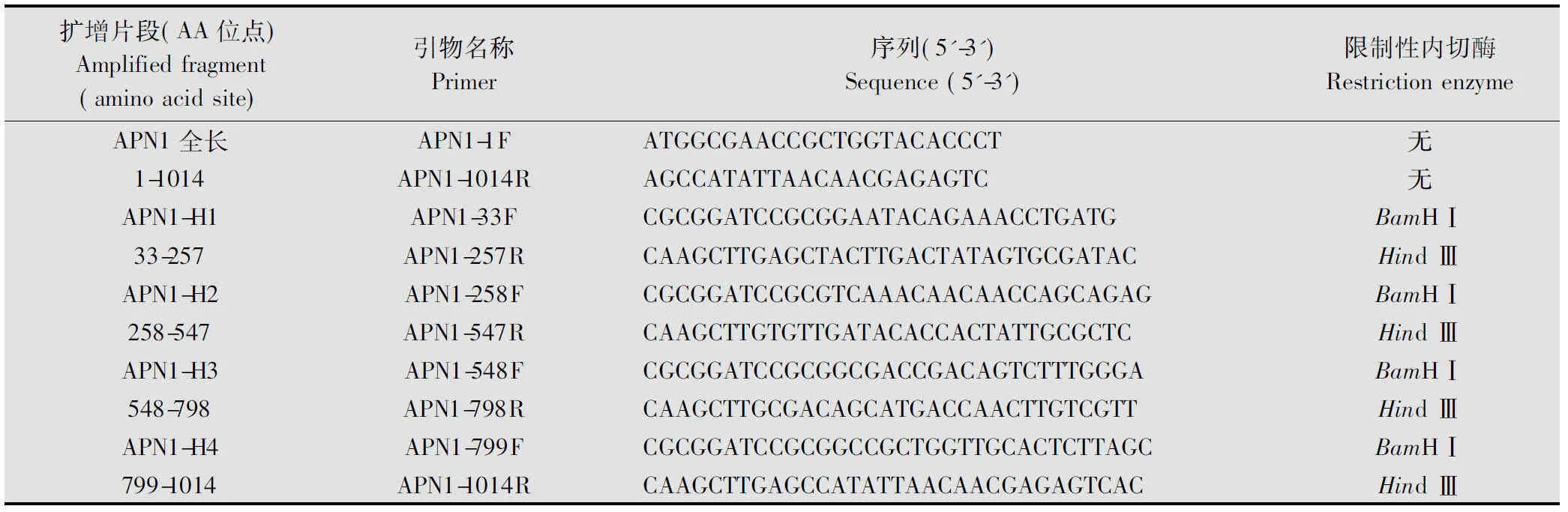
表1 apn1基因全長及分段克隆的引物
1.8 重組質粒的構建及鑒定
用限制性內切酶Ecl136Ⅱ對pEB載體進行酶切,將回收后的apn1全長的PCR產物與pEB載體連接,轉入DH5α感受態細胞中;以BamHⅠ和Hind Ⅲ對apn1片段和pET28a載體進行雙酶切,回收連接后,轉入DH5α感受態細胞中,重組質粒的轉化與陽性克隆的篩選參照分子克隆實驗指南[22],提取質粒進行PCR鑒定后送Invitrogen上海英駿生物技術有限公司北京分公司進行序列測定,將測序正確的陽性克隆質粒轉入E.coliRosetta(DE3)感受態細胞中,進行PCR鑒定。
1.9 重組蛋白表達及SDS-PAGE分析
誘導表達條件參照Novagen公司操作手冊,其中IPTG的終濃度為1.0 mmol/L,溫度為30 ℃,誘導表達6 h。提取E.coli表達的重組蛋白,SDS-PAGE電泳鑒定。凝膠經考馬斯亮藍染色后,小心切取蛋白條帶分裝于Ep管中,送往北京華大蛋白質研發中心有限公司進行質譜分析。
1.10 Ligand blotting分析
先將提取的棉鈴蟲APN1全長及片段進行SDS-PAGE分析,用Bio-Rad標準濕式轉膜裝置將蛋白轉移至PVDF膜上,PVDF膜在含有5%脫脂奶粉的TBS-T(10 mmol/L Tris-HCl pH 8.0,150 mmol/L NaCl,0.05% Tween 20)中室溫封閉2 h;TBS-T漂洗10 min,重復3次;將PVDF膜放入含有純化的活化的Cry1Ac蛋白(終濃度為1.0 mmol/L)室溫孵育1 h;TBS-T漂洗10 min,重復3次;一抗(Cry1Ac蛋白單克隆抗體)室溫孵育1 h,TBS-T漂洗10 min,重復3次;二抗(堿性磷酸酶標記的羊抗鼠的抗血清,購自Sigma)室溫孵育1 h,TBST漂洗10 min,重復3次,最后用NBT/BCIP進行顯色。以空載體pEB和pET28a在Rosetta(DE3)中誘導表達的蛋白為陰性對照,以活化的Cry1Ac蛋白為陽性對照。
2 結果與分析
2.1 棉鈴蟲BBMVs與Cry1Ac蛋白的結合分析
將終濃度為100 μg/mL的BBMVs分別與不同濃度的Cry1Ac蛋白混合,室溫孵育1 h,Western blotting結果(圖1)表明:Cry1Ac蛋白可以與棉鈴蟲的BBMVs結合,并且結合量隨著Cry1Ac蛋白濃度增加而增加。

圖1 不同濃度Cry1Ac蛋白與棉鈴蟲BBMVs的結合分析Fig.1 Binding analysis between different concentrations of Cry1Ac and BBMVs from Helicoverpa armigera
2.2 棉鈴蟲apn1在大腸桿菌Rosetta(DE3)的表達及質譜鑒定結果
預測棉鈴蟲APN1全長的分子量約為112 kDa,APN1片段H1的分子量為24 kDa,H2的分子量為32 kDa,H3的分子量為27 kDa,H4的分子量為24 kDa;但SDS-PAGE分析發現APN1全長(圖2a,條帶Ⅰ)實際分子量大于112 kDa;4個片段中(圖2b),H1和H4的實際分子量也分別高于預測的大小,這可能是由于蛋白疏水性太強,結構松散而引起的。在圖2a中,APN1全長與pEB空載體對照泳道相比,在70 kDa附近另有一條明顯的蛋白條帶存在(條帶Ⅱ),將圖2a中的條帶Ⅰ和Ⅱ進行質譜分析,質譜鑒定結果表明,條帶Ⅰ與棉鈴蟲中腸受體蛋白APN1(登錄號為17027158)的匹配分值為24 329,序列覆蓋率為61%;條帶Ⅱ與APN1的匹配分值為17 693,覆蓋率為50%,說明條帶Ⅰ與條帶Ⅱ都含有棉鈴蟲的APN1蛋白,條帶Ⅱ可能是條帶Ⅰ的降解片段。
2.3 Cry1Ac蛋白與APN全長及片段的結合分析
Ligand blotting分析結果顯示(圖3),與pEB空載體相比(圖3a),Cry1Ac蛋白與APN1全長片段
可以檢測到3條結合條帶,除圖2中檢測到的條帶Ⅰ和條帶Ⅱ以外,還發現100 kDa左右的條帶Ⅲ也可以與Cry1Ac蛋白結合。取SDS-PAGE檢測中條帶Ⅲ所對應的蛋白條帶進行質譜鑒定,結果表明:條帶Ⅲ與登錄號為17027158的棉鈴蟲中腸受體蛋白APN1匹配分值為25 865,序列覆蓋率為57%,因此,條帶Ⅲ也可能是APN1降解的片段。
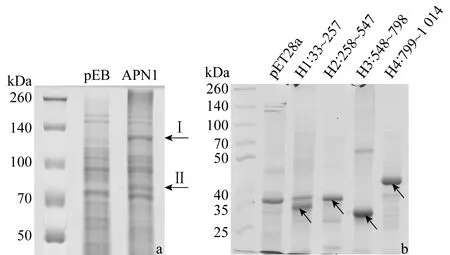
圖2 apn1基因全長(a)及片段(b)在Escherichia coli中表達分析(目的蛋白由箭頭指出)Fig.2 Analysis of expressed full-length (a) and the fragments (b) of apn1 gene in Escherichia Coli (Target proteins were indicated with arrows)
棉鈴蟲APN1片段與Cry1Ac蛋白的結合情況如圖3b所示,片段H1、H2和H3可以檢測到結合條帶,H4沒有檢測到結合條帶。如圖3c所示,沒與Cry1Ac蛋白孵育時,即使加入Cry1Ac單抗和相應的二抗,也檢測不到APN1片段的結合條帶,這說明,圖3b中檢測到的結合條帶即是能與Cry1Ac蛋白結合的條帶。
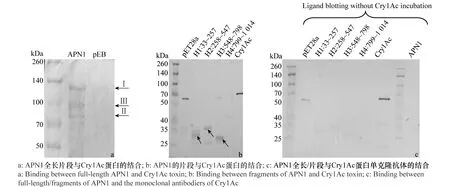
圖3 Ligand blotting分析APN1全長及片段與Cry1Ac蛋白的結合情況Fig.3 Binding analysis between full-length/the fragments of APN1 and Cry1Ac toxin by ligand blotting
3 討論
在Cry蛋白的作用機制中,與昆蟲中腸BBMVs的結合是其發揮殺蟲作用的基礎,也是決定殺蟲特異性的關鍵[4],與BBMVs的結合主要是與膜上受體結合,其中APN是研究較為深入的Cry蛋白受體,并且在多種昆蟲中,已明確Cry蛋白與APN1的結合是其發揮殺蟲作用的關鍵[9-10]。本研究證實Cry1Ac蛋白可以與棉鈴蟲的BBMVs結合,并發現它能與原核表達的受體蛋白APN1結合,這可能是Cry1Ac蛋白對棉鈴蟲表現出殺蟲活性的重要原因之一。
原核系統表達的APN與Cry蛋白的結合報道較少,前人的研究表明:Cry1Ac蛋白與APN1的結合依賴于糖基化[10,23]。但2009年Zhang等人將棉鈴蟲APN1的C端(892~982)進行原核表達,檢測到其可以與Cry1Ac蛋白結合[18],這說明雖然原核表達系統缺少翻譯后修飾等功能,但仍可以與Cry1Ac蛋白結合。本研究基于前人的研究結果,將棉鈴蟲中腸APN1的全長進行原核表達,并通過Ligand blotting證明Cry1Ac蛋白可以與原核表達的受體APN1結合,同時發現除棉鈴蟲APN1的全長表達產物(條帶Ⅰ)以外,APN1的片段100 kDa(條帶Ⅲ)和70 kDa(條帶Ⅱ)的蛋白也可以與Cry1Ac蛋白結合;這與Yaoi等人的研究結果相似[24],Yaoi等人發現原核系統中表達了家蠶中腸受體APN1及降解的片段可以與Cry1Aa蛋白結合。同時,本研究將棉鈴蟲的APN1進行了分段表達,同時分析了不同片段與Cry1Ac蛋白的結合情況。在分析APN1片段與Cry1Ac蛋白(圖3b)以及與Cry1Ac蛋白的單克隆抗體(圖3c)結合時,空載體pET28a在70 kDa附近均能檢測到一條結合帶,這說明70 kDa附近結合條帶是空載體pET28a的蛋白與Cry1Ac單克隆抗體之間的非特異結合產生的,而并不是與Cry1Ac蛋白的結合產生的。通過對比APN1片段與Cry1Ac蛋白(圖3b)及其單克隆抗體(圖3c)的結合情況,本研究發現H1、H2和H3 3個片段可以與Cry1Ac蛋白結合,片段H1包含了Yaoi和Nakanishi等人發現Cry1Aa的結合區;片段H2包含APN的兩個相對保守結構GAMEN和HEXXH;而片段H3是本研究首次鑒定出可以與Cry1Ac蛋白結合。與Zhang等人研究結果不同的是,本研究中的片段H4雖然包含Zhang等人發現的Cry1Ac結合區域,但本研究并沒有檢測到結合條帶,考慮到H4片段實際值約為45 kDa,是預測值24 kDa的近2倍,本研究也試圖通過加入DTT打開二硫鍵,或者加入6 mol/L尿素使蛋白變性,但SDS-PAGE檢測到的H4仍然為45 kDa,因此猜測可能是蛋白形成了穩定的二聚體,使結合位點不能暴露出來,因此檢測不到結合片段。
本研究不僅證明了Cry1Ac蛋白可以與棉鈴蟲BBMVs及原核表達的受體APN1結合,并且通過分段表達確定了棉鈴蟲APN1與Cry1Ac蛋白的結合位點,并首次發現片段H3(548~798)可以與Cry1Ac蛋白結合,這些工作為其他受體的體外功能研究提供參考。
[1] Crickmore N,Zeigler D R, Feitelson J, et al. Revision of the nomenclature for theBacillusthuringiensispesticidal crystal proteins [J]. Microbiology and Molecular Biology, 1998, 62(3): 807-813.
[2] James C. Global status of commercialized biotech/GM crops:2014 [M]. ISAAA Brief No. 49. ISAAA: Ithaca, NY,2014.
[3] Xue J, Liang G M, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin fromBacillusthuringiensiswith high toxicity to the Asian corn borer and other lepidopteran insects [J]. FEMS Letters, 2008, 280(1): 95-101.
[4] Bravo A, Gomez I, Conde J, et al. Oligomerization triggers binding of aBacillusthuringiensisCry1Ab pore-forming toxin to aminopeptidase N receptor leading to insertion into membrane microdomains [J]. Biochimica et Biophysica Acta, 2004, 1667(1): 38-46.
[5] Soberón M, Gill S S, Bravo A. Signaling versus punching hole:how doBacillusthuringiensistoxins kill insect midgut cells[J]. Cellular and Molecular Life Sciences, 2009, 66(8): 1337-1349.
[6] Pardo-Lopez L, Soberon M, Bravo A.Bacillusthuringiensisinsecticidal three-domain Cry toxins: mode of action, insect resistance and consequences for crop protection [J]. FEMS Microbiology Reviews, 2013, 37(1): 3-22.
[7] 常洪雷,梁革梅,于宏坤,等. 棉鈴蟲Bt毒素受體蛋白-氨肽酶N與抗性的關系[J]. 植物保護,2007,33(1):1-5.
[8] Sangadala S, Walters F S, English L H, et al. A mixture ofManducasextaaminopeptidase and phosphatase enhancesBacillusthuringiensisinsecticidal CryIA(c) toxin binding and86Rb+-K+effluxinvitro[J]. The Journal of Biological Chemistry, 1994, 269(13): 10088-10092.
[9] Luo K, Sangadala S, Masson L, et al. TheHeliothisvirescens170 kDa aminopeptidase functions as “Receptor A” by mediating specificBacillusthuringiensisCry1A δ-Endotoxin binding and pore formation [J]. Insect Biochemistry and Molecular Biology, 1997, 27(8): 735-743.
[10]Luo K, Tabashnik B E, Adang M J. Binding ofBacillusthuringiensisCry1Ac toxin to aminopeptidase in susceptible and resistant diamondback moths (Plutellaxylostella)[J]. Applied and Environmental Microbiology, 1997, 63(3): 1024-1027.
[11]Estada U, Ferre J. Binding of insecticidal crystal proteins ofBacillusthuringiensisto the midgut brush border of the cabbage looper,Trichoplusiani(Hübner) (Lepidoptera: Noctuidae), and selection for resistance to one of the crystal proteins[J]. Applied and Environmental Microbiology, 1994, 60(10): 3840-3846.
[12]王桂榮,梁革梅,吳孔明,等. 棉鈴蟲中腸氨基氨肽酶N基因的克隆及序列分析[J]. 中國農業科學,2003,36(11):1293-1300.
[13]Gómez J E, López-Pazos S A, Cerón J. Determination of Cry toxin activity and identification of an aminopeptidase N receptor-like gene inAsymmathetesvulcanorum(Coleoptera: Curculionidae) [J]. Journal of Invertebrate Pathology, 2012, 111(1): 94-98.
[14]Contreras E, Schoppmeier M, Real M D, et al. Sodium solute symporter and cadherin proteins act asBacillusthuringiensisCry3Ba toxin functional receptors inTriboliumcastaneum[J]. The Journal of Biological Chemistry, 2013, 288(25): 18013-18021.
[15]常洪雷,梁革梅,王桂榮,等. 棉鈴蟲中腸Cry1A受體蛋白氨肽酶N1在Tn細胞系的表達[J]. 中國農業科學,2008,41(6):1667-1672.
[16]Yaoi K, Nakanishi K, Kadotani T, et al.BacillusthuringiensisCry1Aa toxin-binding region ofBombyxmoriaminopeptidase N [J]. FEMS Letters, 1999, 463(3): 221-224.
[17]Nakanishi K, Yaoi K, Nagino Y, et al. Aminopeptidase N isoforms from the midgut ofBombyxmoriandPlutellaxylostella—their classification and the factors that determine their binding specificity toBacillusthuringiensisCry1A toxin [J]. FEMS Letters, 2002, 519(1): 215-220.
[18]Zhang S, Cheng H, Gao Y, et al. Mutation of an aminopeptidase N gene is associated withHelicoverpaarmigeraresistance toBacillusthuringiensisCry1Ac toxin [J]. Insect Biochemistry and Molecular Biology, 2009, 39(7): 421-429.
[19]張靜濤,束長龍,宋福平,等. 蘇云金芽胞桿菌cry2Ad基因的克隆及其表達產物的活性分析[J]. 生物技術通報,2009(10):145-150.
[20]Wolfersberger M G. The toxicity of twoBacillusthuringiensisdelta-endotoxins to gypsy moth larvae is inversely related to the affinity of binding sites on midgut brush border membranes for the toxins [J]. Experientia, 1990, 46(5):475-477.
[21]尹鳳翔,孫凱,束長龍,等. Cry1Ba3蛋白對亞洲玉米螟殺蟲活性測定及其與BBMVs的結合分析[J]. 植物保護,2014,40(2):20-27.
[22]薩姆布魯克 J, 拉塞爾 D W. 分子克隆實驗指南(上冊)[M]. 第3版. 北京:科學出版社,2002:98-99.
[23]Knight P J, Carroll J, Ellar D J. Analysis of glycan structures on the 120 kDa aminopeptidase N ofManducasextaand their interactions withBacillusthuringiensis[J]. Insect Biochemistry and Molecular Biology, 2004, 34(1): 101-112.
[24]Yaoi K, Nakanishi K, Kadotani T, et al. cDNA cloning and expression ofBacillusthuringiensisCry1Aa toxin binding 120 kDa aminopeptidase N fromBombyxmori[J]. Biochimica et Biophysica Acta, 1999, 1444(1): 131-137.
(責任編輯:田 喆)
Prokaryotic expression of aminopeptidase N1 fromHelicoverpaarmigeraand binding analysis with Cry1Ac toxininvitro
Lin Huiyan1,2, Zhou Zishan2, Shu Changlong2, Gao Jiguo1, Zhang Jie2
(1. College of Life Sciences, Northeast Agricultural University, Harbin 150030, China; 2. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Binding assay between Cry1Ac toxin and BBMVs fromHelicoverpaarmigerawas analyzed in this study. The full-length gene and the fragments ofapn1 were cloned and expressed inEscherichiacoliRosetta (DE3) strain. The binding between full-length/fragments of APN1 expressed inE.coliand Cry1Ac toxin was performed by Ligand blotting. The results showed that BBMVs fromH.armigeracould bind Cry1Ac toxin; the full-length APN1 and APN1 fragments H1(33-257), H2(258-547), and H3(548-798)expressed in prokaryotic system could bind Cry1Ac toxin. It was the first report that H3 (548-798) could bind with Cry1Ac. The results may provide a new clue for functional studies on other Bt toxin receptorsinvitro.
Cry1Ac toxin;Helicoverpaarmigera; aminopeptidase N1; prokaryotic expression; binding site

研究報告ResearchReports
2014-04-04
2015-02-23
國家自然科學基金(31272115)
S 476.1
A
10.3969/j.issn.0529-1542.2015.04.004
致 謝:感謝棉花害蟲組梁革梅研究員在試蟲和實驗技術等方面的支持和指導。
* 通信作者 E-mail: 高繼國gaojiguo1961@hotmail. com; 張杰jzhang@ippcaas.cn

