間充質干細胞對系統性紅斑狼瘡患者樹突狀細胞的免疫抑制作用
裘影影,何建強,湯 郁,李 晶
(江蘇大學附屬醫院1.風濕科,2.腎內科,江蘇鎮江212001)
間充質干細胞對系統性紅斑狼瘡患者樹突狀細胞的免疫抑制作用
裘影影1,何建強2,湯 郁1,李 晶1
(江蘇大學附屬醫院1.風濕科,2.腎內科,江蘇鎮江212001)
目的:探討間充質干細胞(mesenchyma1 stem ce11s,MSCs)在體外對系統性紅斑狼瘡(systemic 1upus erythematosus,SLE)患者外周血單核細胞來源樹突狀細胞(dendritic ce11s,DC)免疫功能的影響。方法:從人骨髓中分離培養MSCs,采用流式細胞儀(FCM)分析鑒定MSCs的純度。分離SLE患者外周血單核細胞,用重組人粒—巨噬細胞集落刺激因子(rhGM-CSF)、重組人白細胞介素4(rhIL-4)誘導培養DC的同時加入MSCs共培養,設立MSCs處理組,MSCs未處理組。在第7天收集細胞,流式細胞術檢測兩組DC表面CD 1a,CD14的表達。SLE患者的不成熟DC與MSCs共同培養加入終濃度為50 ng/mL的重組人腫瘤壞死因子-α(rhTNF-α)48 h后收集細胞,流式細胞術檢測兩組DC表面CD86、CD83、HLA-DR的表達。分別將MSCs處理或未處理的DC和T淋巴細胞共培養,72 h后用MTT法檢測DC刺激淋巴細胞增殖的能力。結果:與對照組相比,MSCs處理組DCs表面CD1a、CD86、CD83以及HLA-DR表達明顯下降(P<0.01),CD14表達明顯增高,對淋巴細胞的刺激能力明顯減弱(P<0.01)。結論:MSCs可能通過抑制SLE患者DC的發育、成熟和功能的途徑,抑制SLE患者的免疫反應。
間充質干細胞;系統性紅斑狼瘡;樹突狀細胞;免疫調節
間充質干細胞(mesenchyma1 stem ce11s,MSCs)是具有多向分化潛能的一類干細胞,具有免疫調節等功能[1]。細胞免疫應答時,環境中的可溶性外來抗原不能直接觸發T淋巴細胞,而是由抗原遞呈細胞(antigen-presenting ce11,APC)以特定方式呈遞給T淋巴細胞。樹突狀細胞(dendritic ce11s,DC)作為一類專職性APC,是刺激T淋巴細胞最強的、唯一能激活初始T淋巴細胞的APC。
系統性紅斑狼瘡(systemic 1upus erythematosus,SLE)是一種累及多系統、多器官的自身免疫性疾病,主要以T、B淋巴細胞高度活化,大量自身抗體產生和累及多器官組織為特點[2]。SLE患者體內高度活化的T、B細胞功能的異常多繼發于DC功能的缺陷,因此DC在SLE的發病中起重要作用[3]。研究表明MSCs可以抑制髓系或單核細胞來源的DC成熟,對DC具有免疫抑制作用[4]。目前MSCs對SLE患者DC影響的報道較少,本實驗主要探討MSCs對SLE患者外周血單核細胞來源DC免疫功能的影響。
1 材料與方法
1.1 材料與儀器
Perco11(質量濃度1.073 g/mL)為Pharmacia公司產品,RPMI 1640、胎牛血清及低糖-DMEM(Gibco公司),淋巴細胞分離液(Fico11,1.077 g/mL)購于上海恒信試劑公司,藻紅蛋白(PE)或異硫氰酸熒光素(FITC)標記的鼠抗人HLA-DR、CD86、CD83、CD1a、CD14、CD34、CD45、CD105、CD29、CD44單克隆抗體及相應的同型對照抗體(美國e Bioscience公司)。重組人粒—巨噬細胞集落刺激因子(rhGM-CSF)、重組人白細胞介素4(rhIL-4)、重組人腫瘤壞死因子-α(rhTNF-α)均為R&D公司產品。流式細胞儀(美國BD公司,FACSC a1ibur),紫外可見光掃描酶標儀(美國Bio-TEK公司,MQX200)。
1.2 病例
本實驗選取初發SLE患者10例,為我科2011年1月至2014年12月住院患者,均為女性,年齡16~54(33.10±11.33)歲。患者入院前均未使用糖皮質激素和免疫抑制劑,均符合1997年由美國風濕病學會推薦的SLE分類標準且SLE活動指數(SLEDAI評分)≥10分。
1.3 方法
1.3.1 MSCs的分離、培養及鑒定 采集成人健康志愿者骨髓10 mL,以Perco11梯度離心,吸取中間單個核細胞層,用PBS洗2次,以2×105/cm2的密度接種于含10%胎牛血清的低糖DMEM培養瓶中,在37℃、5%CO2培養箱中培養24 h。去除懸浮的細胞,每隔3 d換液,當有90%的貼壁細胞層融合時,以0.25%胰蛋白酶消化傳代培養,取第3代MSCs,分別與CD14、CD105、CD29、CD34、CD45、CD44單克隆抗體及同型單抗孵育20 min,PBS洗滌后,經流式細胞儀檢測,第3代的MSCs經鑒定和確定純度后凍存于液氮罐中備用。
1.3.2 DC的誘導、培養及鑒定 ①無菌抽取SLE患者外周靜脈血20 mL并采用肝素抗凝,Fico11密度梯度離心法收獲單個核細胞(2 000 r/min,20 min),PBS液洗滌2次(1 500 r/min,5 min)。②用含10%胎牛血清的RMPI-1640培養基重懸細胞,3×106/孔接種于24孔培養板中,37℃、5%CO2培養箱中孵育2 h后吸去非貼壁細胞,輕輕洗滌2次,加入含rhIL-4 10 ng/mL,rhGM-CSF 20 ng/mL的10%胎牛血清的RMPI-1640培養基1 mL,37℃、5%CO2培養箱中孵育,第3天、第5天各吸棄0.3 mL,加入含等量rhIL-4、rhGM-CSF的新鮮培養基0.5 mL。③部分細胞第7天加入rhTNF-α(50 ng/mL)促其成熟,第9天收獲懸浮細胞。加入FITC/PE標記的鼠抗人CD1a、CD14、CD83、CD86、HLA-DR單克隆抗體,流式細胞儀鑒定。
1.3.3 MSCs對SLE患者單核細胞來源DC分化的影響 在培養第0天,經20 Gy照射的MSCs與SLE患者單核細胞共培養,二者的數量比例為1∶10。分為MSCs處理組和MSCs未處理組。誘導體系為含rhGM-CSF(20 ng/mL),rhIL-4(10 ng/mL)和10%胎牛血清的RPMI-1640。誘導3 d后半量換液,在第7天收集細胞,標記熒光抗體,流式細胞儀檢測兩組DC表面CD1a、CD14的表達,觀察MSCs對SLE患者單核細胞來源DC分化的影響。
1.3.4 MSCs對rhTNF-α刺激SLE患者DC成熟的影響 在rhGM-CSF、rhIL-4誘導體系下培養7 d的SLE患者的不成熟DC中,加入終濃度為50 ng/mL的rhTNF-α,與經20 Gy照射的MSCs共同培養,MSCs與DC數量比例為1∶10,作為MSCs處理組。同時設立MSCs未處理組。各組繼續培養48 h后收集細胞,流式細胞儀檢測兩組DC表面HLA-DR、CD83、CD86和CD1a的表達。
1.3.5 MSCs對成熟DC刺激的淋巴細胞增殖的影響 效應細胞:按上述方法分離的外周血單個核細胞,貼壁2 h后吸取懸浮細胞,調整細胞密度為2× 106/mL作為效應細胞。刺激細胞:SLE患者的不成熟DC,加入終濃度為50 ng/mL的rhTNF-α,與經20 Gy照射的MSCs共同培養獲得成熟的DC,MSCs與DC數量比例為1∶10,分為MSCs處理組和MSCs未處理組。成熟的DC經20 Gy照射后調整細胞密度為2×105/mL作為刺激細胞。96孔板中每孔加入刺激細胞和效應細胞各100 μL,每組各設3個復孔,共培養72 h,在培養結束前4 h向各孔中分別加入MTT(5 mg/mL),培養結束后250×g離心5 min,棄上清,向各孔中加入二甲基亞砜,靜置10 min,以紫外可見光掃描酶標儀檢測各孔570 nm的光密度(D)值。
1.4 統計學處理
應用SPSS 18.0軟件進行統計分析,百分率數據經平方根反正弦轉換,計量數據用均數±標準差(±s)表示,組間比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 MSCs的分離培養和鑒定
MSCs培養3 d左右可見單個分散存在的克隆,呈現80%融合的時間為7~10 d,第3代MSCs形態均一,呈長梭形。流式細胞儀檢測第3代MSCs,均為CD44、CD29、CD105陽性,CD14、CD45、CD34陰性,純度鑒定達到了90%以上。
2.2 MSCs不能被誘導分化為DC
由于MSCs具有多向分化的潛能,我們首先觀察體外誘導DC的培養體系是否能誘導照射后的MSCs分化為DC。結果見圖1,在rhGM-CSF和rhIL-4作用7 d后,未發現MSCs表達CD14、CD1a、CD83、CD86。鏡下觀察仍然為貼壁的成纖維樣細胞,說明在此條件下MSCs不能被誘導分化為DC。
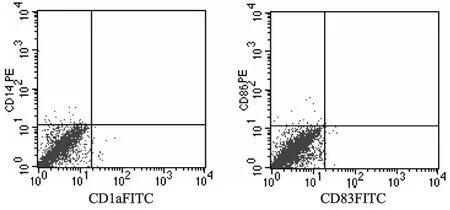
圖1 流式細胞術檢測MSCs向樹突狀細胞分化情況
2.3 DC的鑒定結果
SLE患者外周血單個核細胞貼壁2 h后,獲得的貼壁細胞為單核細胞,在含細胞因子的血清培養體系中誘導培養外周血單核細胞。隨著培養時間延長,細胞逐漸變大,第7天大部分細胞半懸浮生長,相對特異的表面分子CD1a表達率為(61.60±9.91)%。加入rhTNF-α刺激48 h促進DC成熟后細胞邊緣有明顯突起,細胞毛刺增多,細胞表面抗原HLA-DR表達率為(87.57±5.91)%、共刺激分子CD86表達率為(91.30±4.12)%,成熟標志CD83的表達率為(45.66±7.27)%。見圖2,圖3。
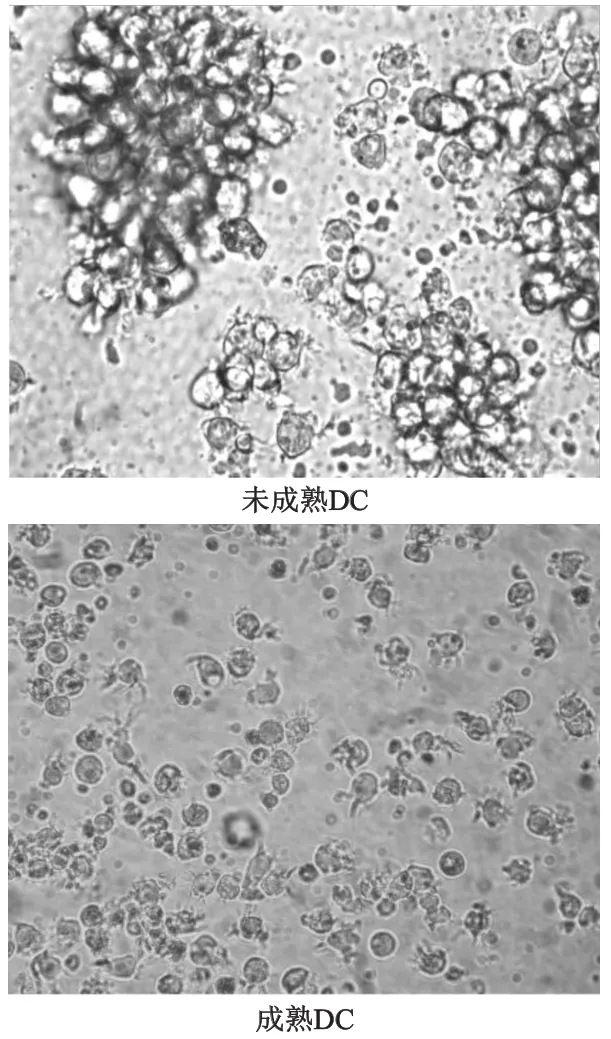
圖2 SLE患者單核細胞來源樹突狀細胞的形態
2.4 MSCs抑制SLE患者單核細胞來源DC的分化
SLE患者單核細胞在rhGM-CSF和rhIL-4的誘導條件下與MSCs共同培養7 d后,與MSCs未處理組相比,MSCs處理組的DC細胞體積雖然變大,但未見明顯毛刺(圖4);流式細胞術檢測結果顯示,MSCs處理組CD1a的表達率為(11.12±5.50)%,較MSCs未處理組的(61.60±9.91)%明顯下降(t=-14.08,P<0.01);MSCs處理組CD14的表達率為(47.46±4.65)%,較MSCs未處理組的(1.08±0.27)%明顯升高(t=31.47,P<0.01)。見圖5。說明在MSCs存在的情況下,SLE患者大部分單核細胞沒有分化為DC。
2.5 MSCs抑制SLE單核細胞來源DC的成熟
SLE患者單核細胞用rhGM-CSF和rhIL-4培養7天獲得不成熟的DC,在rhTNF-α存在的條件下,將其與MSCs共同培養2 d后收集細胞,流式細胞術檢測結果發現,MSCs處理組DC較MSCs未處理組DC表面標志物CD86、CD83、HLA-DR的表達均顯著降低(P<0.01),提示MSCs能抑制SLE患者未成熟DC的成熟(圖6)。
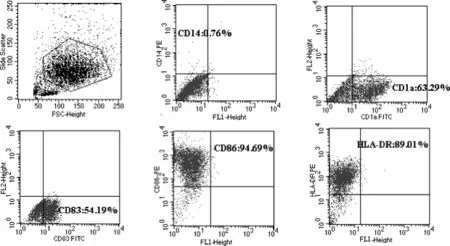
圖3 流式細胞術檢測樹突狀細胞的細胞表型
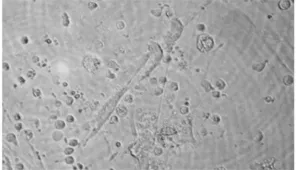
圖4 MSCs共同培養的樹突狀細胞形態
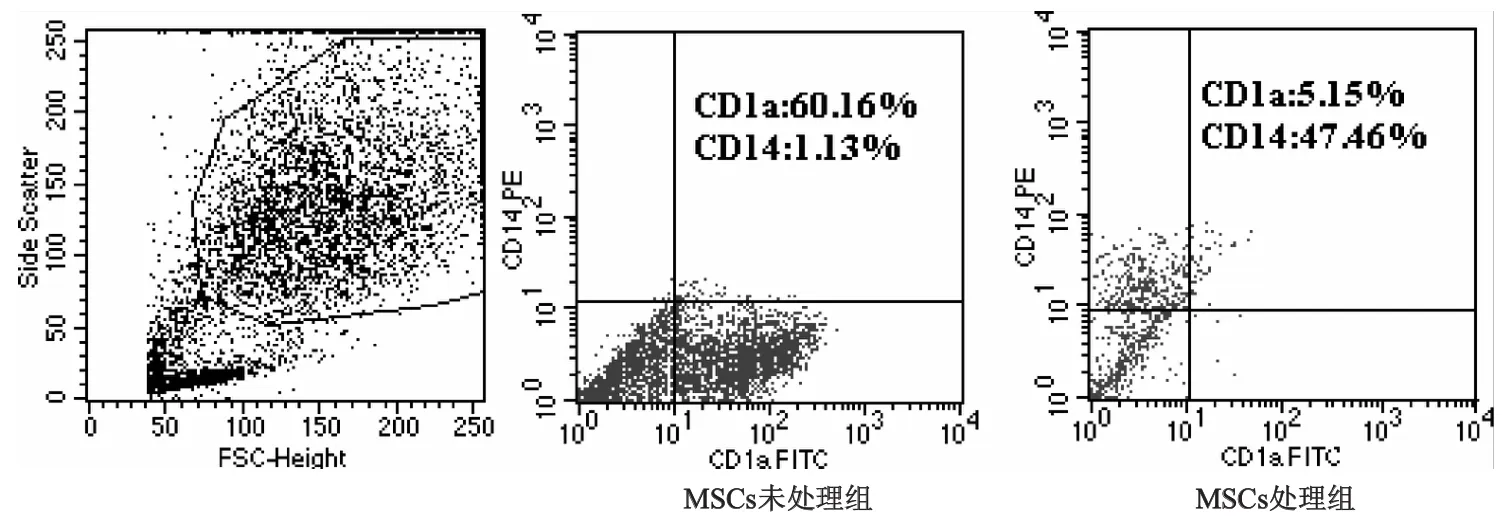
圖5 不同培養條件對樹突狀細胞表型的影響
2.6 MSCs抑制成熟DC刺激同種異體淋巴細胞的增殖
MTT法檢測結果表明,MSCs處理組淋巴細胞D值為0.313±0.050,較MSCs未處理組的0.873± 0.048明顯降低(t=24.12,P<0.01)。說明經MSCs處理后,SLE患者DC刺激淋巴細胞增殖的能力明顯下降。
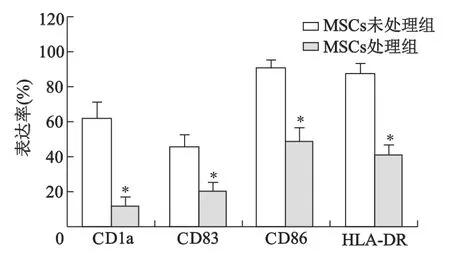
*:P<0.01,與MSCs未處理組比較圖6 MSCs抑制樹突狀細胞的成熟
3 討論
SLE主要特征是體內存在大量的自身抗體,這些抗體的產生依賴于T淋巴細胞[5],而T淋巴細胞的激活及分化又依賴于APC。DC是目前認為作用最強的APC,它可以通過遞呈抗原肽MHC復合物的作用激活T淋巴細胞,DC和抗原信號及炎癥因子共同決定了初始CD4+T淋巴細胞向Th1或Th2分化[6]。SLE患者體內過量的自身反應性T淋巴細胞可能是由DC異常信號傳遞所誘導的,因此目前認為DC異常是SLE發病機制之一[7]。
MSCs具有低免疫原性,體內外實驗均證實MSCs具有較強的免疫抑制作用[8],但其中的作用途徑和機制目前不是很明確。由于MSCs具有多向分化的潛能,我們首先檢測了在加入rhGM-CSF和rhIL-4的情況下,經直線加速器照射的MSCs能否被誘導分化為DC,結果提示MSCs不能被誘導分化為DC。
為了探討MSCs是否通過對免疫始動者DC的調節作用來抑制SLE患者T淋巴細胞的增殖,我們進行了MSCs對SLE患者單核細胞來源DC功能影響的實驗,結果顯示,MSCs對SLE患者DC的發育、成熟和功能均有負調控作用。MSCs可以使DC刺激淋巴細胞增殖的能力顯著下降;在DC的分化階段,MSCs可以明顯抑制SLE患者單核細胞向DC的分化,抑制DC上CD1a表達的上調,使其喪失攝取抗原的能力;在DC成熟階段,MSCs可以顯著抑制共刺激分子CD86、抗原呈遞分子HLA-DR和成熟標志物CD83的表達。Ger1等[9]發現在SLE活動期,DC的表面標志如CD83、HLA-DR明顯增高,提示SLE患者DC分化和T、B淋巴細胞分化均異常增加;同時DC表面的共刺激分子CD86也明顯增高。CD86是APC表面提供協同刺激信號的重要分子,它調節著T淋巴細胞的增殖反應及效應功能,因此認為CD83、CD86、HLA-DR與SLE發病及進展具有密切關系。MSCs可能通過抑制SLE患者DC共刺激分子的表達、抑制DC的成熟和抗原遞呈能力,進而抑制特異性T淋巴細胞的免疫活性,因此MSCs有誘導SLE免疫耐受的可能。
我們同時發現將DC和MSCs共培養時DC突觸數量減少,這可導致DC表面積減小,引起MHC-Ⅱ類分子不能充分發揮其捕獲抗原和提呈的作用,導致了DC免疫效應的下降。
綜上,MSCs可以抑制SLE患者DC的分化、成熟,抑制DC刺激異體淋巴細胞增殖,從而推斷MSCs可能是通過調節DC而抑制T淋巴細胞,進而改變SLE患者的免疫反應。
[1] Wang S,Qu X,Zhao RC,et a1.Mesenchyma1 stem ce11s ho1d promise for regenerative medicine[J].Front Med,2011,5(4):372-378.
[2] Nagy G,Koncz A,Per1 A.T-and B-ce11 abnorma1ities in systemic 1upus erythematosus[J].Crit Rev Immuno1,2005,25(2):123-140.
[3] Mackern-Oberti JP,L1anos C,Vega F,et a1.Ro1e of dendritic ce11s in the initiation,progress and modu1ation of systemic autoimmune diseases[J].Autoimmun Rev,2015,14(2):127-139.
[4] Sadeghi L,Kama1i-Sarvestani E,Azarpira N,et a1.Immunomodu1atory effects of mice mesenchyma1 stem ce11s on maturation and activation of dendritic ce11s[J].Iran J Immuno1,2014,11(3):177-188.
[5] Mou1ton VR,Tsokos GC.T ce11 signa1ing abnorma1ities contribute to aberrant immune ce11 function and autoimmunity[J].J C1in Invest,2015,125(6):2220-2227.
[6] Bri1ot F,Strowig T,Munz C.NK ce11s interactions with dendritic ce11s shape innate and adaptive immunity[J]. Front Biosci,2008,13(17):6443-6454.
[7] Chan VS,Nie YJ,Shen N,et a1.Distinct ro1es of mye-1oid and p1asmacytoid dendritic ce11s in systemic 1upus erythematosus[J].Autoimmun Rev,2012,11(12):890-897.
[8] De Migue1 MP,Fuentes-Ju1ián S,B1ázquez-Martinez A,et a1.Immunosuppressive properties of mesenchyma1 stem ce11s:advances and app1ications[J].Curr Mo1 Med,2012,12(5):574-591.
[9] Ger1 V,Lischka A,Panne D,et a1.B1ood dendritic ce11s in systemic 1upus erythematosus exhibit a1tered activation state and chemokine receptor function[J].Ann Rheum Dis,2010,69(7):1370-1377.
Immunosuppressive effects of mesenchymal stem cells on dendritic cells in systemic lupus erythematosus
QIU Ying-ying1,HE Jian-qiang2,TANG Yu1,LI Jing1
(1.Department of Rheumato1ogy,2.Department of Nephro1ogy,the Affi1iated Hospita1 of Jiangsu University,Zhenjiang Jiangsu 212001,China)
Objective:To investigate the immunoregu1atory effects of mesenchyma1 stem ce11s(MSCs)on periphera1 monocyte-derived dendritic ce11s(DC)in systemic 1upus erythematosus(SLE)patients in vitro. Methods:MSCs were iso1ated and expanded from human bone marrow ce11s.The purity of MSCs was identified by f1ow cytometry(FCM).The monocytes were iso1ated from periphera1 b1ood of SLE patients and cu1-tivated into DC with cytokines such as rhGM-CSF and rhIL-4 for 7 days.Set up the MSCs treated group and MSCs untreated group.Co11ected the ce11s on the 7th day,f1ow cytometry was used to detect the expression of DCs′surface markers CD1a,CD14 in these two groups.The immature DCs of SLE patients were co-cu1-tured with MSCs with adding the rhTNF-α at the fina1 concentration 50 ng/mL.The ce11s were co11ected after 48 hrs.We used f1ow cytometry to check the expression of DCs′surface marker CD86,CD83,HLA-DR in these two groups.The processed or not processed DC by MSCs were co-cu1tivated with T 1ymphocytes respective1y.After 72 hrs the abi1ity of DC stimu1ating 1ymphocytes pro1iferation was detected by MTT.Results:In vitro,compared with contro1 group,expression of CD1a,CD86,CD83 and HLA-DR were significant1y decreased in MSC-treated group(P<0.01),expression of CD14 was significant1y increased(P<0.01),the abi1ity of DC stimu1ating 1ymphocytes pro1iferation was decreased(P<0.01).Conclusion:MSCs can inhibit DC differentiation and function in SLE patients which may p1ay an important ro1e in its immunosuppressive affects in SLE.
mesenchyma1 stem ce11s;systemic 1upus erythmatosus;dendritic ce11s;immunoregu1atory effects
R593.241
A
1671-7783(2015)06-0477-05
10.13312/j.issn.1671-7783.y150142
2015-06-27 [編輯] 何承志
鎮江市科技局社會發展項目(SH2012022);江蘇大學臨床醫學科技發展基金資助項目(JLY2010119)
裘影影(1976—),女,江蘇鎮江人,副主任醫師,碩士,主要從事干細胞與自身免疫性疾病的研究;李晶(通訊作者),教授,碩士生導師,E-mai1:11686662@qq.com

