柚皮多糖提取分級及分子質量的分布*
郭文,陶紅,于立梅,趙瑞峰,馮志斌,梁慧
1(仲愷農業工程學院輕工食品學院,廣東廣州,510225)
2(廣東中煙工業有限公司技術中心,廣東廣州,510620)
柚子屬于蕓香科柑橘,是大眾化的水果之一,廣東梅縣柚子是廣東省“三高”農業戰略龍頭產品,目前梅州金柚的栽培已近百年歷史,全市總面積2.67萬hm2,產量30萬t以上,全省金柚產量高達40萬t,是全國最大的金柚商品生產基地。1995年被國家首批百家中國特產之鄉組委會命名為“金柚之鄉”。
柚子皮占整個柚子的43%~48%,含有多種對人體健康有益的非營養性生理活性成分,如黃酮類化合物、活性多糖、類檸檬苦素、香精油、天然色素、膳食纖維等,這些成分高于柚果實[2-4]。柚皮具有抑菌、抗氧化且具有止咳、化痰、理氣、抗炎、止癢等功效[5-6]。
目前多糖提取方法主要有水浸提法、酸堿提取法、微波提取法等,而本研究則利用復合酶提取柚皮多糖。
1 材料與方法
1.1 材料
蜜柚采自梅州柚子園,選擇同品種、大小、果色均勻、成熟度基本一致,無機械損傷、無病蟲侵染等蜜柚作為試驗材料。將果皮切成薄片在恒溫干燥箱進行烘干,粉碎機將其磨成粉末備用。試劑為分析純葡萄糖,無水乙醇,丙二醇,5%苯酚,濃H2SO4,去離子水,三氯甲烷,正丁醇,活性炭等,均購于廣州一馬生物科技有限公司。果膠酶,天津酶制劑廠;纖維素酶,上海伯奧生物科技有限公司。
1.2 儀器
DU-730型紫外可見分光光度計(日本島津分析儀器廠);恒溫水浴鍋(廣東環凱微生物科技有限公司);電熱恒溫培養箱(上海索譜儀器有限公司);旋轉蒸發器RE-52AA(上海亞榮生化儀器廠);凝膠滲透色譜(美國Waters公司)。
1.3 實驗方法
1.3.1 復合酶提取制備柚皮多糖條件優化
1.3.1.1 液料比對多糖得率的影響
準確稱量30 g柚粉,纖維素酶和果膠酶的酶均在添加量1%、溫度45℃、pH 6.5,液料比分別按10∶1、15∶1、25∶1、30∶1、35∶1處理,混勻,恒溫酶解,反應結束后,將其置于100℃水浴中10 min使酶滅活,冷卻至室溫,離心,在上清液中加入無水乙醇至最終濃度為80%,4℃靜置12 h,置于4 000 r/min離心機中離心20 min,收集沉淀。測定沉淀物多糖含量及計算得率。
1.3.1.2 酶解時間對多糖得率的影響
準確稱量30 g柚粉,纖維素酶和果膠酶的酶均在添加量1%、溫度45℃、pH 6.5,酶解時間分別按30、60、90、120、150、180 min 處理,同上。
1.3.1.3 酶解溫度對多糖得率的影響
纖維素酶和果膠酶的酶均在添加量1%,液料比、酶解時間和pH按照確定的最佳值,酶解溫度分別按 40、45、50、55、60、65℃處理,同上。
1.3.1.4 酶添加量對多糖得率的影響
酶解時間、液料比、酶解溫度和pH值按照確定的最佳值,酶添加量分別按 0.5%、1%、1.5%、2%、2.5%和3%處理,同上。
1.3.1.5 復合酶法正交試驗
根據單因素試驗結果,用正交試驗對影響提取的因素:酶解時間、復合酶添加量、液料比及酶解溫度進行條件優化。
1.3.2 柚皮多糖的提取分級制備
有機溶劑沉淀分級法——參照史軍花等方法[7]。
按照優化工藝條件提取多糖,在200 mL的柚皮提取濃縮液中,加入無水乙醇400 mL和去離子水200 mL,配制成乙醇體積分數為50%的混合液。將混合液放入4℃冰箱,靜置24 h,進行醇析。將醇析后的混合液,在4 000 r/min離心機下,進行沉淀分離,用燒杯分別收集沉淀物和柚皮澄清液,沉淀物即50%的乙醇沉淀的柚皮粗多糖,編號為a粗多糖。如上述方法,分別采用70%、90%的乙醇繼續醇沉柚皮澄清液,分別得到b粗多糖、c粗多糖。將a粗多糖、b粗多糖、c粗多糖冷凍干燥備用。
1.3.3 分級多糖去蛋白
采用Sevag法。
1.3.4 分級多糖脫色
采用活性炭脫色。
1.3.5 多糖含糖量的測定
采用苯酚-硫酸法[8]。

1.3.5 多糖分子質量測定
采用Waters凝膠滲透色譜(GPC)[9]。
2 結果與分析
2.1 液料比對酶法提取柚皮多糖得率的影響
不同的液料比會影響到提取溶劑對活性物質的溶解情況。復合酶提取料液比對多糖得率的影響如圖1所示。由圖1可知,多糖得率隨液料比的增加而逐漸升高,20∶1時達到最大,之后繼續增大液料比,多糖得率平緩到30∶1,隨后下降。有這樣的趨勢可能是因為液料比過低,活性物質不能充分溶解,影響到提取率。隨著液料比的過多增加,稀釋了體系使酶濃度降低,酶與底物的結合不充分,多糖得率下降。考慮到成本,選擇15∶1~25∶1為柚皮多糖提取的最適液料比。
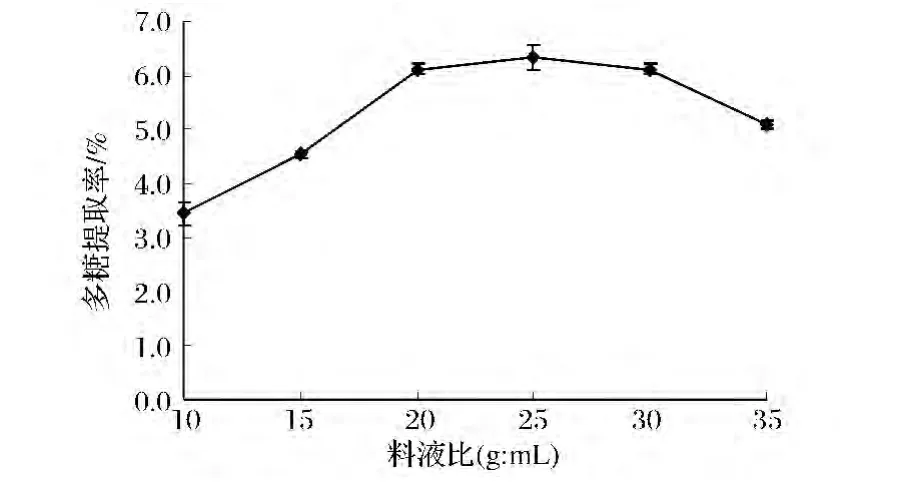
圖1 液料比對酶法提取柚皮多糖得率的影響Fig.1 The effect of ratio of liquid to solid on yield of Polysaccharide from Pomelo peel
2.2 復合酶量對酶法提取柚皮多糖得率的影響
每種酶在反應體系中的加入量對多糖的得率有很大影響,酶用量對多糖得率的影響見圖2。由圖2可見,隨著酶用量的增加,酶與底物接觸機會增加,多糖得率隨之升高。當酶量大于1.5%時,多糖得率下降,原因可能是酶的種類不同,活性中心結構不同,空間結構不同,由于當酶濃度升高到一定程度,酶分子過于飽和,一部分沒有機會與底物結合,酶解速度降低,因此,酶用量范圍果膠酶和纖維素酶為1%~2%較理想。
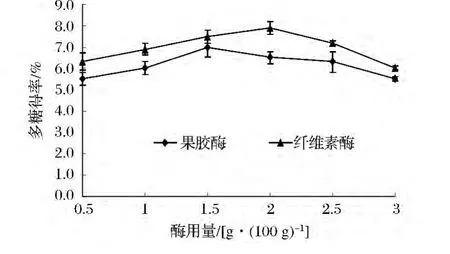
圖2 酶用量對酶法提取柚皮多糖得率的影響Fig.2 The effect of enzyme quantities on yield of Polysaccharide from Pomelo peel
2.3 酶解時間對酶法提取柚皮多糖得率的影響
浸提時間影響到溶劑與不同細胞位置活性物質的接觸,并將其溶解提取出來。浸提時間越長,溶劑能夠充分滲透到柚皮細胞組織的各個部位,與活性物質充分接觸溶解,從而提高產率。由圖3可知,當酶解時間為90 min時,多糖的提取率最大,超過120 min,多糖提取率反而下降。因此,選擇60~120 min為柚皮多糖提取的最適酶解時間。
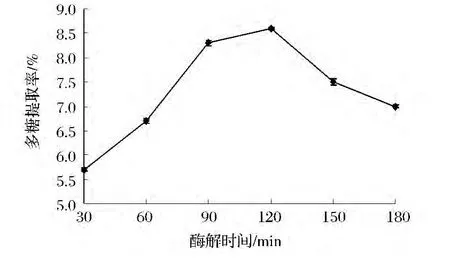
圖3 酶解時間對復合酶提取柚皮多糖得率的影響Fig.3 The effect of enzymolysis time on yield of Polysaccharide from Pomelo peel
2.4 酶解溫度對酶法提取柚皮多糖得率的影響
酶解溫度對復合酶提取柚皮多糖得率的影響如圖4所示。
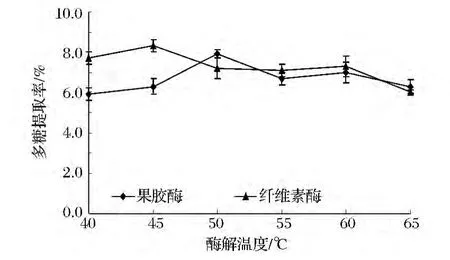
圖4 酶解溫度對復合酶提取柚皮多糖得率的影響Fig.4 The effect of enzymolysis temperature on yield of Polysaccharide from Pomelo peel
由圖4可知,隨著溫度的升高多糖提取率也升高,2種酶最適溫度不同,果膠酶50~55℃、纖維素酶45℃時得率達至最大,因為隨著溫度升高,分子運動速度加快,滲透、擴散、溶解速度加快,同時,高溫可以引起細胞膜結構的變化,弱化或破壞了細胞壁的完整性,使多糖易于從柚皮的外層細胞轉移到溶劑中。繼續升高溫度,酶蛋白開始變性,酶活力減弱直至完全喪失,反應速度亦逐漸降低,多糖得率隨之下降。綜合考慮,選擇45~50℃最適酶解溫度。
2.5 正交試驗優化復合酶提取柚皮多糖工藝
影響柚皮多糖得率的各因素主次次序由表1可知,即B>C>A>D。由極差分析各因素的最佳試驗組合為A2B3C3D2,實際組合為A1B2C2D2,浸提得率為9.49%。,通過驗證,確定最佳組合為A2B3C3D2,即酶用量1.5%、酶解時間120 min、料液比1∶25、酶解溫度50℃,浸提得率為10.39%。
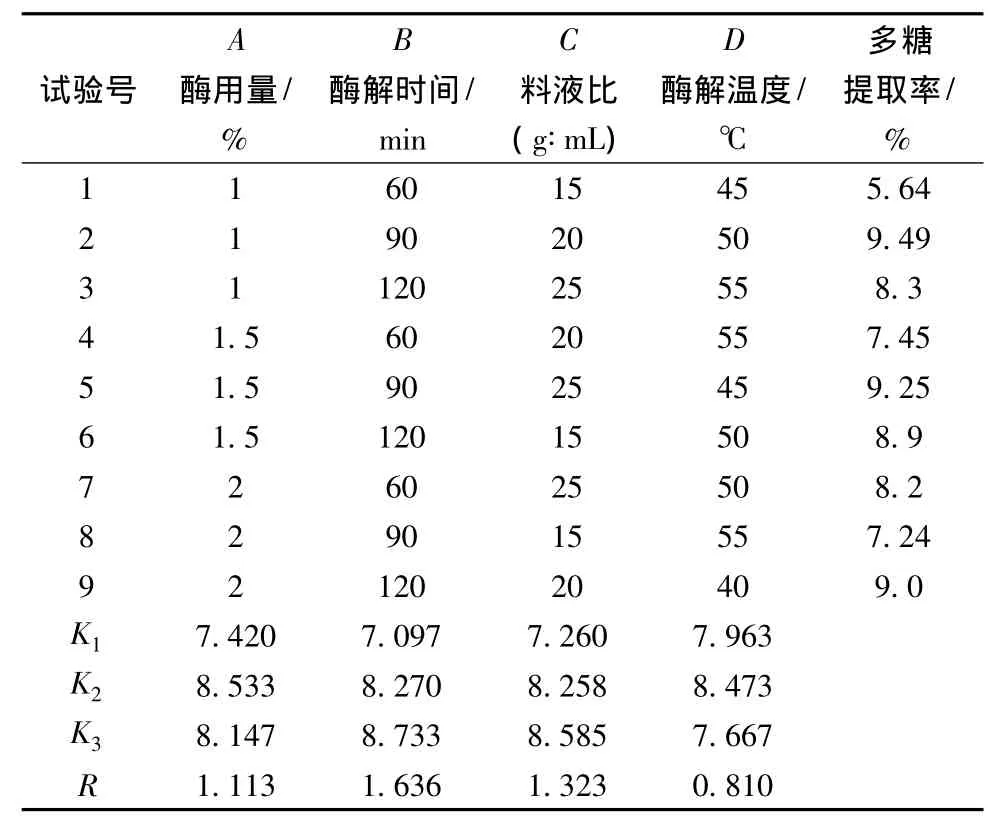
表1 正交試驗結果Table 1 The results of orthogonal test
2.6 不同分級的柚皮粗多糖含量的變化
乙醇通過降低多糖水溶液的介電常數,增加溶質分子的靜電作用力,多糖發生聚合而析出;另外乙醇可減少多糖與水的作用,使多糖脫水而相互聚集沉淀。由表2可知,一定濃度的乙醇對應沉淀一定量的多糖,采用復合酶提取,不同濃度的乙醇分級后,不同級分多糖含量有差異,各為a粗多糖為5.6 g/100 g柚粉,b粗多糖為1.9 g/100 g柚粉,c粗多糖為1.8 g/100 g柚粉。其中不同分級的柚皮粗多糖純度也不同,a粗多糖純度和b粗多糖純度沒有顯著差異,分別為42.2%、42.8%;c粗多糖純度為56.2%。孔夢曉等人[10]則采用水提醇沉淀法提取了柚皮多糖,純化后其平均收率為6.92%,劉國聰等人[11]則采用石油醚回流脫脂,熱水提取沙田柚柚皮多糖的方法,測得柚皮水溶性多糖含量是7.28%。他們測定的結果與本次試驗的結果存在差異,其原因可能是①柚皮的品種、成分含量等不同,其含糖量會有所差異。

表2 不同分級的柚皮粗多糖含量的變化Table 2 Changes of the content of crude polysaccharide of different grades from Pomelo peel
2.7 不同分級的柚皮多糖分子質量差異
2.7.1 粗多糖(a)分子質量變化
從色譜圖5和表3可以看出,粗多糖(a)淋洗時間在9~15 min,出現2個譜峰。說明有兩部分多糖。利用隨機的Breeze軟件計算得:粗多糖(a)的峰①的重均分子量Mw為24 100 Da,數均分子質量Mn為21 300 Da,峰位分子質量Mp28 540 Da,分子質量分布寬度(Mw/Mn)為1.13;粗多糖(a)的峰②的分子質量很小,是峰①的大約10倍左右,峰②重均分子質量Mw為2 180 Da,數均分子質量Mn為2 060 Da,峰位分子質量Mp2 650 Da,分子質量分布寬度(Mw/Mn)為1.06。說明50%乙醇沉淀多糖主要是大分子質量多糖。分子質量分布寬度的數值比1越大,其分子質量分布越寬,多分散性程度越大。
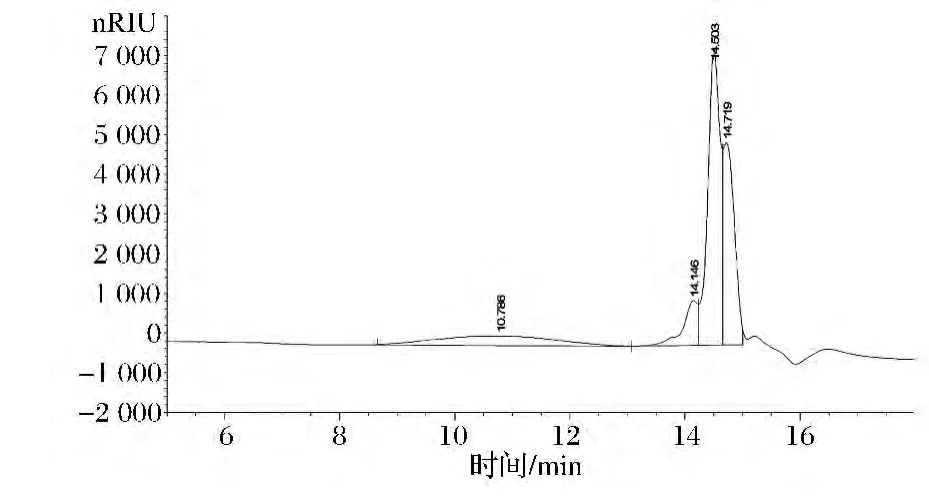
圖5 粗多糖(a)凝膠色譜圖Fig.5 GPC chromatogram of crude polysaccharide(a)
2.7.2 粗多糖(b)分子質量變化
從色譜圖6和表3得知,粗多糖(b)淋洗時間在11~15 min,出現2個譜峰,說明有兩部分多糖。利用隨機的Breeze軟件計算得:粗多糖(b)的峰②的分子質量很小,是峰①的大約1/10倍左右,分子質量分別為重均分子質量Mw為1 920 Da,數均分子質量Mn為2 030 Da,峰位分子質量Mp2 390 Da,分子質量分布寬度(Mw/Mn)為1.05.。粗多糖(b)的峰①的重均分子質量Mw為11 700 Da,數均分子質量Mn為11 200 Da,峰位分子質量Mp13 540 Da,分子質量分布寬度(Mw/Mn)為1.04。
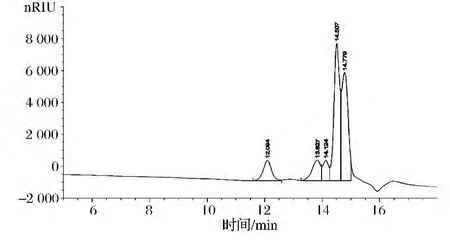
圖6 粗多糖(b)分子量色譜圖Fig.6 GPC chromatogram of crude polysaccharide(b)
2.7.3 粗多糖(c)分子量變化
從色譜圖7和表3得知,粗多糖(c)在色譜柱上出現一個譜峰,說明有一部分多糖。淋洗時間在13~15 min,利用隨機的Breeze軟件計算得:粗多糖(c)的峰①的重均分子質量Mw為2 130 Da,數均分子質量Mn為1 890 Da,峰位分子質量Mp2 540 Da,分子質量分布寬度(Mw/Mn)為1.12。

圖7 粗多糖(c)分子量色譜圖Fig.7 GPC chromatogram of crude polysaccharide(c)
不同分級的柚皮多糖分子質量表征如圖5~圖7,由圖5~圖7可以看出,不同溶劑分級的柚皮多糖經過凝膠滲透色譜柱淋洗時間不同,粗多糖(a)淋洗時間最低為9 min,最高在15 min。淋洗時間長短表明這3種粗多糖分子質量有一定的差異,當其流經凝膠色譜柱較大的分子被排除在粒子的小孔之外,只能從粒子間的間隙通過,速率較快;而較小的分子可以進入粒子中的小孔,通過的速率要慢得多。經過一定長度的色譜柱,分子根據相對分子質量被分開,相對分子質量大的在前面(即淋洗時間短),相對分子質量小的在后面(即淋洗時間長)。
不同分級的多糖分子質量呈現趨勢為粗多糖(c)的分子質量最小,粗多糖(a)分子質量最大,且在粗多糖a,b中出現了和c一個級的分子質量,可能是因為不同分子質量多糖的沉淀不僅與乙醇濃度有關,還與乙醇加入的順序有關。如先加乙醇后加料分子量較大,先加料后加乙醇則分子量較小。
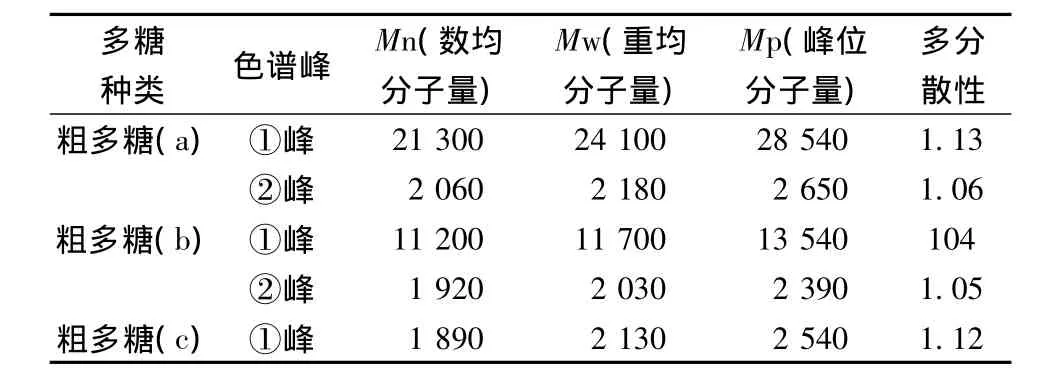
表3 粗多糖(a、b、c)凝膠色譜表征Table 3 The data of GPC chromatogram of crude polysaccharide(a,b,c)
本實驗采用先加料后加乙醇的方法,隨著乙醇的加入,多糖分子表面出現乙醇濃度差,當沉淀大分子多糖時,則有小分子多糖混在大分子多糖里。
3 結論
由于植物多糖的來源廣泛,不同種的植物多糖的結構,分子構成及分子質量各不相同,生物活性也不同。在提取多糖過程中,利用適量的酶可提高提取率,加速多糖的釋放。同時,使用酶法可分解提取液中淀粉、果膠、蛋白質等的產物,有利于多糖的純化。本文采用復合酶提取、有機溶劑分級沉淀法制備柚皮多糖,得出優化工藝為:酶用量1.0%、酶解時間90 min、料液比 1∶20、酶解溫度 50℃,多糖得率為9.32%。不同分級的柚皮粗多糖含量和純度各不同,不同分級的多糖分子質量測定表明:乙醇濃度越低,沉淀多糖的分子質量越大,不同分級的多糖分子質量呈現趨勢為粗多糖(c)的分子質量最小,粗多糖(a)分子質量最大,且在粗多糖a,b中出現了和c一個級的分子質量,可能是因為不同分子質量多糖的沉淀不僅與乙醇濃度有關,還與乙醇加入的順序有關。
[1]任貽軍,張宏琳,李建英.胡柚的化學成分及藥理作用研究[J].中草藥,2009,37(21):18-19.
[2]WU Ting,GUAN Yue-qing,YE Jian-nong,et al.Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection[J].Food Chemistry,2007,100(4):1 573 -1 579.
[3]賈冬英,姚開,譚敏,等.柚果皮中生理活性成分的研究進展[J].食品與發酵工業,2001,27(11):74-78.
[4]Builarelli F,Cartoni G P,Coccioli F,et al.Aanlysis of bitter essential oils from orange and grapefruit by high performance liquid chromatography with microbore columns[J].Journal of Chromatography A,1999,730(1 -2):9 -16.
[5]Viuda-Martos M,Ruiz-Navajas Y,et al.Antifungal activity of lemon(Citrus lemon L.),mandarin(Citrus retivulata L.),grape fruit(Citrus paradise L.)and orange(Citrus sinensis L.)essential oils[J].Food Control,2008,19(12):1 130-1 138.
[6]Alessandra Bocco,Marie-Elisabeth Cuvelier,et al.Antioxidant activity and phenolic composition of citrus peel and seed extract[J].Journal of Ariculture Food Chemistry,1998,46(6):2 123 -2 129.
[7]史軍花,梁忠巖.猴頭發酵菌絲多糖的分離、提純、純化及其初步研究[J].長春師范學院學報,2002,21(1):
[8]王忠民,王躍進,周鵬.苯酚-硫酸法測定葡萄多糖含量[J].陜西:新疆農業大學學報,2004,27(2):87-90.
[9]Yamamoto Y,Nunome T,Yamauchi R,et al.Structure of an exocellular polysaccharide of Lactobacillus helveticus TN-4,a spontaneous mutant strain of Lactobacillus helveticus TY1-2[J].Carbohydr Res,1995,275(2):319 - 332.
[10]孔夢曉,等.柚皮多糖的提取純化工藝及鑒定[J].食品工程,2011(8):157.
[11]劉國聰.沙田柚皮水溶性多糖的提取和測定[J].食品科學,2007,28(11):223.

