城市廢水暴露致食蚊魚形態雌/雄性化的生物學效應
謝勇平,方展強
(華南師范大學 生命科學學院/廣東省高等學校生態與環境科學重點實驗室,廣東 廣州 510631)
隨著我國經濟的不斷發展、現代工業與農業生產的不斷進步,我國江河湖泊等地表水的污染日趨突 出,導致污染程度嚴重,不僅影響城市生態環境,灌溉后也影響農田生態和作物生產。有關廢水監測及 治理方法也越來越成為人們關注的焦點。廢水中含有大量有毒有害的污染物,目前國家檢測廢水的排放 標準主要為色度、濁度、化學需氧量(COD)、pH等理化指標,缺少對城市工業廢水與城市生活污水中污 染物的毒性指標等進行生物監測,而理化指標只能反映污染物的瞬時濃度,無法反映污染物作用于環境的綜合毒性效應和長期效應[1]。為解決這些問題,近 10年來,國內外已廣泛運用一些小型魚類作為指示 生物進行生物監測。如使用斑馬魚(Danio rerio)研究城市污水對其鰓和肝臟組織的毒性作用、對胚胎 和仔魚的發育毒性影響等[2-6]; 也研究了生活污水對稀有鮈鯽(Gobiocypris rarus)的毒性效應等[7],但這些研究主要以采集生活污水進行室內暴露為主,原因是斑馬魚或稀有鮈鯽都不能在城市周邊受污染的溪 流或河涌中存活,而 不能直接投放到野外受污染的水域中進行生物監測的研究。食 蚊魚(Gambusia affinis)是一種原產北美洲的熱帶性卵胎生小魚[8],其入侵性非常強,因體形小、食性雜、繁殖周期短、產仔量 大,已廣泛分布于國內各地水域,尤其受污染的城市河涌中也可以生存,因此探討利用食蚊魚作為指示 生物,開發其在器官、組織、細胞及基因各級水平作為生物標志物監測城市水環境中可能存在的環境激 素類物質污染的研究具有重要的學術意義和實際應用價值。
近年已經陸續報道關于不同種類的環境內分泌干擾物室內暴露對食蚊魚的毒性影響及形態性逆轉的生物學效應等方面的研究[9-16]結 果,并開展了野外觀察實驗,發現生存在受城市污水污染的廣東東莞寒 溪河的雌性食蚊魚出現形態雄性化現象,而雄性食蚊魚則出現形態雌性化趨勢[11,17]。由于野外水環境復 雜多變,而且能引起食蚊魚形態雄性化和雌性化的原因也是多種多樣的,例如環境溫度的突變[18],溶解 氧改變[19],種群密度變化[20],以及與其他魚種之間的生存競爭等因素,都可能造成所觀察到的性別比例 變化和形態性逆轉現象。所以要正確評價與證實東莞寒溪河水中污染物造成食蚊魚的雌性化和雄性化變 異,在野外實驗的基礎上,還需要進一步開展相關的室內模擬暴露的驗證實驗。因此,本課題擬在實驗 室條件下控制統一合理的食物、種群密度、溫度、溶解氧、pH等條件,排除可能引起性別比例失調和形 態性逆轉的因素,研究城市廢水室內暴露對食蚊魚目標基因表達及性形態變異的影響,是否與野外實驗 觀察的結果相一致,其目的在于探討利用食蚊魚出現的性形態逆轉及目標基因作為生物標志物監測環境 內分泌干擾物的可行性。
1 材料與方法
1.1 實驗材料
1.1.1 儀器與試劑低溫高速離心機(Sigma,德國),Nanodrap-1000 型分光光度計(Thermo Fisher Scientific,美國),PCR 儀(Bio-rad,美國),7500 Quantitative Realtime-PCR 儀(ABI,美國),水平 電泳儀(北京六一)。RNAisoPlus(TAKARA,Dalian,China),DNase(RQ1 RNase-Free DNase,Promega,Madison,WI,USA),TAKARA First Strand cDNA Synthesis Kit(TAKARA,Dalian,China),SYBRPremix Ex TaqKit(TAKARA,Dalian,China)。其他生化試劑均為符合實驗規格要求國產試劑。
1.1.2 實驗魚實驗所用的食蚊魚(G.affinis)均購買自廣州市芳村區花地灣花鳥魚蟲市場。挑選大小 一致、形態正常的雌、雄性食蚊魚,在實驗室水族缸中清水馴養1個月以上,每天死亡率低于0.1%時適 合進行暴露實驗。
1.1.3 實驗用廢水暴露實驗用廢水均采集自東莞市樟村污水處理廠出水口。出水污水用25 L塑料桶盛 裝,采集后置于4℃條件下運回。在實驗室大冰箱中冷凍處理,以防水中微生物降解化合物,換水之前 先將結冰的水融化。整個試驗過程中用污水處理廠出水原液800 L左右。
1.2 實驗方法
1.2.1 室內模擬實驗分組與暴露方法暴露實驗設置空白組和實驗組,空白對照組(C0)采用實驗室去 氯自來水,實驗組(C1、C2、C3、和C4)設置含10%、40%、60%和80%樟村污水處理廠出水原液的4個 暴露組。不同濃度廢水的配制方法以原廢水為100%計算,用實驗室經曝氣的自來水按體積比例相應稀釋 成所需要的濃度。同時設置強雄激素組(CMT,甲基睪酮)作為陽性對照。每組設置3個魚缸重復實驗。魚缸大小為30cm×40cm×45cm,暴露時控制體積為30 L。實驗開始時每個缸加入雌魚20條、雄魚20 條。同時設置平行組。
1.2.2 實驗條件控制嚴格控制實驗條件,實 驗期間利用室內空調控制水溫為25°C左右,用充氣機供氧,通過調節充氣量以保證不同濃度廢水中的溶解氧一致,溶解氧大于4mg/L,pH在6~8之間。每日早晨、中午、晚上各喂食1次,食料為商業購買的紅蟲。實驗期間用Thermo多道水質監測儀(Thermo Orion,520M-01,Guangzhou,China)監測水質,隔3d換一次水,每次換總體積的1/2,若水質出現異常波動,則 立即換水。
1.2.3 形態學數據采集暴露期間進行雌魚臀鰭形態學數據采集,先將食蚊魚冰浴麻醉,拍照之后將食 蚊魚放回魚缸繼續暴露。
(1)骨骼處理。將實驗魚處死后拍照,再用1%的KOH處理3d,隔天換液,然后仔細地剝去魚皮及 肉質部分使其只剩下骨骼,用1%的茜素紅S染色20min左右,取出清理好骨骼標本,并在萊卡體式顯微 鏡下拍照[17]。
(2)骨骼形態參數計算。骨骼照片采用圖像處理軟件“Adobe Photoshop CS4”中的“距離測量工具” 進行相關指標的測定。所測量的指標包括第14/15/16椎肋骨總長(14L/15L/16L)、第14/15/16椎肋骨的投 影長度(14P/15P/16P)、第14/15/16椎肋骨尾部尖端到脊柱的高度(14D/15D/16D)。根據測量的指標計 算P:D的比值(14P:14D / 15P:15D / 16P:16D)。一些研究已經證明,L/P/D值的大小與魚相應的體長成顯 著的正相關關系,所 以在數據處理判定不同采樣點樣本指標的顯著水平時,采 用協方差分析(CO-ANOVA)對數據進行統計分析.[21]。測量和處理的方法如圖1所示。
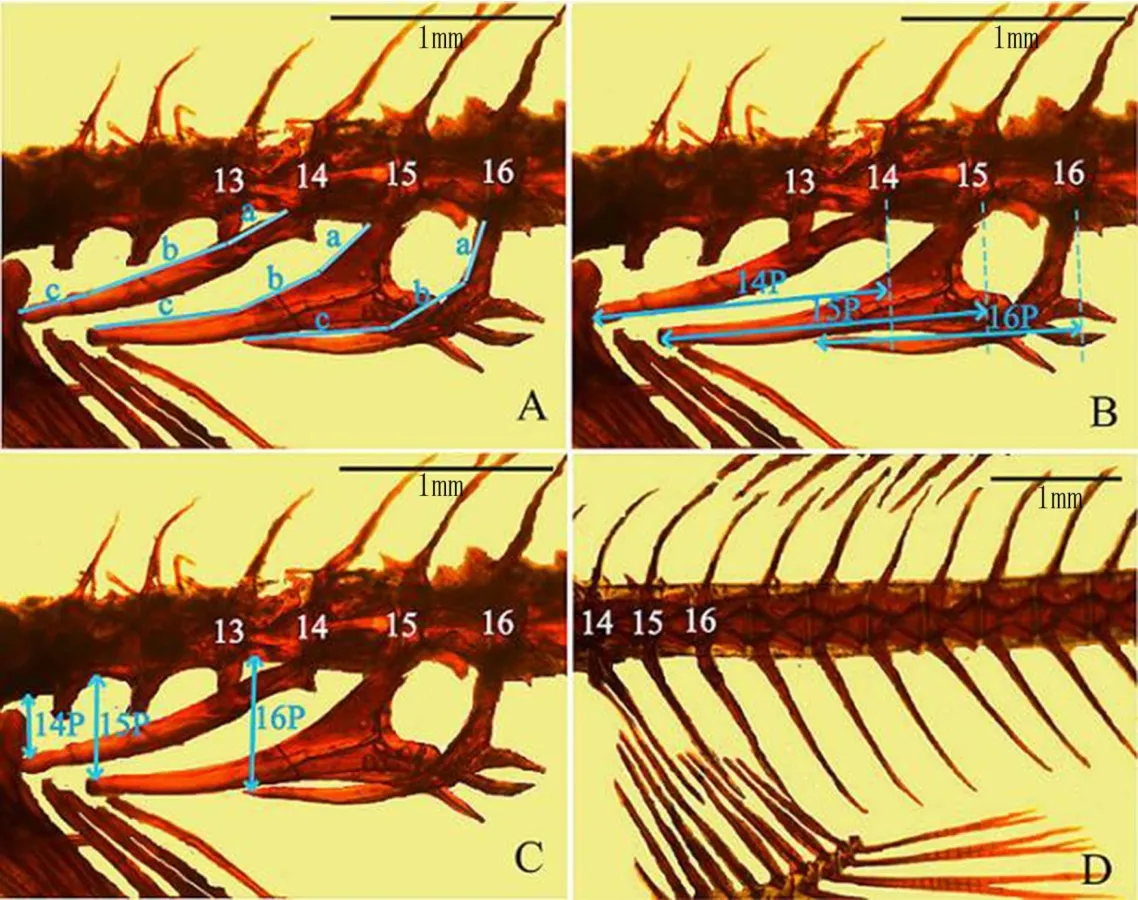
圖1 骨骼形態各個參數的測量和計算方法示意圖[17]
(3)雌魚鰭條數據采集的方法 將魚冰浴麻醉,在萊卡體式顯微鏡下拍照,用圖像處理軟件AdobePhotoshop CS4中的距離測量工具進行相關指標的測定(圖2)。雌魚的臀鰭總共有10根鰭條,從左到右 依次為第1~10鰭條,在測量鰭條長度時,為了精細統計,將鰭條長度分為(a+b+c)3段。每一根鰭條的分節數也在圖片作處理,以方便肉眼計數統計。
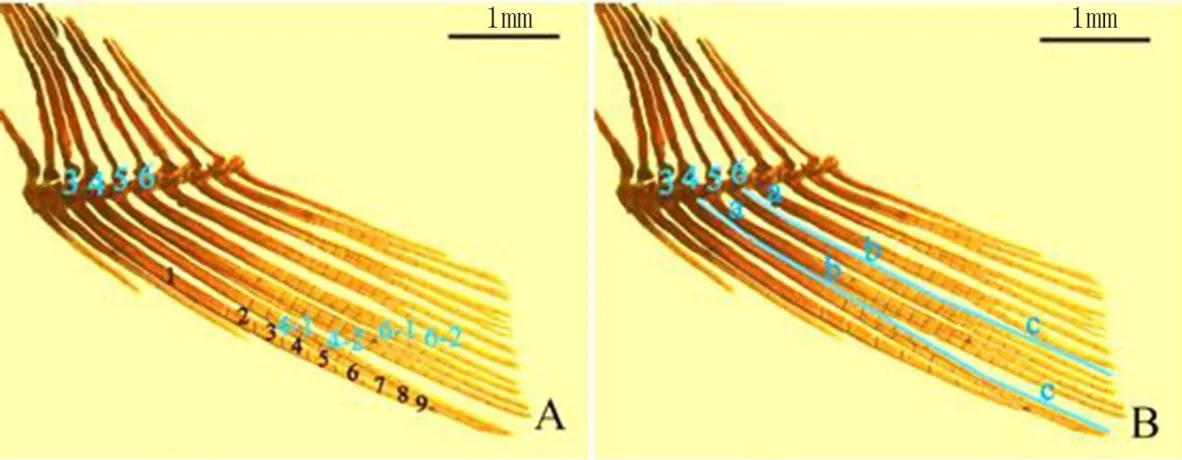
圖2 雌魚雄性化特征之臀鰭延長程度的測量與計算方法示意圖[17]
(4)數據處理 所有數據用SPSS16.0 處理,檢驗顯著差異度設置為P<0.05。由于在預實驗中發現 參數(雌魚臀鰭第 3 鰭條分節數,14~16P,14~16D,14~16L)與魚體長有高度相關性。因此這些參數將結合與之高度相關的體長,利用協方差分析方法(CO-ANOVA)檢驗不同位點之間的差異性。所有數據表示為:平均數±標準差(mean ± standard deviation)。
1.2.4 分子生物學實驗數據采集解剖食蚊魚小心剪下完整的雌魚鰭條、取出肝臟等目標器官裝入有標 簽的離心管,迅速放入液氮中速凍后統一轉入-80°C 超低溫冰箱中暫存直至RNA 提取試驗。提取肝臟 RNA時每個暴露濃度每次至少取出 9 條食蚊魚,每3條食蚊魚肝臟合裝一個離心管,提取臀鰭 RNA時每個暴露濃度組至少取出 12 條食蚊魚,每4 條食蚊魚臀鰭合裝一個離心管。RNA 提取、RNA 反轉錄 cDNA、QRT-PCR 分析方法如下。
(1)引物設計。登錄 NCBI網站,找到西部食蚊魚(Gambusia affinis)的VTGαcDNA、ERαcDNA、ARαcDNA的序列,用Primer primer5 設計與之匹配的Real-time PCR 擴增引物,校對后最終選取的引物 如表1 所示。
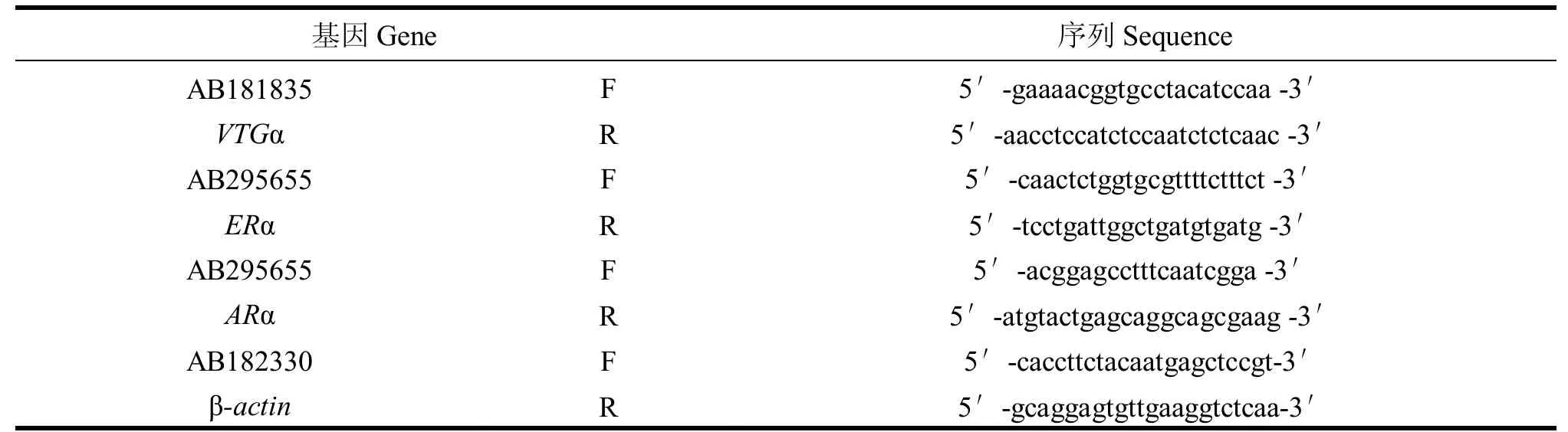
表1 目標基因擴增引物名稱及其序列
(2)R NA制備。將肝組織勻漿,臀鰭條則研磨成粉末,分別加入約1 mL的Isoplus RNA(RNAiso Plus)提取液(Takara)進行總RNA提取。R NA提取后進行基因組DNA的去除,并檢測RNA濃度及其完整性,保證A260/A280的比值在1.8~2.0(TakaRa)。RNA反轉錄成cDNA使用TakaRa Code:DRR037 PrimeScript TM RT reagents Kit(Perfect Real Time)產品。RT反應液配置如下:5×PrimeScript Buffer(2 μL),PrimeScript PT Enzyme Mix I(0.5 μL),Random 6 mers(100μmol/L,0.5 μL),Oligo dT Primer(50μmol/L,0.5 μL),Total RNA(1μL),Rnase Free dH2O(5.5 μL),總共10μL。反轉錄反應條件如下:37℃15min-cDNA 合成),85℃ 5s(酶失活)。
(3)實時熒光定量。使用TakaRa Code:DRR081A SYBR? Premix ExTaq? Ⅱ(2×)10.0μL,正反向 引物(10μmol/L)各0.8 μL,ROX References DyeⅠ(50 ×)or ROX References DyeⅡ(50 ×)0.4 μL,cDNA模板 2.0μL,H2O(滅菌)6.0μL,總共20.0μL。按照兩步法PCR擴增標準程序進行RT-PCR反應。RT-PCR擴增結 果數據的處理采用相對定量法,內參基因選用β actin。通過標準曲線對對照樣品待測樣品的目的基因及管家基因進行定量,然后根據計算公式求得相對值即為相對表達量。校正值=目的基因定量結果/管家基因 定量結果?相對值=待測樣品的校正值/對照樣品的校正值。
(4)數據統計與處理。使 用SPSS16.0統計軟件對所得數據進行統計學分析。采 用單因素方差分析(one way-ANOVA)法對數據進行差異性分析。用Excel 2003做柱形圖。設 置P<0.05時,表示差異顯著;當P<0.01 時,表示差異極其顯著。
2 結果與分析
2.1 水質控制
水質監測數據為多次測試的結果,溫度控制在23.9~25.1℃,pH值嚴格控制在6.0~7.1,電導值在不 同濃度組有差異,在209.1~352.2μs/cm,溶解氧介于6.99~8.05mg/L(表2)。
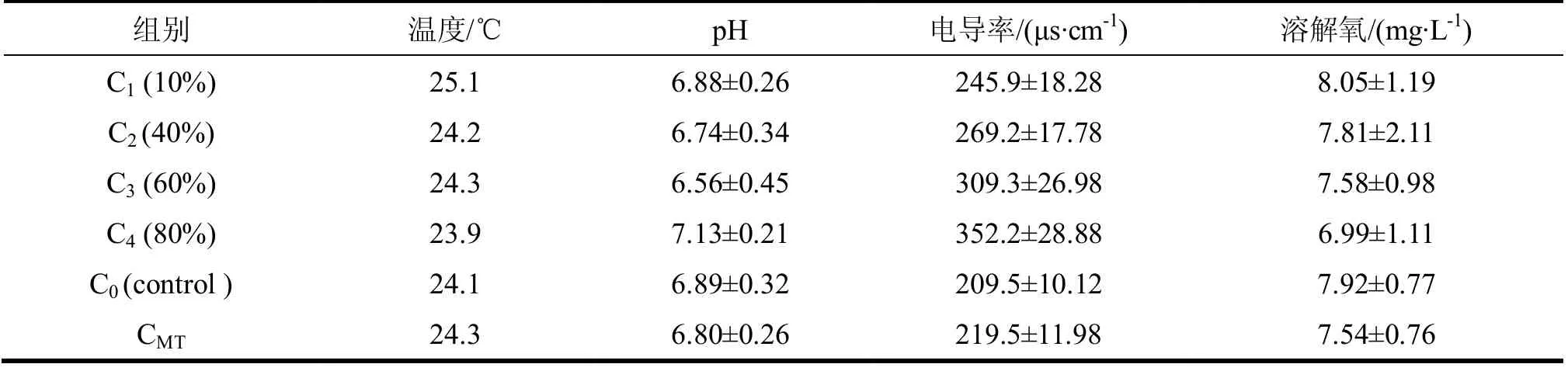
表2 水質理化指標
2.2 污水暴露致食蚊魚骨骼形態變異
正常的雌性食蚊魚骨骼第14~16節椎肋骨向尾部方向彎曲,椎肋骨細長,與臀鰭之間沒有通過軟骨 進行連接(圖3-A);正常的雄魚第14~15根椎肋骨向頭部方向彎曲,肋骨粗大,第14根椎肋骨與臀鰭的骨骼通過韌帶緊密連接(圖3-B)。雌性食蚊魚經過強雄激素甲基睪酮(MT)暴露后,第14~16根椎肋 骨出現特化,彎曲方向改變,由原來向尾部彎曲的改變成為向頭部彎曲,椎肋骨也變厚變粗變硬,甚至增生出與臀鰭骨骼相連接的軟骨。臀鰭的第3~5鰭條也相應延長,直至與雄魚的生殖足類似(圖3-C)。經過東莞樟村污水處理廠出水暴露35d后,高濃度暴露組雌魚在一定程度上出現一些微弱變化,第14~16 椎肋骨的中間部位出現骨骼膨大增生,其椎肋骨向尾部彎曲的程度也較之正常雌魚的有所變小(圖3-D)。至于臀鰭,也出現了第3~5鰭條在一定程度上延長的現象。
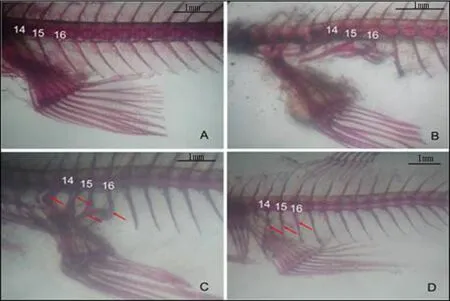
圖3 實驗魚的骨骼圖
2.3 污水暴露致食蚊魚目標基因mRNA表達
2.3.1 雌性食蚊魚目標基因mRNA表達變化暴露實驗雌性食蚊魚臀鰭的ARαmRNA轉錄水平如圖4所 示。以對照組的ARαmRNA轉錄水平設定為參照值,實驗組中60%和80%濃度組臀鰭的ARαmRNA轉錄水 平呈顯著升高,分別達到2.99倍(P<0.001)和1.98倍(P<0.01)。10%和40%濃度組的轉錄水平則無顯著性差 別,其中10%濃度組略為降低(0.78倍,P>0.05),而40%濃度組則稍微升高(1.21倍,P>0.05)。
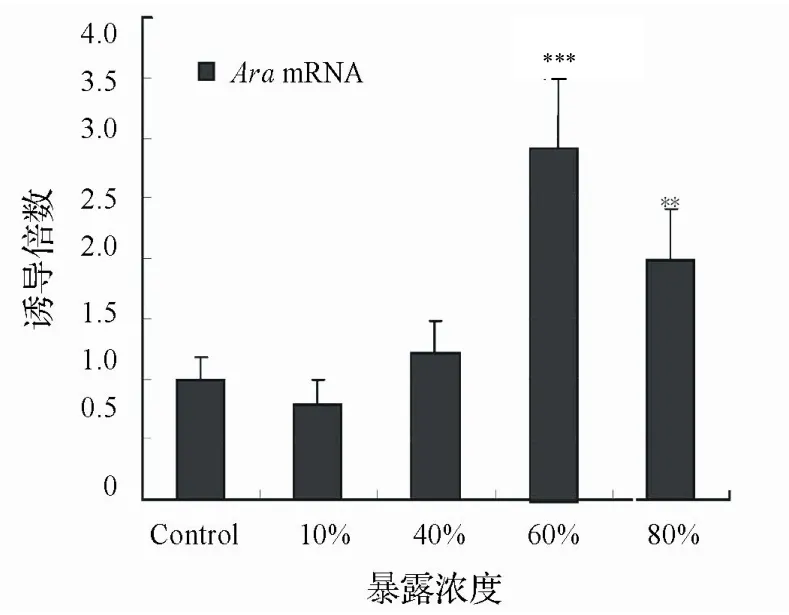
圖4 廢水暴露致雌性食蚊魚臀鰭ARαmRNA 轉錄水平
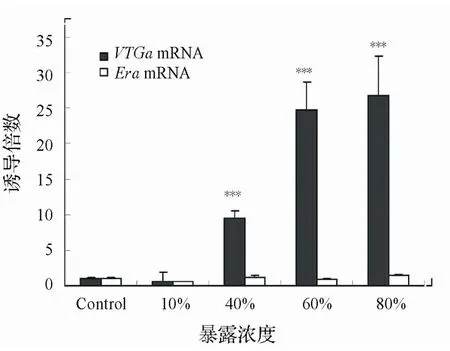
圖5 廢水暴露致雄性食蚊魚肝臟VTGαmRNA和ERα mRNA轉錄水平變化
2.3.2 雄性食蚊魚目標基因mRNA表達變化用不同濃度的污水處理廠出水對食蚊魚暴露35d之后檢測 了各個濃度組食蚊魚肝臟中VTGαmRNA和ERαmRNA的轉錄水平,其結果如圖5所示。其中80%濃度組的VTGαmRNA轉錄水平是清水對照組轉錄水平的25倍以上(P<0.001),而 60%濃度組和40%濃度組也分別 達到了24.8倍(P<0.001)和9.5倍(P<0.001)。從 整個變化趨勢來看,低 濃度10%到高濃度80%,其VTGαmRNA的轉錄水平隨之相應上升,而且呈現良好的線性關系。而ERαmRNA的變化與暴露濃度的變化則無明顯的相關性,與對照組的轉錄水平相比未呈現顯著性差異(P>0.05)。
3 討 論
暴露實驗水質的監測結果顯示,對照組和實驗組的溫度和pH 都無明顯差異,且控制在一個較小的范圍內,說明喂食過程中的食物殘渣得到了及時清理,不引起水質變壞,DO 值保持在6.0mg/L以上,表明水中的溶解氧供給足夠食蚊魚正常生活。對照組電導值為 209μs/cm,該值較干凈的河水(東莞流溪 河,86.7 μs/cm)[11]略 偏高,其原因是實驗用的為自來水,水中有用于消毒的次氯酸鈣成分而造成水中 含有大量離子,但這些離子不會影響食蚊魚的正常生活。污水按不同比例稀釋后電導值也呈現一定的變 化趨勢,而且變化與稀釋比例一致,相關系數為R= 0.982,說明污水處理廠出水含有大量的金屬礦質離 子和各類酸根離子,同時也表明本實驗對稀釋水樣操作時工作的嚴謹性。
雌性食蚊魚和雄性食蚊魚的第 14、15、16 根椎肋骨呈現形態與功能相適應的特征,因其在不同性 別中的功能不同而呈現形態上的“二態性”,表現為雄魚的椎肋骨粗大,向頭部彎曲,與臀鰭聯系緊密,而雌魚的這3 根椎肋骨向尾部彎曲,椎肋骨細長且與臀鰭無緊密聯系。本暴露實驗中,雄激素 MT誘 導后臀鰭出現明顯延長直至發展為與雄魚類似的生殖足,第 14、15、16 根椎肋骨完全改變,基本趨 近于雄性食蚊魚的椎肋形態,再次驗證已經報道的強雄激素可以導致食蚊魚性逆轉的現象[9,22]。同時也與實驗室內制漿造紙廢水暴露食蚊魚可以使雌性食蚊魚性腺出現“卵睪”、臀鰭延長成為生殖足;造紙 廢水能誘導出雙性魚的結果相一致[23]。本研究中,廢水暴露 35d 后高濃度組的部分雌性食蚊魚出現臀 鰭輕度延長,骨骼經過處理之后可見第 14、15、16 根椎肋骨開始出現膨大,向后彎曲的角度減小(也即 P:D的比值變小),顯示食蚊魚發生形態雄性化轉變。推測在廢水暴露過程中,雄激素類物質作用于雌性食蚊魚,紊亂其體內的雄激素水平,刺激雌性食蚊魚發生第 14~16 根椎肋骨膨大彎曲,臀鰭延 長等變化。本研究的廢水室內暴露實驗也驗證了野外調查中發現的內分泌干擾效應在食蚊魚形態特征上的體現[11]。然而,由于暴露實驗添加到水中雄激素物質含量較低,此外采用的實驗魚已經完成性分化階段,實驗魚在一定程度上已經具備抵御外界內分泌干擾物的干擾的能力,因此表現出來的雄激素 效應相對微弱。
雌性食蚊魚臀鰭的ARαmRNA轉錄水平升高與水中雄激素物質刺激有關,并 且在一定程度上呈現高 度相關性[24]。雄魚血液或肝臟中 VTG 則是指示食蚊魚受到雌激類物質污染時的良好生物標志物[25],而 其mRNA轉錄水平更是有精確、快速反映暴露水平的特點[26]。本研究在污水處理對雌、雄食蚊魚暴露的實驗中發現,雌魚臀鰭的ARαmRNA轉錄水平具有隨濃度增大而上升的趨勢,對轉錄水平和濃度數據進 行相關性分析結果發現其相關系數R=0.758,P<0.01。這表明雌魚臀鰭的ARαmRNA轉錄水平升高與廢 水濃度的增加具有顯著性相關,揭示其轉錄水平的升高可能與高濃度廢水中所含有的雄激素類物質濃度的高低有密切關聯。而相比之下,雄魚肝臟中的VTGαmRNA 轉錄水平的升高與濃度的相關性則更高(R=0.964,P<0.001),進一步表明雄魚肝臟VTGmRNA這一生物標志物在監測廢水雌激素效應中所呈 現的優越性[10]。
本實驗結果已經證明,城市廢水暴露致雌性食蚊魚發生形態雄性化轉變,并致雌魚臀鰭ARαmRNA 轉錄水平顯著提升,表現明顯的雄激素效應;而城市廢水暴露致雄魚肝臟中的VTGαmRNA 轉錄水平顯著提升,則表現明顯的雌激素效應。這一實驗結果與東莞寒溪河野外調查發現的雌、雄 激素效應在食蚊魚骨骼形態特征和目標基因表達上的表現是相一致的,這也表明利用食蚊魚發生的形態雄性化或形態雌性化轉變以及VTGα和ARα目標基因作為生物標志物監測城市受污染河涌中的環境內分泌干擾物是可行的。
[1]郭莉.綜合廢水和環境水樣遺傳毒性評價新方法研究[D].大連:大連理工大學,2013.
[2]吳玲玲,陳玲,張亞雷.菲對斑馬魚鰓和肝組織結構的影響[J].生態學雜志,2006,26(5):688-692.
[3]甘海燕.城市生活污水對斑馬魚肝臟組織結構和NF-κB基因表達的影響[J].江西農業大學學報,2013,35(1):179-183.
[4]張青碧,甘仲霖,韓知峽.城市生活污水對水生動物斑馬魚的發育毒性研究[J].現代預防醫學,2008,35(23):4568-4569.
[5]劉在平,張松林.城市污水對斑馬魚胚胎的影響[J].生態環境學報,2010,19(12):2911-2915.
[6]梁秋燕,謝勇平,方展強.Zn 2+ 和Cd 2+對斑馬魚早期胚胎發育階段的單一與聯合毒性研究[J].中國水產科學,2012,19(2):283-292.
[7]李莉,馬陶武,吳振斌.生活污水對稀有鮈鯽的毒性效應研究[J].水生生物學報,2004,28(1):40-44.
[8]潘炯華,蘇炳之,鄭文彪.蚊魚(Gambusia affinis)的生物學特性及其滅蚊利用的展望[J].華南師范學院學報:自然科學 版,1980,(1):117-138.
[9]范俊杰,徐少群,方展強,等.17α-甲基睪酮對食蚊魚形態雄性化及目標基因表達的影響[J].水產學報,2013,37(1):9-15.
[10]Wen R S,Xie Y P,Wan C X,et al.Estrogenic and androgenic effects in mosquitofish(Gambusia affinis)from municipal effluent contaminated streams in Guangzhou,China[J].Aquatic Toxicology,2013,132-133:165-173.
[11]謝勇平,方展強.利用食蚊魚目標基因轉錄水平評價東莞寒溪河雌/雄激素物質污染現狀[J].水生生物學報,2013,37(4):691-697.
[12]蘇方,謝勇平,方展強.苯并[a]芘和鎘暴露對食蚊魚求偶行為的影響[J].生物學雜志,2013,30(4):5-10.
[13]駱曉燕,謝勇平,方展強.鎘(Cd 2+ )暴露對食蚊魚生長發育的影響[J].天津農業科學,2013,19(10):1-6.
[14]陳文娟,謝勇平,賴靜萍,等.城市廢水暴露對食蚊魚肝臟EROD酶活性的影響[J].天津農業科學,2014,20(2):54-59.
[15]鐘林燕,謝勇平,張曉嬋,等.3,4-苯并芘暴露對食蚊魚生長發育的毒性影響[J].江西農業學報,2014,26(4):94-97.
[16]范俊杰,黎紫蘭,徐少群,等.孕激素暴露致食蚊魚形態雄性化的生物學效應[J].中國實驗動物學報,2014,22(4):31-36.
[17]XieY P,Fang Z Q,Hou L P,et al.Altered development and reproduction in western mosquitofish(Gambusia affinis)found in the Hanxi River,soutern China [J].EnvironmentalToxicology andChemistry,2010,29(11):2607-2615.
[18]Ospina-Alvarez N,Piferrer F.Temperature-dependent sex determination in fish revisited:Prevalence,a single sex ratio response pattern,and possible effects of climate change [J].Plos One,2008,3(7):2837.
[19]陳兆南,譚玲,董亞明,等.溶解氧和氣泡對食蚊魚生存的影響[J].上海師范大學學報:自然科學版,2007,36(2):61-65.
[20]Stefan P W Walker,Loic Thibaut,Mark I McCormick.Density-dependent sex ratio adjustment and the allee effect:Amodel and a test using a sex-changing fish [J].American Naturalist,2010,176(3):312-321.
[21]Rawson C,Lim R P,Warne M S J,et al.The effect of 17β-estradiol on the development of modified hemal spines in early life-stageGambusia holbrooki[J].Arch Environ Contam Toxicol,2006,51:253-262.
[22]Ogino Y,Katoh H,Yamada G.Androgen dependent development of a modified anal fin,gonopodium,as a model to understand the mechanism of secondary sexual character expression in vertebrates [J].FEBS Letters,2004,575:119-126.
[23]Drysdale D T,Bortone S A.Laboratory induction of intersexuality in the mosquitofish,Gambusia affinis,using paper mill effluent[J].Bull Environ Contam Toxicol,1989,43:611-617.
[24]Kiyoaki Sone,Megumi Hinago,Misaki Itamoto,et al.Effects of an androgenic growth promoter 17β-trenbolone on masculinization of Mosquitofish(Gambusia affinis affinis)[J].General and Comparative Endocrinology,2005,143:151-160.
[25]溫茹淑,方展強,江世貴,等.劍尾魚卵黃蛋白原的ELISA檢測[J].環境科學研究,2007,20(4):144-149.
[26]黃曄,任華,孫竹筠,等.壬基酚和雙酚A對雄性斑馬魚(Danio rerio)卵黃蛋白原mRNA的誘導效應[J].生態毒理學報,2008,3(3):274-279.

