硫辛酸對高糖誘導小鼠RIN-m5F細胞保護作用的機制
高翠翠,唐雪,2,藺憶,陳立立,施用暉,2,樂國偉*,2
(1.江南大學食品學院,江蘇無錫214122;2.食品科學與技術國家重點實驗室,江南大學,江蘇無錫214122)
硫辛酸對高糖誘導小鼠RIN-m5F細胞保護作用的機制
高翠翠1,唐雪1,2,藺憶1,陳立立1,施用暉1,2,樂國偉*1,2
(1.江南大學食品學院,江蘇無錫214122;2.食品科學與技術國家重點實驗室,江南大學,江蘇無錫214122)
探究α-硫辛酸(α-LA)對高糖誘導RIN-m5F細胞的保護機制。RIN-m5F細胞分為對照組(11 mmol/L葡萄糖)、葡萄糖損傷組(22 mmol/L或44 mmol/L葡萄糖)、α-LA干預組(上述3個葡萄糖濃度+200 μmol/L α-LA),分別檢測細胞內活性氧自由基(ROS)、丙二醛(MDA)水平、總抗氧化能力(T-AOC)及超氧化物歧化酶(SOD)活性;BAX、BCL-2、GSK-3β mRNA表達水平;細胞線粒體膜電位及蛋白印跡法檢測GSK-3β和p-Ser9 GSK-3β蛋白質水平。結果表明,與糖損傷組相比,200 μmmol/L α-LA顯著降低胞內ROS水平,分別降低30%和83%;增強細胞SOD活性及T-AOC能力,降低MDA積累;上調抗凋亡因子BCL-2 mRNA表達水平,下調促凋亡蛋白質BAX mRNA表達水平,提高細胞線粒體膜電位。此外,α-LA能夠下調GSK-3β mRNA表達水平,提高p-Ser9 GSK-3β蛋白質水平,表明α-LA對高糖誘導RIN-m5F細胞的抗氧化和抗凋亡保護作用與調節GSK-3β有關。
硫辛酸;葡萄糖;氧化應激;細胞凋亡
高血糖導致的胰島β細胞損傷是糖尿病發生的重要環節,高濃度葡萄糖環境導致細胞內氧化系統與抗氧化系統失衡,從而造成細胞各項功能受損,而胰島β細胞抗氧化酶(如CAT、GPx、SOD)活性相對較低,更易受到氧化損傷而引發糖尿病[1]。
α-硫辛酸(α-LA)在糖尿病及其并發癥的預防及治療中已經有所應用。α-LA與其還原形式二氫硫辛酸(DALA)均具有較強抗氧化作用,可通過直接清除氧自由基、螯合金屬離子如銅和鐵、再生內源性抗氧化劑和修復氧化損傷等途徑減輕機體氧化應激[2-4]。多項研究已經證實α-LA對細胞的保護作用,例如它可以抑制高糖誘導的人臍靜脈內皮細胞凋亡[5],抑制TNF-a誘導的肝細胞及骨髓基質細胞凋亡[6-7];也有研究表明α-LA能夠減少自由基對胰島β細胞的損害,對抗凋亡。但是α-LA保護胰島β細胞的具體機制尚未明確[8-9]。
GSK-3β在多種信號傳導過程中起關鍵作用,它不僅通過激活糖原合成酶調節細胞糖代謝及能量代謝過程,而且在細胞生長、分化、突變和凋亡等生命活動中也具有重要的調控作用[10]。研究顯示,GSK-3β是胰島細胞增殖分化的限速酶。正常小鼠敲除GSK-3β可提高胰島β細胞功能,飼喂高脂日糧后仍具有正常的葡萄糖耐受能力及胰島功能[11]。姜黃素可以通過增加GSK-3β Ser9磷酸化水平抑制GSK-3β活性,對抗Aβ導致的線粒體代謝缺陷和氧化應激[12]。此外,LA可通過增加p-GSK-3β水平保護活性氮介導的心肌細胞損傷[13],抑制GSK-3β表達,對抗BV-2細胞炎癥反應[14]。
目前,α-LA對胰腺β細胞抗氧化保護作用是否與GSK-3β有關,尚未有報道。因此,本研究以胰島素瘤細胞株(RIN-m5F)為對象,探究α-LA可能的抗氧化機制,以期為I型糖尿病的防治提供有價值的理論依據。
1 材料與方法
1.1試劑和儀器
小鼠胰島素瘤細胞系RIN-m5F,江南大學藥學院金堅教授饋贈。RPMI 1640培養基,胎牛血清,GIBCO公司產品;α-LA(純度99%),江蘇富士萊醫藥化工有限公司產品;DCFH-DA熒光探針試劑盒,JC-1線粒體膜電位測定試劑盒,碧云天生物公司產品;超氧化物歧化酶(SOD)、丙二醛(MDA)、總抗氧化能力(T-AOC)試劑盒,南京建成生物工程研究所研制;Trizol,熒光染料SBY,美國Biomiga公司產品;M-MLV逆轉錄酶,Promega公司產品;基因引物,上海捷瑞生物工程有限公司產品;兔抗鼠GSK-3β抗體,p-Tyr216GSK-3β抗體,p-Ser9GSK-3β抗體,美國Cell Sinaling公司產品;其他試劑均為國產分析純試劑。Spectra Max M5/M5e酶標儀,美國Molecular Devices公司制造;7900HT Fast Real-Time PCR儀,美國ABI公司制造;FACS Calibur流式細胞儀,美國Becton Dickinson公司制造;Fluor Chem FC3型化學發光成像分析系統,美國Protein Simple公司制造。
1.2細胞培養
RIN-m5F培養于含體積分數10%FBS、100 U/mL青霉素和100 μg/mL鏈霉素的RPMI1640培養基中,在37℃和體積分數5%CO2培養箱中培養,待細胞長至80%~90%融合時,以質量分數0.25%胰蛋白酶消化后按1∶2體積比傳代培養。
1.3實驗分組及處理
細胞貼壁長至50%體積時,分別轉入不同條件培養基繼續培養72 h。實驗分組:對照組(11mmol/L葡萄糖);糖損傷組(22 mmol/L葡萄糖,44 mmol/L葡萄糖);α-LA干預組(11 mmol/L葡萄糖+200 μmol/L α-LA,22 mmol/L葡萄糖+200 μmol/L α-LA,44 mmol/L葡萄糖+200 μmol/L α-LA)。
1.4活性氧自由基(ROS)測定
細胞接種于96孔板,分組及處理同上。去除培養液,加入稀釋好的DCFH-DA探針,使其終濃度為10 μmol/L,37℃培養箱內孵育30 min,用無血清培養液洗滌細胞3次,以充分去除未進入細胞的DCFH-DA。M5熒光酶標儀檢測熒光強度,激發波長為488 nm,發射波長為525 nm。
1.5氧化應激指標的測定
取對數生長期的細胞接種于6孔板,分組及處理同上。預冷磷酸鹽緩沖溶液(0.01 mol/L PBS)清洗細胞2次,RPMI細胞裂解液于冰上裂解細胞5 min,10 000 r/min離心10 min,取上清液,-20℃保存待測。
嚴格按照試劑盒說明書測定細胞裂解液中相關指標:MDA、SOD、T-AOC。
1.6細胞線粒體膜電位測定
取對數生長期的細胞接種于6孔板,分組及處理同上。嚴格按照JC-1線粒體膜電位試劑盒說明書測定,實驗獨立重復3次。
1.7Real-Time PCR檢測細胞內相關基因mRNA表達水平
Trizol法提取細胞總RNA,取2.0 μg總RNA,經反轉錄為cDNA(20 μL反應體系),-20℃保存。PCR擴增條件:預變性95℃,5 min;變性95℃20 s,退火62℃30 s,延伸72℃20 s,所有基因均為40個循環;終末延伸72℃2 min。基因引物上下游序列及退火溫度見表1。

表1 引物序列及退火溫度Table 1 Sequences of the primers and annealing temperature
1.8Western-blot檢測GSK-3β蛋白質水平
各組細胞抽提蛋白質,BCA法測定蛋白質濃度。各組樣品按40 μg/孔點樣,質量分數12.5% SDS-聚丙烯酰胺(PAGE)凝膠電泳,半干法轉蛋白質至PVDF膜。體積分數5%BSA TBST液在室溫條件下封閉60 min。GSK-3β抗體(體積比1∶1 000)、p-Ser9GSK-3β抗體(體積比1∶1 000),4℃孵育過夜。洗滌后二抗室溫孵育60 min。顯色,成像,電泳圖像分析系統分析。
1.9數據處理與統計方法
采用SPASS17.0統計軟件對數據進行相關性分析,并作Duncan多重比較。實驗數據用x±SD表示,顯著水平為P<0.05。
2 結果與分析
2.1α-LA對細胞內ROS的影響
隨著葡萄糖濃度的增加,細胞ROS水平逐漸升高,且差異顯著(P<0.05);添加200 umol/L α-LA可顯著降低22 mmol/L和44 mmol/L葡萄糖組ROS水平(P<0.05),且22 mmol/L葡萄糖組可恢復至正常水平。如圖1所示。
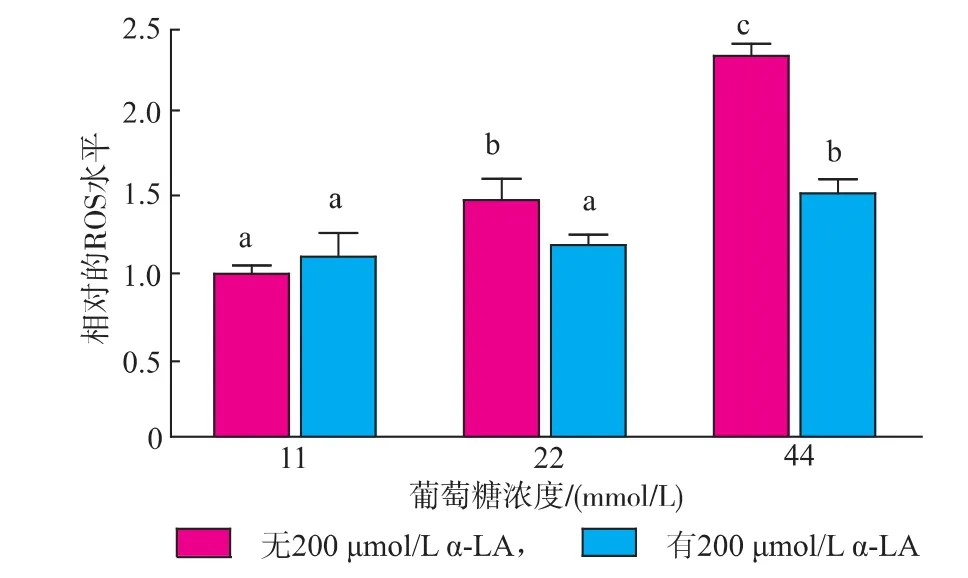
圖1 各組細胞存活率及ROS水平的影響Fig.1 Influence of α-LA on ROS and the viability of RIN-m5F treated with glucose
2.2細胞SOD活性、MDA水平以及T-AOC的變化
隨著葡萄糖濃度的增加,細胞內MDA水平顯著升高(P<0.05),SOD、T-AOC顯著降低(P<0.05);而α-LA干預可顯著提高各組SOD活性(P<0.05),22 mmol/L葡萄糖+α-LA組可恢復至正常水平;此外,添加α-LA后可提高22 mmol/L和44 mmol/L葡萄糖組T-AOC水平,降低MDA含量(P<0.05),表明LA可有效降低高糖引起的氧化應激,見表2。
2.3細胞BAX和BCL-2 mRNA表達水平的變化
隨著葡萄糖濃度的增加,BAX mRNA表達水平顯著上調(P<0.05),BCL-2 mRNA表達水平顯著下調(P<0.05);添加α-LA后可在一定程度恢復22 mmol/L和44 mmol/L葡萄糖組BCL-2表達水平,降低BAX表達水平(P<0.05),表明LA具有一定的抗凋亡作用,如圖2所示。
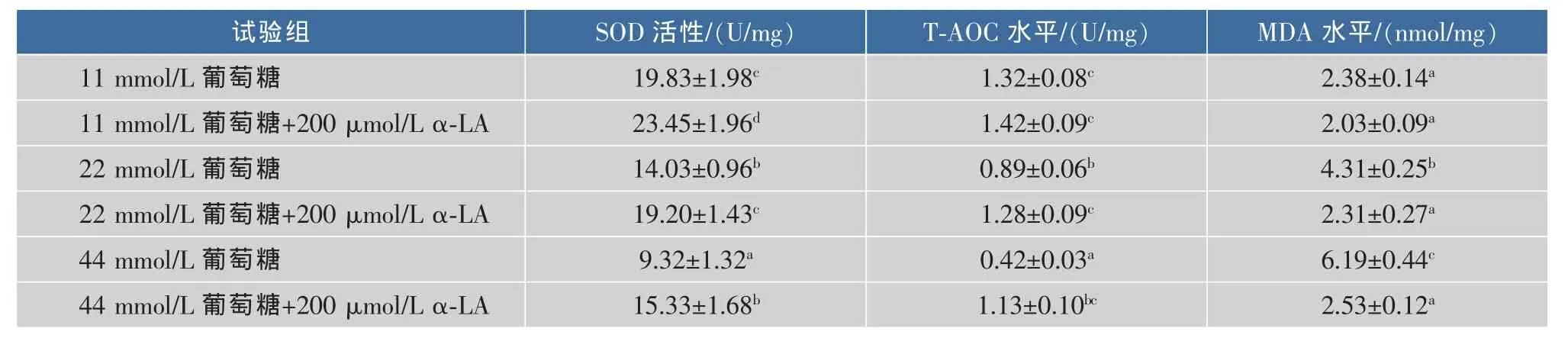
表2 各組細胞MDA、SOD和T-AOC水平的比較Table 2 Effects ofα-LA on MDA content,SOD activities and T-AOC in RIN-m5F treated with glucose
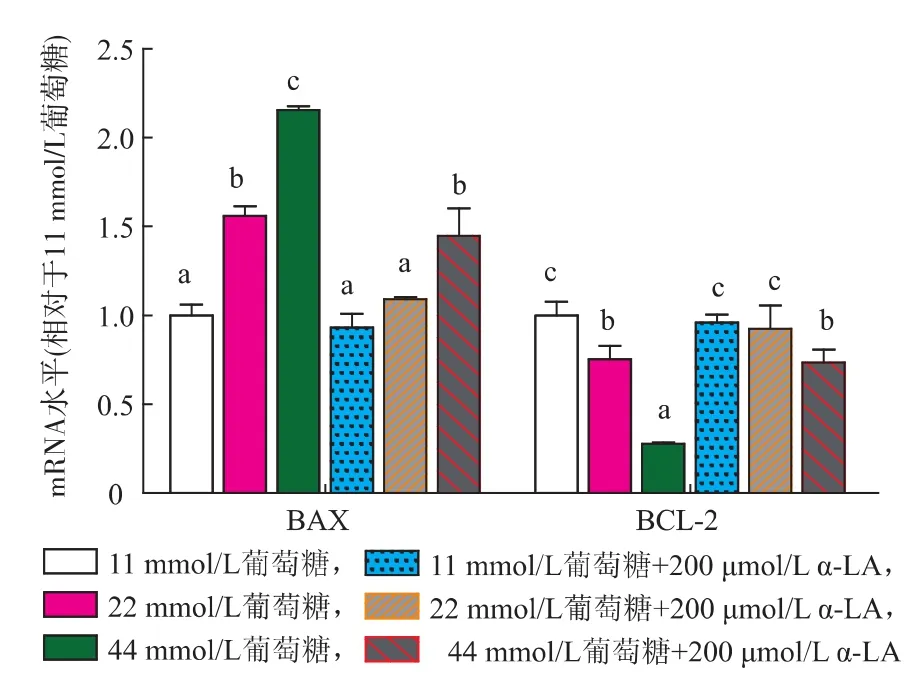
圖2 各組細胞BAX-2mRNA表達的變化Fig.2 Expression of BAX-2 gene in different groups
2.4線粒體膜電位變化
隨著葡萄糖濃度的增加,線粒體膜電位顯著下降(P<0.05);α-LA干預后,各組相比損傷組線粒體膜電位均有顯著升高(P<0.05),且22 mmol/L葡萄糖+α-LA組可恢復至正常水平,如圖3、4所示。
2.5α-LA干預對GSK-3β mRNA表達水平及蛋白質磷酸化水平的影響
α-LA對各組細胞GSK-3β基因水平的影響如圖5所示,GSK-3β mRNA表達水平隨葡萄糖濃度增加而提高(P<0.05);α-LA干預可顯著降低糖損傷組GSK-3β mRNA表達水平,其中22 mmol/L葡萄糖組可下調至正常水平。
Western-blot檢測細胞GSK-3β磷酸化水平,結果如圖6和圖7所示,隨著葡萄糖濃度的升高,GSK-3β Ser9位點磷酸化水平顯著降低(P<0.05);α-LA干預后,相比損傷組Ser9位點磷酸化水平均有顯著升高(P<0.05)。
3 討論
Brownlee的統一機制學說認為,在高糖環境,線粒體呼吸鏈生成過多氧自由基可激活晚期糖基化終末產物途徑、多元醇途徑,以及蛋白激酶C途徑,后者反過來又能促進自由基的生成,形成惡性循環[15]。
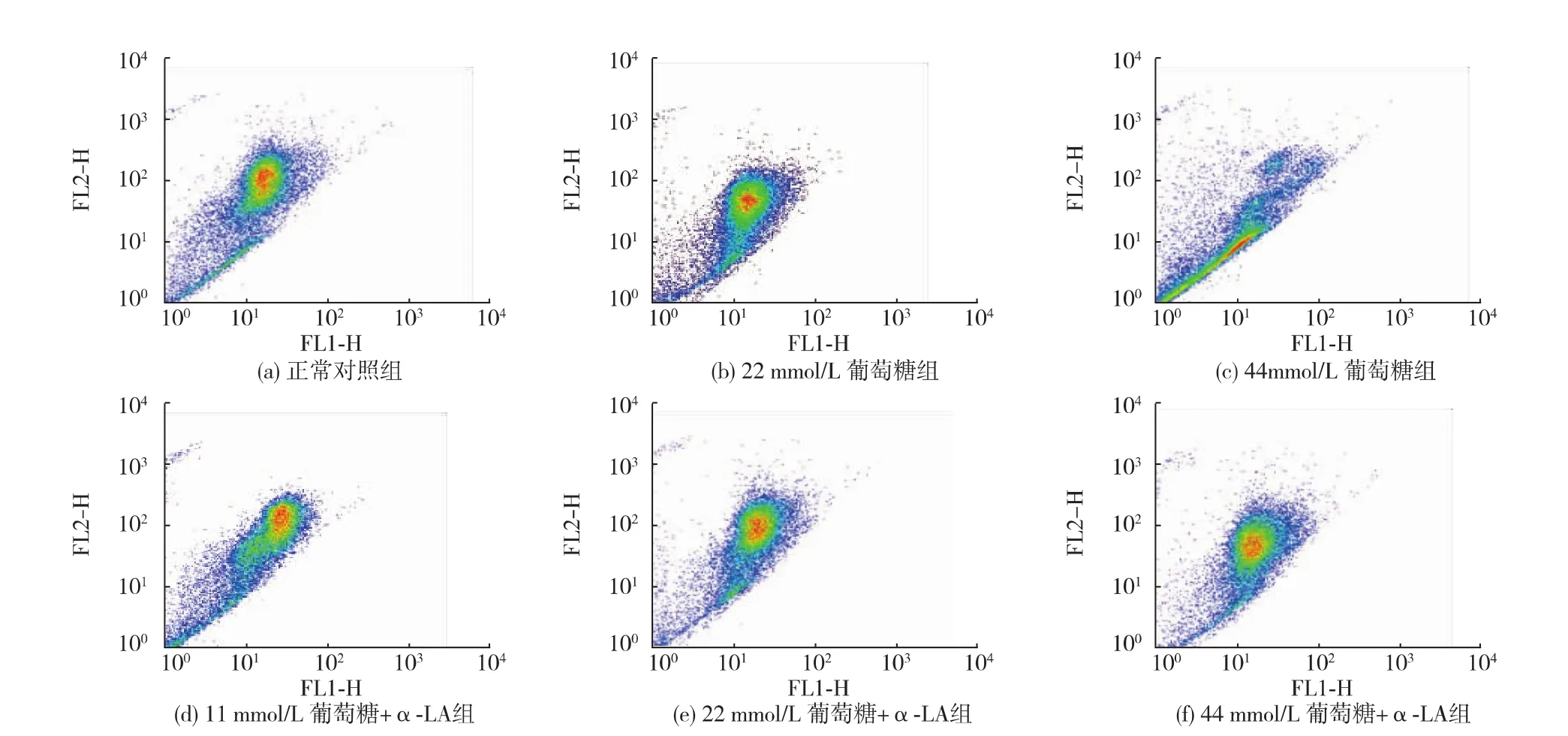
圖3 α-LA對RIN-m5F細胞線粒體膜電位的影響Fig.3 Influence of α-LA to the mitochondrial membrane potential of RIN-m5F cell
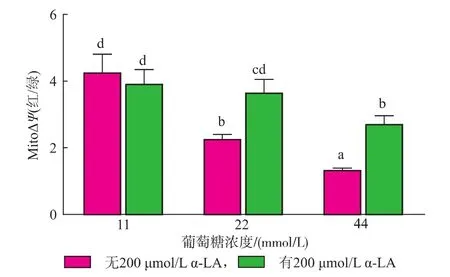
圖4 α-LA對RIN-m5F細胞線粒體膜電位的影響Fig.4 Influence of α-LA to the mitochondrial membrane potential of RIN-m5F cell
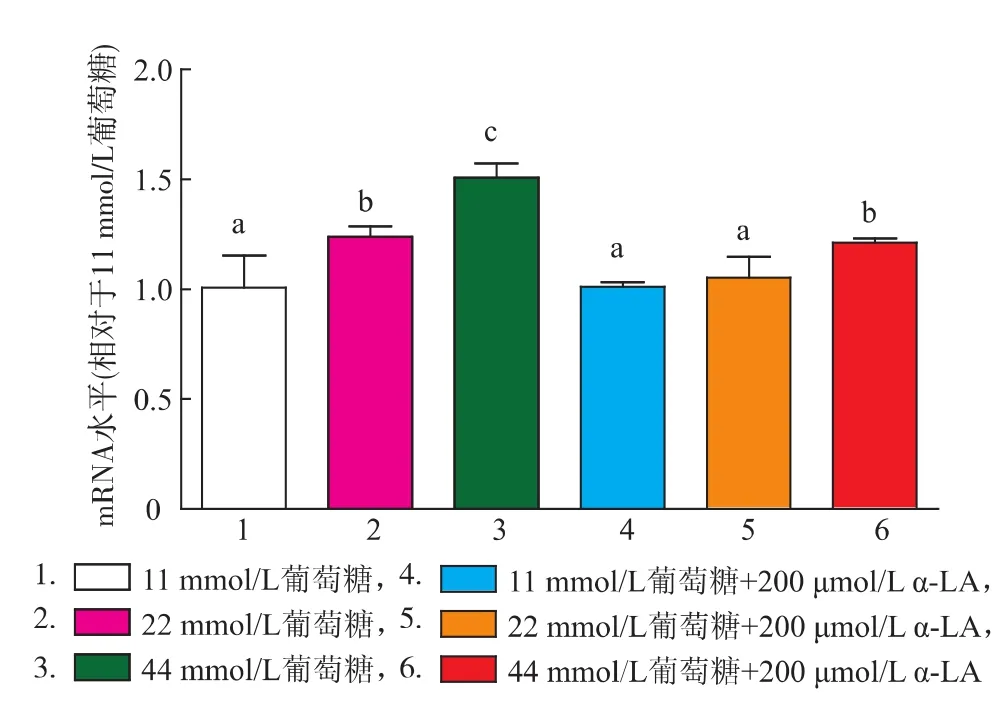
圖5 各組細胞GSK-3β mRNA表達的變化Fig.5 Expression of GSK-3β gene in different groups
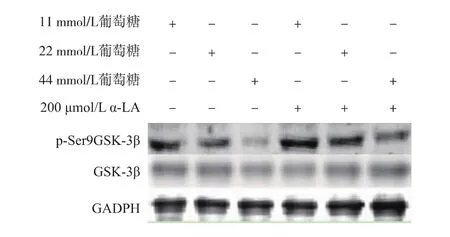
圖6 western-blot檢測各組細胞p-GSK-3β蛋白水平表達Fig.6 western-blot of p-GSK-3β protein in different groups
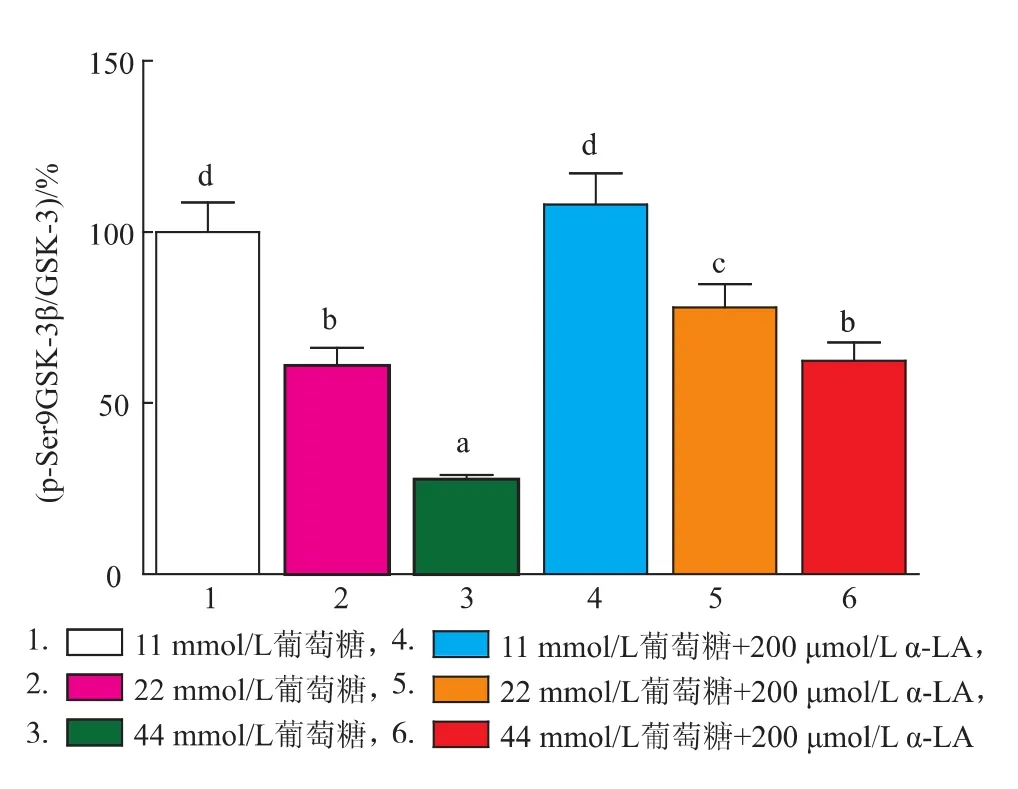
圖7 western-blot檢測各組細胞p-GSK-3β蛋白表達灰度值Fig.7 western-blot of p-GSK-3β protein in different groups
胰島β細胞功能紊亂是糖尿病發生的中心環節,由于β細胞抗氧化系統處于較低水平,使其更易發生氧化應激,誘導細胞凋亡及胰島素分泌功能降低[16]。正常生理狀況下,胞內ROS生成和清除處于動態平衡,ROS過多生成引起細胞氧化損傷。
MDA是細胞膜脂質被活性氧氧化的產物,是評價氧化損傷程度的重要標志物,其過度累積可直接反映受氧化應激損傷的程度[17]。SOD是細胞受到外界刺激產生的內源性抗氧化酶類,可以清除活性氧物質,對維持氧化與抗氧化平衡起著重要作用,通過檢測SOD活性可間接反映胞內氧化應激水平[18]。本研究中以11、22、44 mmol/L葡萄糖分別孵育RIN-m5F細胞72 h,發現高糖可誘導細胞產生氧化應激,且與糖濃度呈正相關。200 μmol/L α-LA干預可使高糖組細胞MDA和ROS生成顯著降低,SOD活性及T-AOC水平顯著升高。表明α-LA對RIN-m5F細胞的抗氧化保護作用,與調節抗氧化酶活性、增強總抗氧化能力有關。
糖原合成酶激酶GSK-3β是一種高度保守的絲氨酸/蘇氨酸蛋白激酶,在生物體內參與多種蛋白質的轉錄與激活,以及調控細胞增殖、分化和凋亡等生命活動的信號轉導,具有廣泛的細胞調節作用。研究發現,ROS升高導致GSK-3β Ser9位點磷酸化水平降低,從而激活GSK-3β,造成線粒體內Ca2+外流,線粒體膜電位改變,PTP通道打開。激活后的GSK-3β能夠促進線粒體促凋亡蛋白質BAX表達[10]。BAX是BCL-2家族的重要蛋白質之一,正常條件下BCL-2與BAX形成異源二聚體,抑制BAX的功能。當BCL-2減少時,釋放出來的BAX形成同源二聚體,在線粒體外膜形成足夠讓凋亡蛋白質傳輸的孔道,使線粒體膜電位破壞,造成線粒體膜電位下降,誘導細胞凋亡。王俐[19]等研究發現,α-LA可以抑制高糖誘導的ECV304細胞線粒體膜電位降低,保護細胞免受氧化損傷。Yoshiki Koriyama[14]等指出,LA可以通過抑制GSK-3β的表達對抗BV-2細胞炎癥反應,為神經病變性疾病提供依據。但α-LA能否調節胰島細胞GSK-3β活性,尚未見相關報道。本研究結果顯示,高糖可以顯著誘導RIN-m5F細胞凋亡,上調GSK-3β mRNA表達水平,下調GSK-3β Ser9位點的磷酸化水平,激活GSK-3β活性;α-LA干預后,GSK-3β mRNA水平顯著下調,GSK-3β Ser9位點的磷酸化水平顯著上調,并且伴隨Bax mRNA表達水平下調及BCL-2 mRNA水平上調,線粒體膜電位顯著升高,其中200 μmol/L α-LA可使22 mmol/L葡萄糖組各項指標恢復至正常水平。表明α-LA可能通過抑制GSK-3β活性調節線粒體BCL-2表達,從而抑制BAX釋放,進而提高線粒體膜電位,抑制高糖誘導的細胞凋亡,維護細胞氧化還原穩態。
4 結語
綜上,推測GSK-3β可能是α-LA保護高糖損傷胰島細胞的一個重要信號分子,α-LA可能通過提高GSK-3β Ser9磷酸化水平抑制其活性,從而降低促凋亡蛋白質表達,提高線粒體膜電位,維護RIN-m5F細胞氧化還原穩態。
[1]Robertson R P,Harmon J S.Diabetes,glucose toxicity,and oxidative stress:a case of double jeopardy for the pancreatic islet β cell[J].Free Radical Biology and Medicine,2006,41(2):177-184.
[2]Bilska A,Wlodek L.Lipoic acid-the drug of the future[J].Pharmacol Rep,2005,57(5):570-577.
[3]Biewenga G P,Haenen G R M M,Bast A.The pharmacology of the antioxidant lipoic acid[J].General Pharmacology:The Vascular System,1997,29(3):315-331.
[4]Saliou C,Kitazawa M.Antioxidants modulate acute solar ultraviolet radiation-induced NF-B activation in a human keratinocyte cell line[J].Free Radic Biol Med,1999,26:174-183.
[5]Meng X,Li Z M,Zhou Y J,et al.Effect of the antioxidant α-lipoic acid on apoptosis in human umbilical vein endothelial cells induced by high glucose[J].Clinical and Experimental Medicine,2008,8(1):43-49.
[6]Byun C H,Koh J M.Alpha-lipoic acid inhibits TNF-alpha-induced apoptosis in human bone marrow stromal cells[J].Bone Miner Res,2015,20(7):1125-1130.
[7]Diesel B,Kulhanek-Heinze S,Holtje M,et al.α-Lipoic Acid as a directly binding activator of the insulin receptor:protection from hepatocyte apoptosis[J].Biochemistry,2007,46(8):2146-2155.
[8]Yang Y,Wang W,Liu Y,et al.α-lipoic acid inhibits high glucose‐induced apoptosis in HIT-T15 cells[J].Development,Growth&Differentiation,2012,54(5):557-565.
[9]Lee B W,Kwon S J,Chae H Y,et al.Dose-related cytoprotective effect of α-lipoic acid on hydrogen peroxide-induced oxidative stress to pancreatic beta cells[J].Free Radical Research,2009,43(1):68-77.
[10]Chiara F,Rasola A.GSK-3 and mitochondria in cancer cells[J].Frontiers in Oncology,2013(3):1.
[11]Liu Y,Tanabe K,Baronnier D,et al.Conditional ablation of Gsk-3β in islet beta cells results in expanded mass and resistance to fat feeding-induced diabetes in mice[J].Diabetologia,2010,53(12):2600-2610.
[12]趙麗艷,余秀娟,韓天云,等.姜黃素神經保護作用研究進展[J].神經藥理學報,2012,2(2):58-64.
ZHAO Liyan,YU Xiujuan,HAN Tianyun,et al.Research progress on neuroprotective effects of curcumin[J].Acta Neuropharmacologica,2012,2(2):58-64.(in Chinese)
[13]姜蘇蓉.α-硫辛酸對活性氮介導心肌損傷的保護作用及其機制研究[D].南京:南京醫科大學,2013.
[14]Koriyama Y,Nakayama Y,Matsugo S,et al.Anti-inflammatory effects of lipoic acid through inhibition of GSK-3β in lipopolysaccharide-induced BV-2 microglial cells[J].Neuroscience Research,2013,77(1):87-96.
[15]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414:813-820.
[16]Simona Cernea,Minodora Dobreanu.Diabetes and beta cell function:from mechanisms to evaluation and clinical implications[J]. Biochemia Medica,2013,23(3):266-280.
[17]Andriantsitohaina R,Duluc L.Systems biology of antioxidants[J].Clin Sci,2012,123:173-192.
[18]Sugino N.The role of oxygen radical—mediated signaling pathways in endometrial function[J].Placenta,2007,28:133-136.
[19]王俐,蔡美琴,劉秀玲,等.α-硫辛酸對高糖和H2O2致ECV304細胞線粒體氧化損傷的保護作用[J].營養學報,2010,32(3):234-238.
WANG Li,CAI Meiqin,LIU Xiuling,et al.The protective effects of α-lipoic acid against oxidative damage induced by hyperglycemia and hydrogen peroxide in ECV304 cell mitochondria[J].Acta Nutrimenta Sinica,2010,32(3):234-238.(in Chinese)
Cytoprotective Effect of α-Lipoic Acid on RIN-m5F Cultured with High Glucose
GAO Cuicui1,TANG Xue1,2,LIN Yi1,CHEN Lili1,SHI Yonghui1,2,LE Guowei*1,2
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.The State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The aim of this study is to investigate whether α-lipoic acid(α-LA)prevents high glucose-induced oxidative damage and apoptosis of pancreatic islet beta cells.In the present sudy,RIN-m5F cells were incubated with different concentration of glucose(11 mmol/L,22 mmol/L and 44 mmol/L)in the presence or absence of 200 μmol/L α-LA for 72 h.Then,cellular reactive oxygen species(ROS)levels,malandialdehyde(MDA)levels,total antioxidant capacity(T-AOC)and superoxide dismutase(SOD)activity were assayed with the appropriate test kits;mitochondrial membrane potential was detected by flow cytometry;relative genes levels were analyzed by reverse transcriptase polymerase chain reaction;western blotting was used to determine protein expression of GSK-3β and p-GSK-3β(Ser9).The results show that α-LA significantly reduced the MDAformation and inhibited the ROS production induced by high glucose,whereas increased T-AOC and SOD activity.Additionally,α-LA induced membrane depolarization and increased mitochondrial membrane potential.These effects were mediated by Bcl-2 associated X protein(BAX)and B-cell lymphoma-2(BCL-2)expression.Western blotting indicated that α-LA inhibited GSK-3β by increasing p-GSK-3β(Ser9)level.Therefore,our data suggest that α-LA can effectively attenuate high glucose-induced RIN-m5F cell oxidative damage and apoptosis,by mechanisms which probably involves the inactivation of GSK-3β by phosphorylation.These findings provide a new interpretation on the role of α-LA in the treatment of diabetes.
α-lipoic acid,glucose,oxidative stress,apoptosis
TS 201.2
A
1673—1689(2015)09—0949—07
2014-06-04
國家“十二五”科技支撐計劃項目(2012BAD33B05);江蘇高校優勢學科建設工程資助項目。
樂國偉(1956—),男,浙江寧波人,農學博士,教授,博士研究生導師,主要從事營養代謝與調控研究。E-mail:lgw@jiangnan.edu.cn

