添加擴增內標的PCR方法快速檢測食品中的沙門氏菌
張德福,付緒磊,湯軼偉,白鳳翎,殷 喆,楊文慧,趙麗紅,張義全,李 春,勵建榮,*(.渤海大學食品科學與工程學院,遼寧省食品安全重點實驗室,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧錦州0;.軍事醫學科學院微生物流行病研究所,病原微生物生物安全國家重點實驗室,北京0007;.江蘇大學醫學院,江蘇鎮江0;.渤海大學數理學院,遼寧錦州0)
添加擴增內標的PCR方法快速檢測食品中的沙門氏菌
張德福1,2,付緒磊1,湯軼偉1,白鳳翎1,殷喆2,楊文慧2,趙麗紅1,張義全3,李春4,勵建榮1,*
(1.渤海大學食品科學與工程學院,遼寧省食品安全重點實驗室,生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧錦州121013;2.軍事醫學科學院微生物流行病研究所,病原微生物生物安全國家重點實驗室,北京100071;3.江蘇大學醫學院,江蘇鎮江212013;4.渤海大學數理學院,遼寧錦州121013)
為了建立一種含擴增內標的沙門氏菌PCR檢測方法,以細菌16S rRNA為擴增內標對照,以沙門氏菌invA基因為靶基因設計了一對引物,并優化了PCR反應體系。通過對20種細菌進行PCR檢測顯示,該方法對沙門氏菌具有良好的特異性。靈敏度實驗表明,該檢測方法對沙門氏菌純DNA模板的檢測靈敏度為61.1 fg/μL,對沙門氏菌純培養物的檢測靈敏度為2×102cfu/mL。對人工污染蛋清的檢測實驗顯示,沙門氏菌接種量為2 cfu/25 mL的雞蛋清樣品經過8 h增菌培養后,可被該方法檢出。結果表明,該檢測方法特異性強、靈敏度高,能排除沙門氏菌PCR檢測方法中可能出現的假陰性現象,適用于雞蛋等食品中沙門氏菌的快速檢測。
沙門氏菌,PCR檢測,擴增內標對照,假陰性
沙門氏菌(Salmonlla)是目前世界上最重要的食源性致病菌之一,食物傳播被認為是人類感染沙門氏菌的主要途徑,肉、蛋、奶等動物源性食品是最容易被沙門氏菌污染的食品[1]。人類食用被沙門氏菌污染的食品會引發惡心、嘔吐、腹痛、腹瀉、痙攣、發燒及頭痛等癥狀[2],嚴重時可導致脫水死亡[3]。在世界范圍內,沙門氏菌引起的中毒事件曾占全部食品中毒事件的第一位或第二位[4]。雖然目前世界上沙門氏菌病總的發病趨勢有所下降,但幾乎每年都有不同程度的沙門氏菌中毒事件的報道[5]。為有效的預防和控制沙門氏菌疾病發生,建立快速有效的沙門氏菌檢測方法是非常必要的。目前,法定的沙門氏菌檢測方法仍采用傳統培養法,操作繁瑣,耗時較長,且腸桿菌科的細菌間生化反應多有交叉[6]。主流的LAMP檢測方法敏感性較高,極易污染造成假陽性,且引物設計要求較高。不能滿足現代社會對沙門氏菌快速檢測的需求。基于聚合酶鏈式反應(PCR)的檢測技術,因其快速、靈敏、特異性強等優點,在病原微生物檢測中具有巨大的優勢,已廣泛應用于病原微生物的檢測。
近年來有報道指出,在PCR實際檢測過程中,由于環境和中間處理環節帶來的一些潛在PCR反應抑制劑影響PCR反應,其結果會出現假陰性現象[7]。雖然研究人員對PCR技術進行了不斷的研究和改進,但仍未有消除抑制因素的有效方法,這限制了PCR技術在病原微生物檢測中的應用。有研究指出,在PCR反應體系中添加指示假陰性的擴增內標對照(internal amplification control,IAC)可以有效的提高PCR檢測結果的準確性,減少假陰性的擴增結果[8-9]。PCR反應體系中采用16S rRNA的通用引物27F和1492R作為擴增內標引物,只要被檢測樣品中含有任意細菌,即可在電泳結果中觀察到一條大小為1465 bp的電泳條帶,所以整個PCR反應體系只需要加入擴增內標引物27F和1492R,不需要添加擴增內標片段,就可以達到指示假陰性結果的目的。在反應體系中,若食品樣品未受沙門氏菌污染,應有擴增內標片段的擴增產物。而當PCR反應沒有產生任何擴增產物時,說明反應可能受到了抑制,產生了假陰性,需重新處理待檢食品樣品。
invA基因是位于沙門氏菌毒力島1上的一段高度保守序列[10],幾乎所有血清型的沙門氏菌均含有invA基因[11],目前invA基因已成為沙門氏菌檢測的重要靶向基因[12]。本研究以細菌16S rRNA為擴增內標對照,以編碼沙門氏菌侵襲蛋白的invA基因為靶基因設計引物,建立了快速檢測雞蛋及蛋制品中沙門氏菌的快速PCR檢測方法,并從特異性、純DNA和純培養物靈敏度以及人工污染雞蛋清樣品三個方面對該檢測方法進行評價。
1 材料與方法
1.1材料與儀器
實驗用的20株菌株來源見表1;Taq-PCR Master Mix、細菌基因組DNA提取試劑盒、DNA Marker D2000生工生物工程(上海)股份有限公司;瓊脂糖Sigma公司;LB培養基北京奧博星生物技術有限公司。
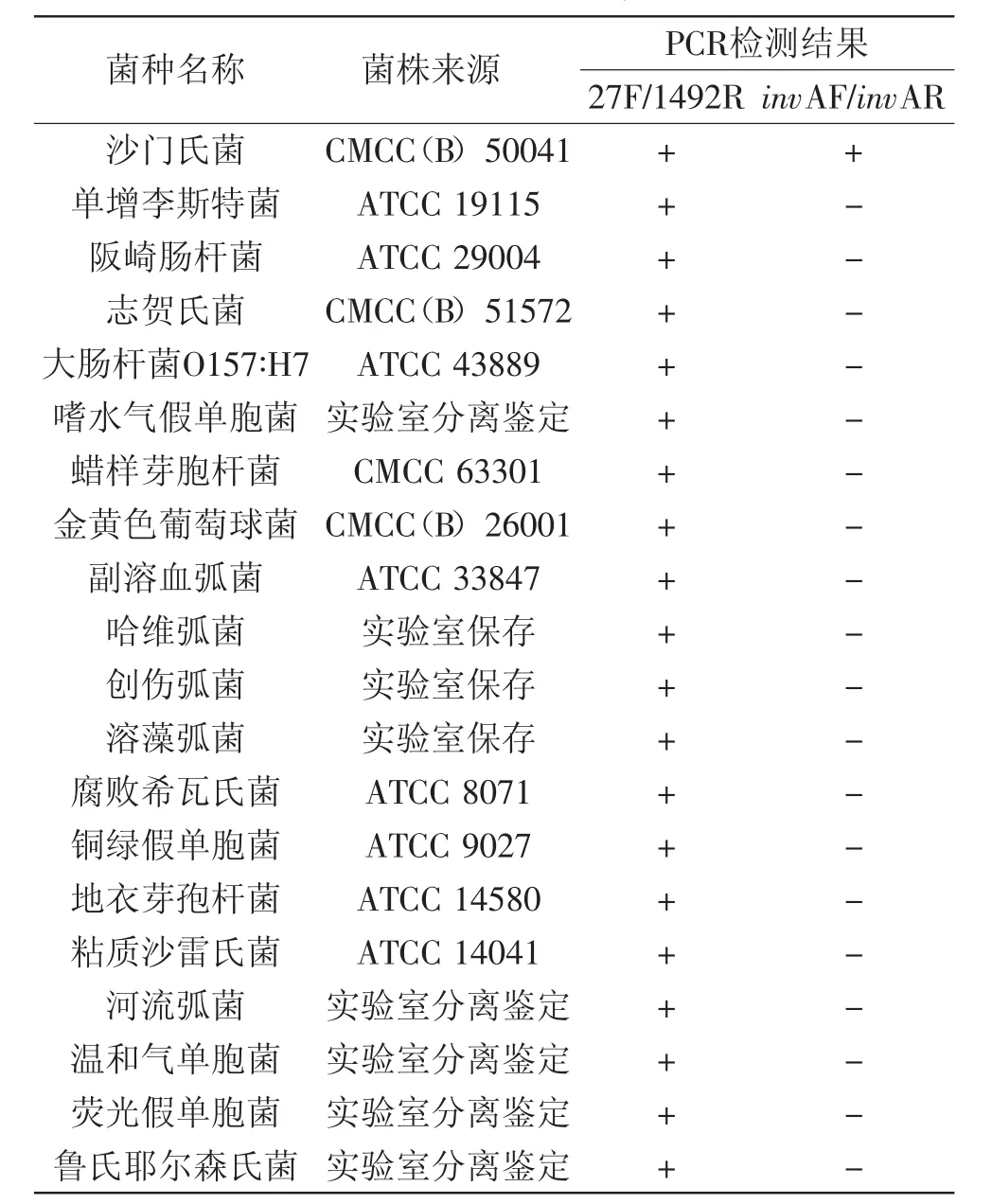
表1 實驗用菌株及其PCR結果Table 1 Bacteria strains used in this study and the results of PCR
Mastercycler pro梯度PCR儀、5424R冷凍離心機德國艾本德股份有限公司;DYY-8C型電泳儀北京市六一儀器廠;Cheimd Doc XRS型凝膠成像儀美國Bio-Rad公司;NanoDrop 2000超微量分光光度計美國賽默飛世爾科技公司;DL-CJ-2N型超級潔凈工作臺東聯哈爾(北京)儀器制造有限公司;LRH系列生化培養箱上海一恒科學儀器有限公司;LC-08拍擊式均質器寧波立成儀器有限公司。
1.2實驗方法
1.2.1沙門氏菌培養及DNA提取將實驗室保存的菌種于LB平板上劃線,37℃培養過夜。挑單菌落于LB液體培養基內,37℃培養10 h。采用細菌基因組DNA提取試劑盒提取沙門氏菌的基因組DNA,提取的DNA溶液置于-20℃冰箱保存。
1.2.2沙門氏菌基因組DNA濃度使用NanoDrop 2000超微量分光光度計測定提取的沙門氏菌基因組DNA濃度。
1.2.3引物設計和篩選選擇沙門氏菌特異性基因invA(GenBank:NC_003197.1),利用軟件Primer 5.0設計引物,經PCR反應驗證篩選出一對特異性良好的沙門氏菌檢測引物:invAF/invAR。采用細菌16S rRNA擴增通用引物27F和1492R作為PCR反應內標對照引物。實驗所用引物序列如表2所示。
1.2.4PCR檢測方法的建立根據Taq PCR MasterMix說明書所建議的PCR反應體系對PCR反應體系的各組分含量以及擴增程序進行微調,最終確定PCR反應最佳條件為:總體系25 μL,其中Taq PCR Master Mix 12.5 μL,DNA模板1 μL,16S rRNA引物和沙門氏菌引物終濃度均為0.4 μmol/L,補充無菌水至25 μL。以無菌水作為空白對照。

表2 引物序列Table 2 Primer sequence
PCR反應程序:94℃預變性4 min,35個循環,每個循環94℃變性30 s、53.3℃退火30 s、72℃延伸90 s,最后72℃延伸10 min。PCR產物使用1.5%的瓊脂糖凝膠進行電泳,凝膠成像儀下觀察結果。
1.2.5特異性驗證使用細菌基因組DNA提取試劑盒提取表1中細菌的基因組DNA,并用建立的含擴增內標的PCR檢測方法對所有細菌的基因組DNA進行檢測,驗證該PCR檢測方法的特異性。
1.2.6靈敏度評價
1.2.6.1純DNA靈敏度評價將提取的沙門氏菌基因組DNA用無菌超純水進行10倍梯度稀釋,取濃度在6.11×108~6.11 fg/μL之間的DNA溶液進行PCR擴增,凝膠成像后能得到肉眼可見條帶的DNA溶液濃度即為該PCR反應的DNA靈敏度。
1.2.6.2純培養物靈敏度評價將活化的沙門氏菌接種于LB液體培養基中,37℃培養10 h后,用無菌生理鹽水進行10倍梯度稀釋,取10-5、10-6、10-7、10-8四個稀釋度的菌懸液進行平板計數。沙門氏菌濃度測定后,用無菌超純水進行10倍梯度稀釋,每個稀釋度取1 mL置于1.5 mL離心管中。參照劉斌等[10]的方法提取沙門氏菌的基因組DNA。離心管中的菌液12000 r/min離心5 min,吸棄上清液,收集沙門氏菌菌體。用100 μL無菌超純水重新懸浮菌體,在沸水浴中煮10 min。從沸水浴中取出后,立即在-20℃放置30 min。在37℃解凍后4000 r/min離心5 min,所得上清液作為模板進行PCR擴增,檢測沙門氏菌在純培養狀態下的靈敏度。
1.2.7人工污染食品樣品實驗取10份雞蛋清,每份25 mL,在超凈工作臺中紫外殺菌30 min。將濃度為2×109CFU/mL的沙門氏菌菌液1 mL接種于無菌蛋清中,使蛋清中沙門氏菌接種量分別為2、20、200 cfu/25 mL,每組做3個平行對照。另取1 mL 0.85%的無菌生理鹽水加入無菌蛋清中做為空白對照,即接菌量為0。將上述10份人工污染樣品添加到225 mL LB培養基中,37℃,150 r/min的搖床中增菌培養,每隔2 h取1 mL菌液放入1.5 mL離心管中。收集的菌液12000 r/min離心5 min,吸棄上清液,再用無菌超純水重新懸浮菌體。離心洗滌3次后采用1.2.6.2中的實驗方法提取沙門氏菌的基因組DNA作為模板進行PCR擴增。
1.2.8食品樣品檢測采集新鮮肉、雞蛋、牛奶三種食品樣品,共50份,每份樣品取25 g或25 mL。鮮肉樣品加入到盛有225 mL LB培養基的無菌均質袋中,使用拍擊式均質器拍打2 min,雞蛋及牛奶樣品不進行均質,直接與培養基混勻。無菌操作將樣品轉移至錐形瓶中,37℃,150 r/min的搖床中增菌培養8 h。使用1.2.6.2中的方法提取基因組DNA,并用建立的PCR檢測方法進行檢測。
2 結果與分析
2.1基因組DNA濃度
提取的沙門氏菌基因組DNA溶液,經超微量分光光度計測定濃度為611.12 ng/μL。
2.2特異性驗證
PCR檢驗結果如表1所示,只有沙門氏菌基因組DNA能全部擴增出大小為435 bp的檢測條帶和大小為1465 bp的擴增內標對照條帶,而它細菌基因組DNA只能擴增出大小為1465 bp的擴增內標對照條帶。表明實驗所設計的引物invAF/invAR的特異性良好。
2.3靈敏度評價
2.3.1純DNA靈敏度實驗如圖1所示,沙門氏菌基因組DNA經10倍梯度稀釋至61.1 fg/μL時,PCR檢測結果仍有肉眼可見條帶,可視為沙門氏菌基因組DNA的檢測限為61.1 fg/μL。

圖1 沙門氏菌基因組DNA檢測靈敏度Fig.1 Sensitivity of detection for Salmonella genomic DNA
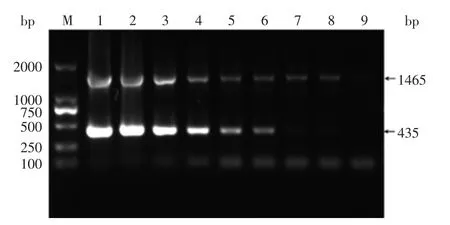
圖2 沙門氏菌純培養物檢測靈敏度Fig.2 Sensitivity of detection for Salmonella pure cultures
2.3.2純培養物靈敏度實驗對培養好的沙門氏菌菌液進行平板菌落計數,沙門氏菌液濃度為2×109CFU/mL。如圖2所示,沙門氏菌菌液稀釋到2× 102CFU/mL時,PCR檢測結果仍有肉眼可見條帶,可視為沙門氏菌純培養物檢測限為2×102CFU/mL。
2.4人工污染食品樣品實驗
蛋清樣品中接種的三個濃度的菌量分別為200、20、2 cfu/25 mL。PCR檢測結果如表3所示,接菌量為200 cfu/25 mL的蛋清樣品,在增菌培養6 h后即可檢出。接菌量為2 cfu/25 mL和20 cfu/25 mL的蛋清樣品,在增菌培養8 h后可以檢出。這表明,該PCR檢測方法最多經8 h增菌培養后,即可鑒定食品樣品是否被沙門氏菌污染。
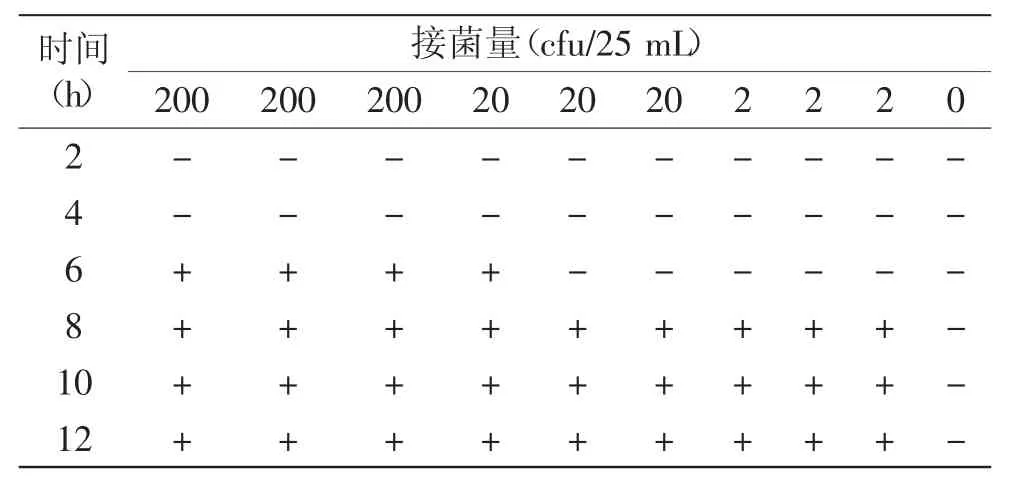
表3 人工污染食品樣品檢測結果Table 3 Artificially contaminated food sample test results
2.5食品樣品檢測結果
50份食品檢測結果如表4所示,總計50份樣品中19份擴增出目的條帶和擴增內標條帶,表明食品樣品受沙門氏菌污染;28份樣品中只擴增出擴增內標條帶,無目的條帶,表明食品未受沙門氏菌污染,3份樣品未擴增出任何條帶,表明樣品檢測過程中PCR反應受到抑制。對3份未擴增出條帶的樣品培養液進行稀釋處理,重新檢測結果顯示3份樣品均僅能擴增出一條內標條帶。結果顯示,實驗采集的50份食品樣品中19份受到沙門氏菌污染。

表4 食品樣品檢測結果Table 4 Food sample test results
3 結論
實驗結果表明,以細菌16S rRNA為擴增內標對照,以沙門氏菌invA基因為檢測基因建立的PCR反應體系特異性強,靈敏度高。在擴增內標存在的條件下,從沙門氏菌菌體中提取的純基因組DNA檢測靈敏度為61.1 fg/μL,沙門氏菌純培養物檢測靈敏度可達2×102CFU/mL,與劉斌、楊晉、Singh等的報道大致相同[3,13-14]。實驗過程中,采用簡單的煮沸裂解法代替繁瑣的傳統DNA提取方法提取樣品中沙門氏菌的基因組DNA,既能確保低豐度的微生物被檢測到,又具有步驟少、耗時短、成本低等優點[15]。沙門氏菌接種量為200、20、2 cfu/25 mL的人工污染蛋清樣品,經6 h和8 h增菌培養后即可檢出。這表明,在實際樣品檢測過程中,一般增菌6~8 h,就可滿足該PCR檢測方法的檢出限,加上DNA模板提取、PCR擴增和電泳分析過程,整個檢測至多需要12 h,遠低于傳統培養檢測方法的4~5 d。
本研究建立的含擴增內標的沙門氏菌PCR檢測方法,檢測時間短,特異性好,靈敏度高,可有效排除檢測過程中存在的假陰性現象。因此,該檢測方法在檢測沙門氏菌方面具有良好的性能,可以滿足沙門氏菌快速檢測的需求。
[1]Hassena A B,Barkallah M,Fendri I,et al.Real time PCR gene profiling and detection of Salmonella using a novel target:The siiA gene[J].Journal of Microbiological Methods,2015,109(1):9-15.
[2]黃文宇,柳陳堅.食源性沙門氏菌檢測方法的研究進展[J].生物技術,2009,19(3):95-98.
[3]楊晉,曾慶梅,張笛,等.添加擴增內標的沙門氏菌PCR檢測方法[J].生物技術通報,2014,30(7):54-59.
[4]Manzano M,Cocolin L,Astori G,et al.Development of a PCR microplate-capture hybridization method for simple,fast and sensitive detection of Salmonella serovars in food[J].Molecular and Cellular Probes,1998,12(4):227-234.
[5]王軍,鄭增忍,王晶鈺.動物源性食品中沙門氏菌的風險評估[J].中國動物檢疫,2007,24(4):23-25.
[6]陳金頂,索青利,廖明,等.沙門氏菌的invA基因序列分析與分子檢測[J].中國人獸共患病雜志,2004,20(10):868-871.
[7]Malorny R,Tassios P T,Radstrom P,et al.Standardization of diagnostic PCR for the detection of foodborne pathogens[J]. International Journal of Food Microbiology,2003,83(1):39-48.
[8]Zhang W J,Cai Q,Guan X,et al.Detection of peanut(Arachis hypogaea)allergen by Real-time PCR method with internal amplification control[J].Food Chemistry,2015,174:547-552.
[9]Hoorfar J,Malorny B,Abdulmawjood A,et al.Practical considerations in design of internal amplification controls for diagnostic PCR assays[J].Journal of Clinical Microbiology,2004,42(5):1863-1868.
[10]Malorny B,Hoorfar J,Bunge C,et al.Multicenter validation of the analytical accuracy of Salmonella PCR:towards an international standard.[J].Applied&Environmental Microbiology,2003,69(1):290-296.
[11]Daum LT.Real-time PCR detection of salmonella in suspect foods from a gastroenteritis outbreak in kerr county,Texas.[J]. Journal of Clinical Microbiology,2002,40(8):3050-3052.
[12]Zhang D,Yan Y,Li Q,et al.Label-free and high-sensitive detection of Salmonella using a surface plasmon resonance DNA-based biosensor.[J].Journal of Biotechnology,2012,160(3-4):123-128.
[13]劉斌,史賢明.擴增內標在沙門氏菌PCR檢測方法中的應用[J].微生物學通報,2006,33(2):156-161.[14]Singh P,Mustapha A.Development of a real-time PCR melt curve assay for simultaneous detection of virulent and antibiotic resistant Salmonella[J].Food Microbiology,2014,44:6-14.
[15]夏樂先,孫文娟,沈振,等.煮沸裂解法和試劑盒法提取浸礦菌基因組DNA的比較[J].現代生物醫學進展,2014(1):31-35,17.
Establishment of a PCR method with an internal amplication control for rapid detection of Salmonlla in foods
ZHANG De-fu1,2,FU Xu-lei1,TANG Yi-wei1,BAI Feng-ling1,YIN Zhe2,YANG Wen-hui2,ZHAO Li-hong1,ZHANG Yi-quan3,LI Chun4,LI Jian-rong1,*
(1.College of Food Science and Project Engineering,Bohai University,Food Safety Key Lab of Liaoning Province,National&Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,State Key Laboratory of Pathogen and Biosecurity,Beijing 100071,China;3.Schoole of Medicine,Jiangsu University,Zhenjiang 212013,China;4.College of Mathematics and Physics,Bohai University,Jinzhou 121013,China)
A PCR assay was developed for the rapid detection of Salmonlla using 16S rRNA as internal amplification control.Primers were designed to detect the gene of invA in Salmonlla and the assay was optimized and assessment.Detection of various bacterias by PCR indicated that this PCR assay was specific for Salmonlla. The sensitivity of detection for Salmonella purified genomic DNA was 61.1 fg/μL and 2×102cfu/mL for pure cultures.The detection for artificially contaminated egg white showed that Salmonlla could be detected after eight hours enrichment culture when the Sallmonla inoculation was 2 cfu/25 mL.This detection method had a good specificity and sensitivity,and could eliminate false-negative results in the PCR detection method for Salmonella,and suitable for rapid detection of Salmonella in food.
Salmonlla;PCR detection;Internal amplification control;false-negative
TS201.6
A
1002-0306(2015)24-054-05
10.13386/j.issn1002-0306.2015.24.002
2015-04-17
張德福(1983-),男,博士,講師,研究方向:食品安全,E-mail:zhangdf@bhu.edu.cn。
勵建榮(1964-),男,博士,教授,研究方向:水產品和果蔬貯藏加工,食品安全,E-mail:lijr6491@163.com。
“十二五”國家科技支撐計劃項目(2012BAD29B06);遼寧省重點實驗室開放課題(LNSAKF2013018);遼寧省高等學校創新團隊項目(LT2014024);病原微生物生物安全國家重點實驗室開放課題(SKLPBS1417,SKLPBS1438);渤海大學博士科研啟動項目(BSQD022)。

