蕎麥粉對高脂膳食大鼠體內抗氧化活性的影響
王 丹,沈 楠,于天龍,葛洪娟,宋春梅,*
(1.吉林醫藥學院公共衛生學院,吉林吉林132013;2.吉林省中醫藥管理局二級實驗室,吉林吉林132013;3.吉林醫藥學院實驗中心機能實驗室,吉林吉林132013)
蕎麥粉對高脂膳食大鼠體內抗氧化活性的影響
王丹1,2,沈楠3,于天龍1,葛洪娟1,2,宋春梅1,2,*
(1.吉林醫藥學院公共衛生學院,吉林吉林132013;2.吉林省中醫藥管理局二級實驗室,吉林吉林132013;3.吉林醫藥學院實驗中心機能實驗室,吉林吉林132013)
研究了蕎麥粉(buckwheat,BW)對高脂膳食大鼠體內抗氧化活性的影響。將50只成年Wistar雄性大鼠隨機分為基礎對照組、高脂模型對照組、蕎麥粉低、中、高劑量組(1、5、10g/kg·d),喂養30d后,測定血清中超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-PX)的活性及丙二醛(MDA)的含量和肝臟組織中超氧化物歧化酶(SOD)活性及丙二醛(MDA)的含量;并觀察主動脈結構。結果顯示,蕎麥粉中、高劑量組與模型對照組相比,蕎麥粉可使高脂膳食大鼠血清SOD、GSH-PX的活性增強(p<0.05)及MDA的含量顯著減少(p<0.05);可使肝臟中SOD活性顯著增強(p<0.05),但MDA的含量顯著減少(p<0.05);主動脈光鏡結構顯示蕎麥粉對高脂膳食大鼠肝臟具有保護作用。說明蕎麥粉具有調節高脂膳食大鼠抗氧化的能力。
蕎麥粉,高脂膳食,抗氧化活性,光鏡結構
高脂膳食結構能夠刺激機體代謝速率加快[1],刺激體內活性氧基團(reactiveoxygenspecies,ROS)和活性氮基團(reactivenitrogenspecies,RNs)等高活性分子過度生成,不能被及時清除而堆積在細胞內,這樣造成機體氧化系統與抗氧化系統失衡,發生機體氧化應激[2]。同時過量的ROS會攻擊生物膜中的多不飽和脂肪酸,造成脂質過氧化,并形成脂質過氧化產物,堆積在細胞內使得細胞正常的生物活性下降,能量代謝、細胞信號轉導等其他功能紊亂;而且自由基和過氧化物對血管壁細胞又具有毒性作用,這樣增加了多種慢性疾病發生的危險性。有研究報道,小鼠經過短期(3周或6周)的高脂膳食可導致機體氧化應激反應,經過長期(26周后)的高脂膳食會導致機體嚴重氧化應激和脂質過氧化。從分子生物角度來講,高脂膳食激活了GSK-3β和Nrf2信號通路,破壞了機體氧化還原狀態的平衡,同時影響了肝臟脂質代謝過程中關鍵基因的表達[3]。
隨著人們生活水平的提高,抗氧化問題越來越受人們的關注。關于探究功能因子抗氧化的機制及如何將其應用在食品和藥品中已經成為研究領域中的熱點問題。蕎麥是一種重要的雜糧作物,富含蛋白質、不飽和脂肪酸、維生素、微量元素等營養成分。有研究表明,蕎麥中的提取物具有抗氧化性及對羥基自由基的清除作用[4]。但是關于蕎麥在高脂飲食過程中體內抗氧化活性的研究報道很少。本研究以蕎麥粉作為研究對象,通過對大鼠體內血清及肝臟組織的GSH-PX活力、SOD活力及MDA的含量測定,探討其抗氧化活性,這將為蕎麥食品及保健品的開發提供可靠的理論依據,為利用蕎麥營養食療高脂膳食所引發的慢性疾病提供可靠的依據。
1 材料與方法
1.1材料與儀器
蕎麥粉吉林市市售,采用凱氏定氮法測定其粗蛋白含量為9.2%,采用索式抽提法測定其脂肪含量為2.01%,按照國標GB/T 5009.88-2008測定其膳食纖維含量為1.04%,按照國標GB 5009.9-85測定其淀粉含量為62.34%,紅外水分測定儀測定其水分含量為10.16%;膽固醇長春鼎國生物技術有限公司;烏拉坦上海譜振生物科技有限公司;雞蛋黃粉吉林金翼蛋品有限公司;豬油吉林市大商超市;氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽過氧化物酶(GSH-PX)試劑盒南京建成生物工程研究所;健康成年Wistar雄性大鼠50只,體重(200±20)g,由吉林大學動物實驗中心提供,許可證號碼為SCXK(吉)-2011-0004。
TD-5A離心機湖南凱達科學儀器有限公司;202-1AB電熱恒溫干燥箱天津市泰斯特儀器有限公司;FA1104N電子天平上海精密科學儀器有限公司;722可見分光光度計上海欣茂儀器有限公司;TAS-960原子吸收分光光度計北京普析通用儀器有限公司;Selectra XL全自動血生化分析儀荷蘭威圖;Hitachi-7650透射電鏡日本日立公司;UC7超薄切片機德國徠卡。
1.2實驗方法
1.2.1高脂模型實驗動物分組及給藥方式將50只大鼠,隨機分為5組,每組10只,分別為基礎對照組、模型對照組、蕎麥低、中、高劑量組,每天定時喂食(每200g體重對應25g飼料),飲水自由。基礎對照組喂食基礎飼料,高脂模型對照組喂食高脂飼料,蕎麥劑量組按照1、5、10g/(kg·d)的低、中、高劑量飼喂相應的蕎麥,每周測一次體重,連續飼喂30d。各模型組飼料配方如下:
基礎對照組飼料配方:玉米粉17.5kg、大豆粉15.0kg、面粉12.5kg、麩皮5.0kg、葵花子油1.0kg,另外加多種維生素和無機鹽。
高脂飼料配方:基礎飼料79%、蛋黃粉10%、豬油10%、膽固醇1%。
蕎麥低劑量組:蕎麥粉0.8%、基礎飼料78.2%、蛋黃粉10%、豬油10%、膽固醇1%。
蕎麥中劑量組:蕎麥粉4%、基礎飼料75%、蛋黃粉10%、豬油10%、膽固醇1%。
蕎麥高劑量組:蕎麥粉8%、基礎飼料71%、蛋黃粉10%、豬油10%、膽固醇1%。
為防止油脂被空氣氧化,每周做一次飼料。
1.2.2血清中生化指標測定高脂膳食大鼠模型末次喂養后禁食12h,不禁水,以10%烏拉坦6mL/kg腹腔注射對大鼠進行麻醉,腹主動脈取血,采用試劑盒測定血清中SOD、GSH-PX的活性,以及MDA的含量。
1.2.3肝臟中生化指標測定10%組織勻漿液制備:稱取肝組織塊1g,放到冰冷生理鹽水中漂洗,除去血液,取出肝臟,濾紙吸干稱重。加入冷生理鹽水9g,眼科小剪剪碎,電動玻璃勻漿機勻漿10min,3000r/min離心10min。取上清液,分裝于EP管中,-4℃保存。采用試劑盒測定測定肝臟組織中SOD活性和MDA的含量。
1.2.4主動脈光鏡結構測定固定:各組隨機取大鼠3只,將大鼠麻醉,固定在解剖臺上,待取血后取出主動脈,用冰生理鹽水漂洗,將部分血管置于多聚甲醛-戊二醛固定液(2%/2.5%),將其切成1mm×1mm× 1mm組織塊。二次固定:2.5%戊二醛(pH7.2~7.4)固定2h,PBS反復換液清洗,1%四氧化鋨第二次固定2h。脫水:乙醇梯度脫水;干燥:環氧丙烷干燥;浸透和包埋聚合;超薄切片;透射電子顯微鏡觀察照相。1.2.5數據處理實驗結果用Excel及SPSS統計軟件進行單因素方差分析和組間兩兩比較(SNK),實驗數據均以平均值±標準差(±sD)表示。
2 結果與討論
2.1蕎麥對高脂膳食大鼠血清中SOD、GSH-PX活性及MDA含量的影響
表1是蕎麥對高脂膳食大鼠血清中SOD、GSH-PX活性及MDA含量的影響結果。
表1 蕎麥對高脂膳食大鼠血清中SOD活性、GSH-PX活性及MDA含量的影響(n=10,±sD)Table 1 The effect of buckwheat on SOD,GSH-PX and MDA activity of mice serum in hyperlipidemia rats(n=10,±sD)

表1 蕎麥對高脂膳食大鼠血清中SOD活性、GSH-PX活性及MDA含量的影響(n=10,±sD)Table 1 The effect of buckwheat on SOD,GSH-PX and MDA activity of mice serum in hyperlipidemia rats(n=10,±sD)
注:*表示與基礎對照組相比差異顯著(p<0.05);#表示與高脂模型組相比差異顯著(p<0.05);表2同。
MDA(nmol/mL)基礎對照組 305.91±45.78 1692.89±120.29 4.06±0.47模型對照組 204.58±66.64*1370.58±111.91*5.62±0.96*蕎麥低劑量組 242.42±24.04*1400.33±152.66*5.36±0.85*蕎麥中劑量組 278.53±43.61#1549.92±81.12*#4.56±0.53#蕎麥高劑量組 283.76±34.31# 1549.5±100.06*#4.35±0.70#組別 SOD活性(U/mL)GSH-PX活性(U/mL)
SOD是細胞內一種重要的抗氧化酶,具有特殊的生理活性,是生物體內清除自由基的首要物質[5],是機體天然存在的超氧自由基清除因子,所以SOD的活性可以反映機體抗氧化損傷的能力。GSH-Px是體內清除H2O2和許多過氧化物的重要酶,在清除脂類過氧化物和氧化防御反應中起著關鍵作用。MDA是機體內脂肪酸代謝受阻時,產生的氧自由基攻擊生物膜中的不飽和脂肪酸引發脂質過氧化作用而形成的一種脂質過氧化物。MDA常常可反映機體內脂質過氧化的程度,間接地反映出細胞氧化損傷的程度[6]。
由表1可得,模型對照組與基礎對照組相比,SOD和GSH-Px活性顯著降低(p<0.05),MDA含量顯著升高(p<0.05),說明高脂膳食能夠降低大鼠體內的抗氧化活性。與模型對照組相比,蕎麥劑量組大鼠血清SOD和GSH-Px活性均增加。隨著蕎麥劑量的增加,其活性逐漸增加,其中蕎麥中、高劑量組大鼠SOD和GSH-Px活性與模型對照組比較具有顯著性差異(p<0.05)。與模型對照組相比,蕎麥劑量組的MDA含量降低,而且隨著蕎麥劑量的增加,其含量逐漸降低,其中蕎麥中、高劑量組大鼠血清MDA含量與模型對照組比較有顯著性差異(p<0.05)。這與蕎麥中所含有的成分有著密切關系,Shun-Cheng Ren等[7]從蕎麥芽中提取酚類物質,發現它具有很好的抗氧化活性。P Jiang研究發現一定劑量的蕎麥能夠抑制低密度脂蛋白氧化,其中蘆丁在抗氧化過程中占有重要的角色[8]。除此之外,蕎麥中蛋白質、膳食纖維均有抗氧化作用。
2.2蕎麥對肝臟組織中SOD活性、MDA含量的影響
表2是蕎麥對高脂膳食大鼠肝臟中SOD活性MDA含量的影響結果。
表2 蕎麥對高脂膳食大鼠肝臟組織中SOD活性及MDA含量的影響(n=10,±sD)Table 2 The effect of buckwheat on SOD,MDA activity of mice livers in hyperlipidemia rats(n=10,±sD)
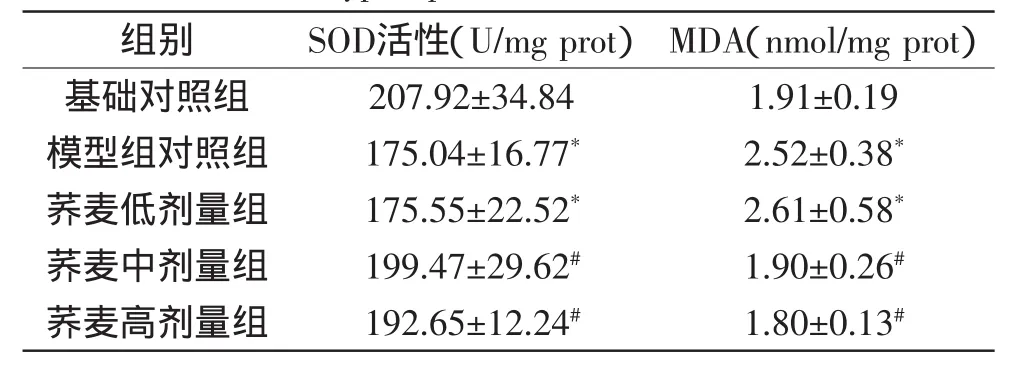
表2 蕎麥對高脂膳食大鼠肝臟組織中SOD活性及MDA含量的影響(n=10,±sD)Table 2 The effect of buckwheat on SOD,MDA activity of mice livers in hyperlipidemia rats(n=10,±sD)
組別 SOD活性(U/mg prot) MDA(nmol/mg prot)基礎對照組 207.92±34.84 1.91±0.19模型組對照組 175.04±16.77* 2.52±0.38*蕎麥低劑量組 175.55±22.52* 2.61±0.58*蕎麥中劑量組 199.47±29.62# 1.90±0.26#蕎麥高劑量組 192.65±12.24# 1.80±0.13#
由表2可得,與基礎對照組相比,模型對照組大鼠肝臟組織中的SOD活性顯著降低(p<0.05),MDA含量顯著升高(p<0.05);與模型對照組相比,蕎麥劑量組大鼠肝臟SOD活性增強,其中蕎麥中、高劑量組與模型對照組比較具有顯著性差異(p<0.05);蕎麥中、高劑量組大鼠肝臟MDA含量與模型對照組比較有顯著性差異(p<0.05)。說明蕎麥粉在肝臟中也可能具有清除自由基、防止過氧化脂質產物產生和抗氧化損傷等的作用。同時,也可能減少過氧化脂質產物與脂類物質結合而發生動脈粥樣硬化的可能性。Li-Yun Lin[9]研究發現,將蕎麥添加到小麥中做成面包,其蘆丁和槲皮素含量增加,蕎麥能夠增強小麥面包的抗氧化活性及自由基清除能力。
2.3光鏡觀察主動脈的微觀結構
由圖1(A)可知,基礎對照組橫切面觀察主動脈管壁有3層分別是內膜、中膜和外膜。內膜由內皮層、內皮下層與內彈性膜組成(內彈性膜與中膜無明顯分界)。內皮細胞扁平,表面比較平滑細胞間連接緊密;中膜較厚,具有多層環形平滑肌和穿插其間的彈性纖維,細胞間排列緊密有序,外膜由膠原纖維、彈性纖維與成纖維細胞等結締組織構成。
由圖1(B)可知,高脂模型組橫切面觀察主動脈管壁內膜較基礎對照組明顯增厚,內皮細胞突向管腔,腔面粗糙,細胞與細胞之間有分離空隙,內彈性膜不連貫。中膜平滑肌細胞明顯腫脹,細胞間排列無序。未見吞噬細胞和粥樣斑塊。
由圖1(C)可知,蕎麥粉低劑量組橫切面觀察主動脈管壁內膜較基礎對照組明顯增厚,光鏡結構與高脂模型組接近。從結果中可以發現低劑量的蕎麥對于高脂膳食大鼠主動脈的改善狀況不明顯。但是有研究指出苦蕎麥中蘆丁對主動脈血管舒張確實有很好的作用[10]。
由圖1(D)可知,蕎麥粉中劑量組橫切面主動脈管壁內膜較基礎對照組厚,較高脂模型組薄,內皮細胞突向管腔,腔面粗糙,內彈性膜連貫。中膜平滑肌細胞沒有明顯腫脹,細胞間排列有序。未見吞噬細胞和粥樣斑塊。可見中劑量的蕎麥對高脂膳食大鼠主動脈微觀結構有一定改善作用。
由圖1(E)可知,蕎麥粉高劑量組橫切面主動脈管壁光鏡結構接近基礎對照組,內皮細胞扁平,表面比較平滑細胞間連接緊密。說明一定劑量的蕎麥能夠保護高脂膳食大鼠主動脈結構。
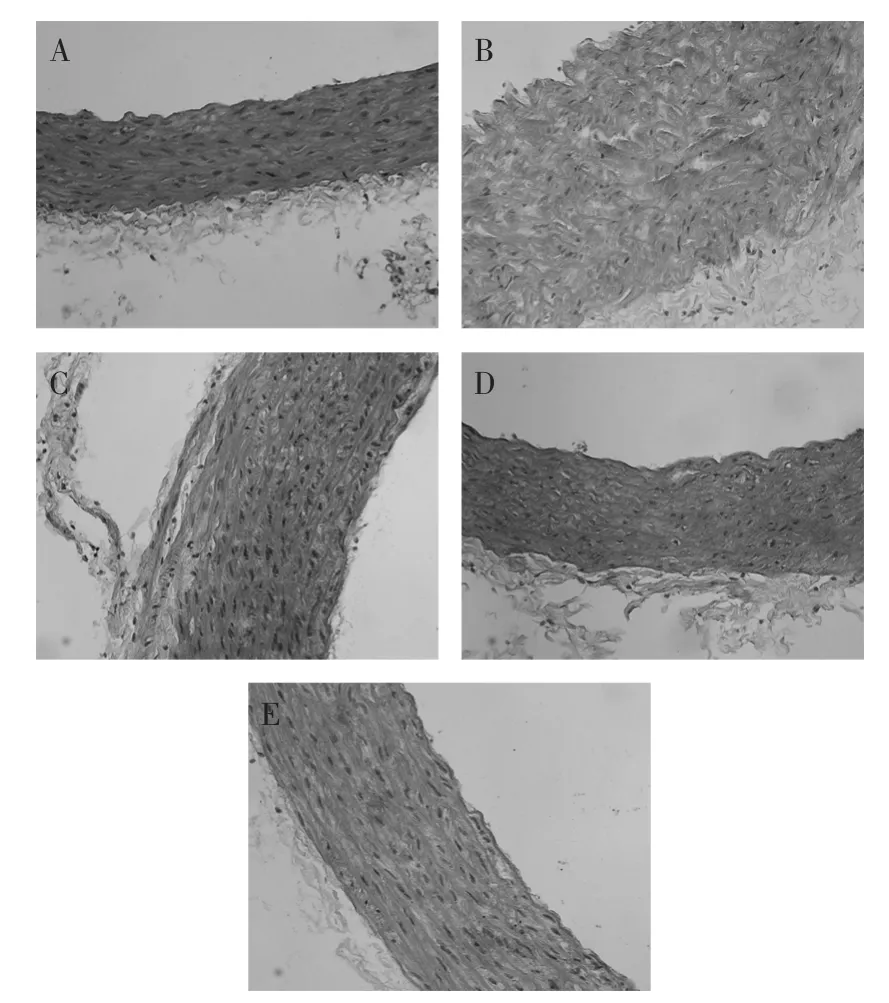
圖1 給藥30d后各組大鼠主動脈組織病理切片(200×)Fig.1 The pathological slices of aorta tissue after 30-day treatment(200×)
3 結論
本文研究了蕎麥粉對高脂膳食大鼠體內抗氧化活性的影響。將50只成年Wistar雄性大鼠隨機分為基礎對照組、高脂模型組、蕎麥粉低、中、高劑量組(1、5、10g/kg·d),腹主動脈取血,分離血清,測定SOD、GSH-PX的活性及MDA的含量和肝臟組織中SOD、MDA的含量;并觀察主動脈結構。實驗結果表明,一定劑量蕎麥粉可使高脂膳食大鼠SOD、GSH-PX活性升高,MDA含量降低,可有效清除自由基,抑制脂質過氧化,減輕肝細胞受損。用蕎麥粉干預大鼠的高脂膳食,提高機體內抗氧化能力,同時可以改善由高脂膳食引起的主動脈結構病理變化,具有保護動脈血管結構的作用。本實驗結果為疾病的預防提供可靠的理論依據,同時為醫藥和保健品的開發奠定基礎。但是關于蕎麥抗氧化的分子機制有待于進一步研究。
[1]Kou-Tai Yang,Chen Lin,Cheng-Wei Liu.Effects of chickenliver hydrolysates on lipid metabolism in a high-fat diet[J].Food Chemistry,2014,160:148-156.
[2]Lin Y L,Chang Y Y,Yang D J,et al.Beneficial effects of noni(Morinda citrifolia L.)juice on livers of high-fat dietary hamsters[J].Food Chemistry,2013,140:31-38.
[3]李龍囡.抗氧化功能因子對高脂膳食小鼠脂代謝的調節作用及其機制研究[D].無錫:江南大學,2013.
[4]何永艷,馮佰利,鄧濤,等.蕎麥提取物抗氧化活性研究[J].西北農業學報,2007,16(6):76-79,84.
[5]李勇,孔令青,高洪,等.自由基與疾病研究進展[J].動物醫學研究進展,2008,29(4):85-88.
[6]閆少芳,李勇,吳娟,等.葡萄籽提取物原花青素調節血脂作用及機理研究[J].中國食品衛生雜志,2003,15(4):302-304.
[7]Shun-Cheng Rena,Jun-Tao Sun.Changes in phenolic content,phenylalanine ammonia-lyase(PAL)activity,and antioxidant capacity of two buckwheat sprouts in relation to germination[J]. Journal of Functional Foods,2014(7):298-304.
[8]P Jiang,F Burczynski,C Campbell.Rutin and Xavonoid contents in three buckwheat species Fagopyrum esculentum,F tataricum,and F homotropicum and their protective eVects against lipid peroxidation[J].Food Research International,2007,40:356-364.
[9]Li-Yun Lina,Hsiu-Man Liub,Ya-Wen Yu.Quality and antioxidant property of buckwheat enhanced wheat bread[J]. Food Chemistry,2009,4(112):987-991.
[10]YusukeUshida, ToshiroMatsui, MitsuruTanaka. Endothelium-dependent vasorelaxation effect of rutin-free tartary buckwheat extract in isolated rat thoracic aorta[J].Nutrition Research,2003,23(6):803-814.
Effect of buckwheat on high-fat diet rat lipid metabolism
WANG Dan1,2,SHEN Nan3,YU Tian-long1,GE Hong-juan1,2,SONG Chun-mei1,2,*
(1.Department of Public and Health,Jilin Medical College,Jilin 132013,China;2.Lever Two Laboratory of Administration of Traditional Chinese Medicine of Jilin Province,Jilin 132013,China;3.Department of Functional Experimental Science in Experimental Center,Jilin Medical College,Jilin 132013,China)
The aim of this study was to point out the effect of buckwheat on antioxidant activity of hyperlipidemia rats.Fifty male Wistar hamsters were assigned randomly to the following groups:control diet,high-fat diet(HFD)and low,medium,high dosage BW(1,5,10g/kg·d)groups.The SOD,GSH-PX and MDA in serum and SOD,MDA in livers were detected after 30 days.The results showed that compared with model group,the levels of SOD,GSH-PX were increased(p<0.05),MDA was decreased(p<0.05)in serum,the buckwheat group SOD was increased(p<0.05),MDA was decreased(p<0.05)in liver of buckwheat group.Buckwheat may improve the antioxidant activity of high-fat diet-induced rats.
buckwheat(BW);high-fat diet(HFD);antioxidant activity;light microscope structure
TS218
A
1002-0306(2015)14-0370-04
10.13386/j.issn1002-0306.2015.14.068
2014-10-20
王丹(1988-),女,碩士,助理實驗師,研究方向:植物蛋白工程。
宋春梅(1964-),女,碩士,教授,研究方向:營養與慢性病。
吉林省科技發展計劃基金(201105089)。

