楊梅蛋白酶解肽抗氧化及降血糖活性的穩定性研究
張一帆,王 強,王 偉,吳莉宇,張 玉,章程輝
(1.海南大學食品學院,海南海口570228;2.浙江省農業科學院農產品質量與標準研究所,農業部農產品質量安全風險評估實驗室(杭州),浙江省食品安全重點實驗室,浙江省植物有害生物防控省部共建國家重點實驗室培育基地,浙江杭州310021)
楊梅蛋白酶解肽抗氧化及降血糖活性的穩定性研究
張一帆1,2,王強1,2,王偉2,吳莉宇2,張玉2,章程輝1,*
(1.海南大學食品學院,海南海口570228;2.浙江省農業科學院農產品質量與標準研究所,農業部農產品質量安全風險評估實驗室(杭州),浙江省食品安全重點實驗室,浙江省植物有害生物防控省部共建國家重點實驗室培育基地,浙江杭州310021)
以楊梅蛋白酶解肽為研究對象,考察其相對分子量分布范圍,并以DPPH自由基清除活性和α-葡萄糖苷酶抑制活性為指標,分別研究了溫度、pH、糖、防腐劑和金屬離子等5個因素對楊梅蛋白酶解肽抗氧化及降血糖活性的影響。結果表明,楊梅蛋白酶解肽分子量范圍在118.9~4552.2u,且楊梅蛋白酶解肽有較強的熱穩定性及耐酸性,而在堿性條件下,抗氧化活性喪失較快而降血糖活性略微上升;糖類能顯著增加其抗氧化活性,增加順序為:葡萄糖>乳糖>蔗糖;苯甲酸和NaCl對其抗氧化活性影響及苯甲酸對其降血糖活性影響都不顯著(p>0.05),而NaCl在1.5%~2%范圍內促進了降血糖活性;Cu2+和Zn2+均能降低抗氧化及降血糖活性,而Mg2+和K+對抗氧化活性影響不顯著(p>0.05),但Mg2+對降血糖活性有較小增強作用,K+影響不顯著(p>0.05)。
楊梅,楊梅蛋白酶解肽,抗氧化,降血糖,穩定性
楊梅(Myrica rubra Sieb.et Zucc)是楊梅科楊梅屬的亞熱帶多年生常綠喬木果實,水分含量87.1%~ 90.9%,總糖含量為9.1%,蛋白質含量在0.14%~0.34%[1-3]。《本草綱目》中記載:“楊梅味酸甜、性溫、無毒,能止渴、和五臟、滌腸胃、除煩潰惡氣”。目前針對楊梅功能活性的研究集中于其酚類化合物[4-5],而楊梅蛋白組分酶解肽的活性研究較為少見。生物酶解肽通常用蛋白酶解法來制備[6],其主要由大量的不同α-氨基酸和肽鍵組成,在220nm處有最大光吸收。因其特有的分子結構而極易在加工制備和貯藏過程中的不利因素影響下,發生消旋化、脫酰化、鏈裂解及重排等,而發生降解[7]。因此研究加工和貯藏過程外在因素對酶解肽穩定性的影響是十分必要的。目前已有大量酶解肽抗氧化活性的穩定性研究,Chao-Zhi Zhu等[8]研究得出金華火腿酶解肽在NaCl添加量小于6%,溫度低于60℃時具備穩定的抗氧化活性。Shiyuan Dong等[9]研究得出β-乳球蛋白酶解肽和葡萄糖發生美拉德反應后能提高DPPH自由基清除活性、總抗氧化活性和鐵離子的螯合能力。但有關蛋白酶解肽在降血糖活性穩定性方面的研究少見報道。
本文采用堿溶酸沉法提取楊梅中蛋白組分,先后采用胃蛋白酶和胰蛋白酶獲取楊梅蛋白酶解肽,并考察其相對分子量分布范圍,選用溫度、pH、糖、防腐劑和金屬離子5個影響因素,以清除DPPH自由基活性保持率和抑制α-葡萄糖苷酶活性保持率為指標,對楊梅蛋白酶解肽的抗氧化及降血糖活性的穩定性進行研究。
1 材料與方法
1.1材料與儀器
楊梅購于杭州文輝大橋水果批發市場并選用新鮮成熟的“東魁楊梅”品種;胃蛋白酶(3000U/g)、胰蛋白酶(10000U/g) 中國醫藥(集團)上海化學試劑有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,>97%)、4-硝基苯基-α-D-呋喃葡萄糖苷(PNPG,>99%)、α-葡萄糖苷酶(Intestinal acetone powders from rat)美國sigma公司;K2SO4、MgSO4、ZnSO4、CuSO4、Na2CO3、無水乙醇(≥99.7%)分析純,上海凌峰化學試劑有限公司;HCl、NaOH分析純,西隴化工股份有限公司;桿菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸德國Serva公司;細胞色素C、抑肽酶、乙氨酸-乙氨酸-乙氨酸上海源葉生物科技有限公司。
1500型全波長酶標儀美國Thermo公司;210 Plus雙光束紫外可見分光光度計德國Analylik Jena公司;pH計梅特勒-托利多儀器有限公司;MW<5ku分子量截留管Thermo Fisher Scientific公司;EZ-2真空濃縮工作站美國Genevac公司;B-260型恒溫水浴鍋上海亞榮生化儀器廠;2690高效液相色譜儀、2996二極陣列檢測器美國Waters公司。
1.2實驗方法
1.2.1楊梅粗蛋白的提取及酶解肽的制備楊梅果實→去核打漿→按料液比1∶10加入蒸餾水→調pH為10,37℃搖床4h→濃縮過濾→調pH為2→離心得楊梅粗蛋白。并準確稱取10g楊梅粗蛋白,參照錢方等[10]和龔麗芬等[11]的酶解工藝條件,按料液比1∶10加入蒸餾水→調pH為2,加5%胃蛋白酶→37℃搖床4h→調pH為8,加5%胰蛋白酶→37℃搖床4h→沸水浴10min→離心取上清液→用5ku截留管截留,濾液為實驗樣品(以下簡稱楊梅蛋白酶解肽),備用。
1.2.2楊梅蛋白酶解肽分子量的測定方法參照GB/T 22729-2008海洋魚低聚肽粉附錄A(高效凝膠過濾色譜法)[12]和陳季旺等[13]的測定方法,測定楊梅蛋白酶解肽的分子量。高效液相色譜儀:Waters 2690,檢測器:Waters 2996二極陣列檢測器;色譜柱:TSKge G2000 SWXL 300mm×7.8mm;流動相:乙腈-水-三氟乙酸(45∶55∶0.1,V/V);檢測波長:220nm;柱溫:30℃;流速:0.5mL/min。選取細胞色素C(MW=12500u)、抑肽酶(MW=6500u)、桿菌酶(MW=1450u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW=451u)、乙氨酸-乙氨酸-乙氨酸(MW=189u)為相對分子量校正曲線所用標準品,以出峰時間為橫坐標,以分子量的對數值(lg)為縱坐標做標準曲線,并測取楊梅蛋白酶解肽的分子量范圍。
1.2.3楊梅蛋白酶解肽對DPPH自由基清除活性的測定參照Xican Li等[14]的測定方法,取2mL DPPH溶液(1×10-4mol/L,用無水乙醇配制)和0.1mL不同處理后的楊梅蛋白酶解肽溶液,加入同一試管中,漩渦混勻室溫避光30min后,于517nm下測吸光值A樣品,并以等體積無水乙醇代替DPPH溶液做空白組測吸光值A空白,以等體積蒸餾水代替樣品溶液做對照組測吸光值A對照,用等體積無水乙醇和蒸餾水混合液空白調零。平行測定三次取平均值,計算處理組清除率S1。
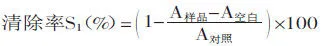
同時計算楊梅蛋白酶解肽未處理組對DPPH自由基的清除率S2,蒸餾水替代楊梅蛋白酶解肽做不同處理后對DPPH自由基的清除率S對照D,計算DPPH自由基活性保持率ηD:
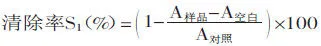
1.2.4楊梅蛋白酶解肽對α-葡萄糖苷酶抑制活性的測定參照Raju等[15]和Ashley等[16]的測定方法,取50μL不同處理后的楊梅蛋白酶解肽溶液,對照組用緩沖液代替。加入100μL 5mg/mL的α-葡糖糖苷酶溶液于37℃水浴10min后,加入50μL 5mmol/L的pNPG溶液,樣品空白組和對照空白組用緩沖液代替,于37℃水浴30min,加入50μL 0.67mol/L的Na2CO3溶液終止反應。利用酶標儀測定405nm處吸光值,計算處理組抑制率S3。

同時計算楊梅蛋白酶解肽未處理組對α-葡萄糖苷酶活性的抑制率S4,蒸餾水替代楊梅蛋白酶解肽做不同處理后對α-葡萄糖苷酶活性的抑制率S對照α,計算抑制α-葡萄糖苷酶活性保持率ηα:

1.2.5溫度對楊梅蛋白酶解肽抗氧化及降血糖活性的影響分別取楊梅蛋白酶解肽5mL,并在25、40、60、80、100℃水浴中加熱處理1h,冷卻至室溫后定容至5mL,測其對DPPH自由基清除活性和α-葡萄糖苷酶抑制活性保持率。
1.2.6pH對楊梅蛋白酶解肽抗氧化及降血糖活性的影響用1mol/L的HCl和NaOH將楊梅蛋白酶解肽分別調pH至3~10,室溫靜置1h,同時用蒸餾水替代樣品做對照。然后再將各組pH調回至7,測對DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.7不同糖對楊梅蛋白酶解肽抗氧化及降血糖活性的影響用楊梅蛋白酶解肽分別配制不同質量分數(2%、4%、6%、8%、10%)的葡萄糖、蔗糖和乳糖溶液,同時用蒸餾水替代樣品做對照。將處理好的楊梅蛋白酶解肽溶液在100℃加熱處理60min后,快速冷卻至25℃,測DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.8防腐劑對楊梅蛋白酶解肽抗氧化及降血糖活性的影響用楊梅蛋白酶解肽分別配制不同質量分數(0.004%、0.008%、0.012%、0.016%和0.020%)的苯甲酸溶液和(0.5%、1.0%、1.5%和2.0%)NaCl溶液,同時用蒸餾水替代樣品做對照。室溫靜置1h后,測DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.2.9不同金屬離子對楊梅蛋白酶解肽抗氧化及降血糖活性的影響用楊梅蛋白酶解肽分別配制不同濃度(1、2、3、4、5mmol/L)的K2SO4、MgSO4、ZnSO4和CuSO4溶液,同時用蒸餾水替代樣品做對照。靜置2h后,測DPPH自由基清除活性和α-葡萄糖苷酶抑制活性的保持率。
1.3數據統計
所有實驗數據均進行三次重復,實驗結果以平均值±標準偏差(SD)表示。實驗結果采用SPSS 16.0軟件分析,通過One-way ANOVA檢驗中的鄧肯多重范圍檢驗來比較其組間差異顯著性,顯著性水平設置為p<0.05。
2 結果與分析
2.1楊梅蛋白酶解肽的相對分子量分布
5種標準樣品的相對分子量分布液相色譜圖如圖1所示,以出峰時間為橫坐標,以分子量的對數值(lg)為縱坐標做標準曲線如圖2,得標準曲線方程為Y=-0.1804X+6.9425,R2=0.9442,并測得楊梅蛋白酶解肽的分子量分布范圍為118.9~4552.2u。

圖1 5種標準樣品的相對分子量分布液相色譜圖Fig.1 The HPLC of relative molecular mass distribution of five standard sample
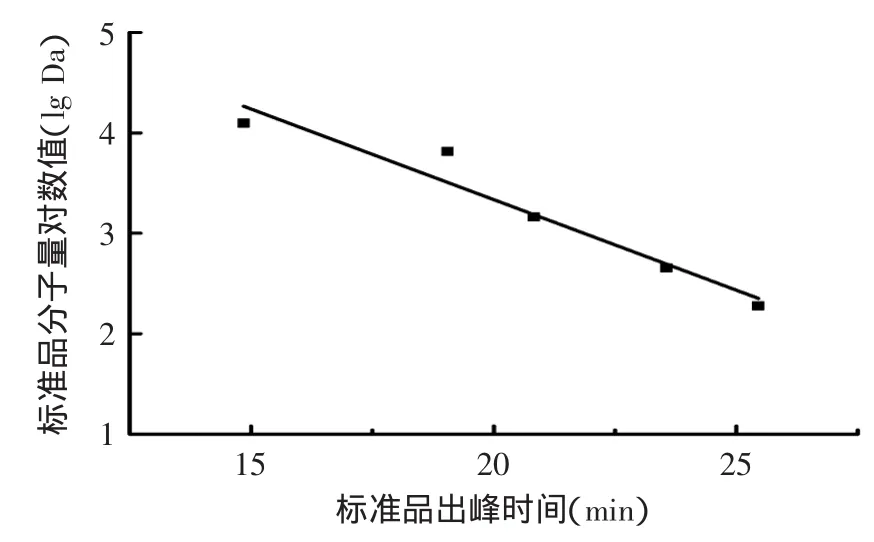
圖2 相對分子量標準曲線Fig.2 The standard curve of relative molecular mass
2.2溫度對楊梅蛋白酶解肽抗氧化及降血糖活性的影響
由圖3所示,在25~100℃范圍內,溫度對楊梅蛋白酶解肽的抗氧化及降血糖活性影響均不顯著(p>0.05),活性保持率都基本維持在100%左右,表明楊梅蛋白酶解肽有較強的熱穩定性。
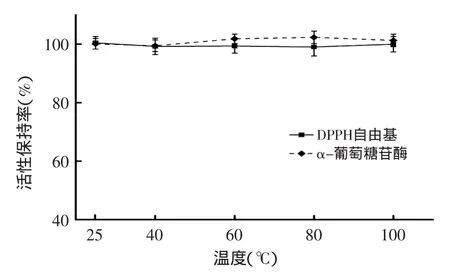
圖3 溫度對楊梅蛋白酶解肽抗氧化及降血糖活性的影響Fig.3 The influence of temperature on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.3pH對楊梅蛋白酶解肽抗氧化及降血糖活性的影響
如圖4所示,楊梅蛋白酶解肽隨著pH的升高,清除DPPH自由基活性保持率總體呈現出先升后降的趨勢,在pH3~5的酸性環境中,楊梅蛋白酶解肽可能部分變性導致抗氧化活性降低,但酸性環境為水解后肽段提供了大量氫供體,使得楊梅蛋白酶解肽DPPH自由基清除活性保持率仍在95%以上;在pH6~7時,DPPH自由基清除能力最強;當隨著pH的繼續升高,堿性條件使得楊梅蛋白酶解肽上的氨基等酸性基團解離出質子[17],與環境中羥基結合生成水,從而減少了提供氫供體能力,使得DPPH自由基清除活性保持率呈下降趨勢。游麗君等[18]還認為這與堿性條件下楊梅蛋白酶解肽發生脫酰胺和消旋等作用有關,當pH=10時,DPPH自由基清除活性保持率為88%。而楊梅蛋白酶解肽隨著pH的升高,對α-葡萄糖苷酶活性抑制能力呈現出先穩定后上升的趨勢,可以看出當pH>7時,楊梅蛋白酶解肽在堿性條件下,肽鏈末端的α-氨基和其他側鏈基團發生解離,使得蛋白質帶負電,從而具備更優的抑制α-葡萄糖苷酶活性抑制能力[19]。

圖4 pH對楊梅蛋白酶解肽抗氧化及降血糖活性的影響Fig.4 The influence of pH values on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.4不同糖對楊梅蛋白酶解肽的抗氧化及降血糖活性影響
如圖5所示,三種糖均對楊梅蛋白酶解肽清除DPPH自由基能力有所加強,加強順序為葡萄糖>乳糖>蔗糖,且2%~10%濃度范圍內,不同糖對抗氧化活性保持率影響差異顯著(p<0.05),當葡萄糖、乳糖和蔗糖濃度達到10%時,DPPH自由基清除活性保持率分別達到空白樣品的1.34、1.30和1.09倍,這一結果與楊梅蛋白酶解肽和糖發生美拉德反應密切相關,羰氨反應消耗楊梅蛋白酶解肽上的氨基,使得大量H+處于游離態,增加了自由基的氫供體,還有一系列中間體還原酮的生成,也提高了對DPPH自由基的捕獲,從而增加了楊梅蛋白酶解肽的抗氧化活性[20]。在清除DPPH自由基能力中,葡萄糖>乳糖>蔗糖的影響結果也符合糖類影響美拉德反應速度的規律,即單糖>雙糖,還原性糖>非還原性糖。
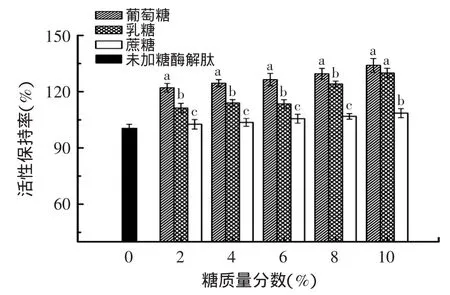
圖5 不同糖對楊梅蛋白酶解肽抗氧化活性的影響Fig.5 The influence of different saccharides on antioxidant activity of Myrica rubra peptide
圖6表示了楊梅蛋白酶解肽經葡萄糖和蔗糖處理,及葡萄糖和蔗糖本底溶液對α-葡萄糖苷酶抑制率的比較。可以看出在降血糖反應體系中:
對硝基苯-α-D-葡萄糖苷(PNPG)α-葡萄糖苷——→酶對硝基苯酚(PNP)+葡萄糖
楊梅蛋白酶解肽經葡萄糖和蔗糖(水解產生葡萄糖)的處理,增加了反應產物的量,抑制了上述反應體系的進行,導致對硝基苯酚(PNP)的量減少,從而使得吸光值降低,表現出了葡萄糖和蔗糖本底溶液的降血糖活性。因此,這并不能直觀表現出葡萄糖和蔗糖對楊梅蛋白酶解肽降血糖活性的影響;而楊梅蛋白酶解肽中乳糖的添加對α-葡萄糖苷酶活性抑制能力并未有顯著影響,隨著濃度的升高,抑制率保持在57.2%~59.8%,而乳糖本底溶液未體現出降血糖活性。
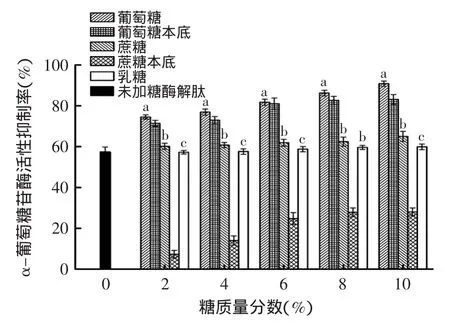
圖6 不同糖對楊梅蛋白酶解肽降血糖活性的影響Fig.6 The influence of different saccharides on hypoglycemic activity of Myrica rubra peptide
2.5防腐劑對楊梅蛋白酶解肽的抗氧化及降血糖活性影響
NaCl和苯甲酸對楊梅蛋白酶解肽的抗氧化及降血糖活性影響分別如圖7和圖8所示,可以看出,隨著NaCl和苯甲酸濃度的升高,對DPPH自由基的清除能力都無顯著性差異(p>0.05)。但當NaCl濃度大于1.5%時,楊梅蛋白酶解肽對抑制α-葡萄糖苷酶活性保持率略微升高,且各濃度苯甲酸的添加對α-葡萄糖苷酶活性抑制能力影響不顯著(p>0.05),而NaCl對人體安全無毒、代謝無殘留,因此,在楊梅蛋白酶解肽的儲藏運輸中,加入低劑量的NaCl作為防腐劑是可行的。

圖7 NaCl對楊梅蛋白酶解肽抗氧化及降血糖活性的影響Fig.7 The influence of NaCl on antioxidant and hypoglycemic activity of Myrica rubra peptide

圖8 苯甲酸對楊梅蛋白酶解肽抗氧化及降血糖活性的影響Fig.8 The influence of benzoic acid on antioxidant and hypoglycemic activity of Myrica rubra peptide
2.6不同金屬離子對楊梅蛋白酶解肽抗氧化及降血糖活性的影響
如圖9、圖10所示,不同金屬離子對楊梅蛋白酶解肽抗氧化及降血糖的活性影響均有不同,對清除DPPH自由基的活性保持率和α-葡萄糖苷酶抑制活性保持率由高到低都依次為Mg2+>K+>Zn2+>Cu2+。就清除DPPH自由基的活性而言,隨著Mg2+和K+濃度的升高,活性保持率趨于平穩,分別達到98.1%和97.1%以上;而Zn2+和Cu2+對活性保持率有明顯降低趨勢,當濃度達到5mmol/L時,Zn2+和Cu2+使楊梅蛋白酶解肽清除DPPH自由基的活性保持率下降至80.9%和78.7%。
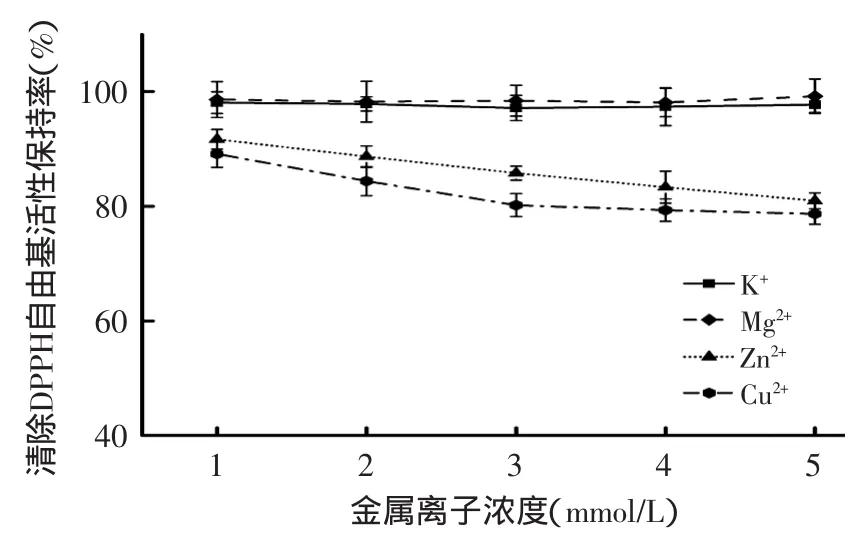
圖9 金屬離子對楊梅蛋白酶解肽抗氧化活性的影響Fig.9 The influence of different metal ions on antioxidant activity of Myrica rubra peptide
而對α-葡萄糖苷酶抑制活性保持率而言,隨著金屬離子濃度的升高,K+對其影響均不顯著,而Mg2+的添加使得活性保持率略微上升,這表明楊梅蛋白酶解肽與Mg2+可能發生螯合作用,Mg2+起到橋梁作用,增加了對α-葡萄糖苷酶的結合位點,使得活性保持率有較小的增強作用[21]。但隨其濃度升高會對人體產生危害作用,因此其安全劑量還需進一步考慮;而Zn2+和Cu2+對α-葡萄糖苷酶抑制活性明顯降低,并具有顯著性差異(p<0.05),當Zn2+和Cu2+添加濃度為5mmol/L時,活性保持率分別降至86.4%和68.0%,這與Zn2+和Cu2+使楊梅蛋白酶解肽的非極性共價鍵發生破壞密切相關,進一步導致溶解度降低、疏水基團外露等理化性質改變,從而使其生物學活性下降。綜上表明,楊梅蛋白酶解肽在加工和保存過程中盡量不要用鋅、銅等材料制作的容器,以免喪失生物活性和對人體產生毒害作用。
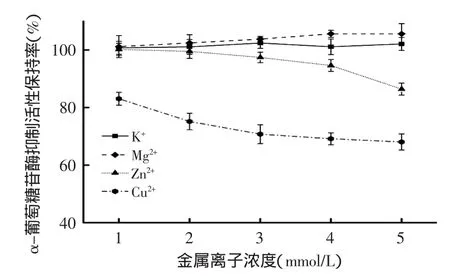
圖10 金屬離子對楊梅蛋白酶解肽降血糖活性的影響Fig.10 The influence of different metal ions on hypoglycemic activity of Myrica rubra peptide
3 結論
楊梅蛋白酶解肽分子量范圍在118.9~4552.2u,其抗氧化及降血糖活性有良好的耐熱性和耐酸性,而在堿性條件下,抗氧化活性喪失較快而降血糖活性略微上升。葡萄糖、乳糖、蔗糖均能增強楊梅蛋白酶解肽的抗氧化活性且增強程度依次為葡萄糖>乳糖>蔗糖,而葡萄糖和蔗糖并不能直觀描述出對楊梅蛋白酶解肽降血糖活性的影響,但乳糖對楊梅蛋白酶解肽降血糖活性影響不明顯。苯甲酸和NaCl對楊梅蛋白酶解肽抗氧化活性影響都不顯著,低劑量NaCl能促進降血糖活性,因此推薦使用低劑量NaCl作為防腐劑;Zn2+和Cu2+均能降低楊梅蛋白酶解肽的抗氧化及降血糖活性,Mg2+和K+對抗氧化活性影響不顯著,Mg2+對降血糖活性有較小增強作用,K+無明顯影響。因此,在加工和保存過程中盡量不要使用Cu2+、Zn2+等材料制作的器皿。本實驗主要探索研究了通過胃蛋白酶和胰蛋白酶酶解楊梅蛋白制備所得的楊梅蛋白酶解肽,但不同的酶對蛋白質的酶切位點不同,可能導致所得多肽含量和組成也會不同,也會影響其活性的測定,因此在后續研究中,楊梅蛋白在不同酶的酶解條件下的活性測定有待深入研究。
[1]吳亞梅,陳健,李維鋒,等.楊梅的綜合研究與利用[J].食品科技,2007,10:75-78.
[2]張澤煌,鐘秋珍,林旗華.楊梅果實氨基酸組成及營養評價[J].熱帶作物學報,2012,33(12):2279-2283.
[3]龔潔強,王允鑌,林媚,等.楊梅果實品質與營養成分分析[J].浙江柑橘,2004,21(1):31-32.
[4]孔令明,李芳,陶永霞,等.多肽的功能活性與研究進展[J].中國食品添加劑,2009(3):71-73.
[5]Sun C,Zheng Y,Chen Q.Purification and anti-tumour activity of cyanidin-3-O-glucoside from Chinese bayberry fruit[J].Food Chemistry,2012,131(4):1287-1294.
[6]KARL E M,OANH H,REIDAR B.C-Methylated Dihydrochalcones from Myrica gale:Effectsas antioxidiants and as scavengers of l,l-DiPhenyl-2-Pricrylhydrazyl[J].Pharmacologyand Toxicology,1996,78(2):111-116.
[7]于志鵬,趙文竹,于一丁,等.蛋清蛋白質降壓肽的化學及酶穩定性研究[J].食品科學,2010,31(9):23-26.
[8]Zhu C Z,Zhang W G,Kang Z L,et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science,2014,96:783-789.
[9]Dong S Y,Panya A,Zeng M Y,et al.Characteristics and antioxidantactivityofhydrolyzedβ-lactoglobulin-glucose Maillard reaction products[J].Food Research International,2012,46:55-61.
[10]錢方,鄧巖,劉陽,等.胃蛋白酶水解大豆蛋白的研究[J].中國乳品工業,2001,29(3):10-13.
[11]龔麗芬,鄭志福,陳碧娥.胰蛋白酶酶解文蛤的工藝條件[J].氨基酸和生物資源,2003,25(2):45-47.
[12]中國食品發酵工業研究院.GB/T 22729-2008海洋魚低聚肽粉[S].2008.
[13]陳季旺,孫勤,夏文水.魚降壓肽的大孔吸附樹脂脫鹽及理化性質[J].2009,30(24):158-162.
[14]Li X C,Lin J,Gao Y X,et al.Antioxidant activity and mechanism of Rhizoma Cimicifugae[J].Chemistry Central Journal,2012,6(1):140.
[15]Raju B C,Tiwari A K,Kumar J A,et al.a-Glucosidase inhibitory antihyperglycemic activity of substituted chromenone derivatives[J].Bioorganic&Medicinal Chemistry,2010,18:359-365.
[16]Ashley S B,Derek S,Gordon J M.Berry components inhibit a-glucosidase in vitro:Synergies between acarbose and polyphenols from black currant and rowanberry[J].Food Chemistry,2012,135:929-936.
[17]沈同.生物化學[M].北京:高等教育出版社,1991:163-175.
[18]游麗君,趙謀明,Regenstein J,等.加工和貯藏條件對泥鰍多肽抗氧化活性的影響[J].江蘇大學學報,2011,41(2):579-583.
[19]楊志敏,蔣立科.生物化學[M].北京:高等教育出版社,2005:156-166.
[20]Liu P,Huang M,Song S,et al.Sensory characteristics and antioxidant activities of maillard reaction products from soy protein hydrolysates with different molecular weight distribution[J].Food Bioprocess Technol,2012,5:1775-1789.
[21]王子懷,胡曉,李來好,等.肽-金屬離子螯合物的研究進展[J].食品工業科技,2014,35(8):359-362.
Study on antioxidant and hypoglycemic activity stability from Myrica rubra peptide
ZHANG Yi-fan1,2,WANG Qiang1,2,WANG Wei2,WU Li-yu2,ZHANG Yu2,ZHANG Cheng-hui1,*
(1.College of Food Science and Technology,Hainan University,Haikou 570228,China;2.Institute of Quality and Standard for Agriculture Products,Zhejiang Academy of Agricultural ScienceLaboratory for Risk Assessment of Agricultural Product Quality and Safety,Ministry of Agriculture,Zhejiang Key Laboratory of Food Safety,State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control,Hangzhou 310021,China)
The stability of antioxidant and hypoglycemic activity from Myrica rubra peptide were determined with the effects of temperature,pH,saccharides,antiseptics and metal ions on the DPPH radicals scavenging activity and α-glucosidase inhibition activity assessed,but also investigated its relative molecular mass distribution.The result showed that the relative molecular mass distribution of Myrica rubra peptide range from 118.9~4552.2u with an excellent heat-resistant and heat-resistant ability.But antioxidant activity lost and hypoglycemic activity rose slightly in the alkali environment.Saccharides could increase the antioxidant activity significantly in the order of glucose>lactose>sucrose.Both benzoic acid and NaCl had no effects on antioxidant activity.Benzoic acid had no significant effects on hypoglycemic activity(p>0.05),but NaCl improved the hypoglycemic activity from 1.5%to 2%.Both Cu2+and Zn2+reduced the antioxidant and hypoglycemic activity.Mg2+and K+had no significant effects on antioxidant activity(p>0.05),but hypoglycemic activity was slightly enhanced by Mg2+and K+had no significant effects on hypoglycemic activity(p>0.05).
Myrica rubra;peptide;antioxidant;hypoglycemic;stability
TS255.1
A
1002-0306(2015)14-0086-06
10.13386/j.issn1002-0306.2015.14.008
2014-10-20
張一帆(1989-),男,在讀碩士研究生,研究方向:功能性食品。
章程輝(1967-),男,博士,研究員,研究方向:熱帶農產品質量安全與無損檢測技術研究。
農業部農產品質量安全風險評估實驗室(杭州)開放課題;國家自然科學基金青年科學基金(31101390);浙江省自然科學基金(LY13C200015)。

