熱應激誘導雄性大鼠生殖功能改變的實驗觀察*
高俊濤 萬 朋 王春艷 謝 維
吉林醫藥學院生理學教研室(吉林 132013)
熱應激誘導雄性大鼠生殖功能改變的實驗觀察*
高俊濤**萬 朋 王春艷 謝 維
吉林醫藥學院生理學教研室(吉林 132013)
目的 觀察熱應激誘導雄性大鼠生殖功能的改變,并初步探討其生理機制。方法 清潔級Wistar大鼠64只,隨機分成4組,即正常對照組及環境溫度分別為38℃、40℃、42℃的3組熱應激組,將大鼠暴露于高溫環境1h/d,連續14d。分別于高溫暴露后7d 和14d進行大鼠性行為能力的觀察,包括撲捉潛伏期(capture incubation period,CIP)、撲捉次數(capture times,CT)、精子相對計數、精子畸形率;血清與睪丸組織中超氧化物歧化酶(SOD)和丙二醛(MDA)等指標的檢測。結果 與正常對照組比較,42℃高溫暴露7d,14d以及40℃高溫暴露14d后大鼠的撲捉潛伏期顯著延長,撲捉次數顯著減少(P<0.05);精子相對計數明顯減少(P<0.05);精子畸形率明顯增加(P<0.05);血清和睪丸組織中SOD的活性顯著降低(P<0.05),MDA的含量顯著增加(P<0.05);38℃熱應激組上述各項指標與正常對照組相比均未見明顯變化。結論 高溫環境暴露后,產生的熱應激可改變雄性大鼠的生殖功能,其作用機制可能與生殖細胞的氧化損傷有關。
熱應激; 生殖細胞; 氧化性應激
高溫環境導致人體體溫調節中樞功能紊亂,體核溫度升高,并由此引起循環系統與中樞神經系統功能障礙,表現為高體溫、譫妄、驚厥或昏迷[1]。機體處于高溫環境,機體體溫調節失敗,最終機體出現動脈血壓降低,氧分壓降低,如無法得到及時搶救將導致血壓迅速下降,機體各器官缺血缺氧,直至死亡。高溫環境對人類健康和生殖功能產生危害,當前各國生殖健康的狀況相當嚴峻,高溫對睪丸組織會產生損害,精子對高溫環境特別敏感,使男性生殖能力下降,甚至導致不孕不育癥。以往的研究表明,熱應激與雄性生殖功能存在密切的聯系,熱應激導致精子發育異常[2],熱應激誘導蛋白-1在雄性生殖系統的表達[3],熱應激引起的代謝改變與雄性生殖功能具有密切聯系[4],因此,本實驗采用不同溫度的熱應激動物模型,在大鼠的生精期內,選取不同的時間點,分別從大鼠性行為能力和血清及組織中氧化應激水平等方面來研究不同溫度對雄性大鼠生殖系統的時間毒性,探討熱應激引起雄性大鼠生殖功能的改變及其機制,為高溫環境對生殖系統的影響提供理論依據。
材料與方法
一、實驗動物分組
選擇清潔級Wistar大鼠(吉林大學白求恩醫學部實驗動物中心)64只,雄性,體質量(180±20)g,適應性飼養1周,室溫(22±2)℃,相對濕度40%~60%,由吉林大學動物實驗中心提供。實驗動物隨機分為4個組,即正常對照組和熱倉內溫度38℃、40℃、42℃的3個熱應激組,分別設為低、中、高溫度組,每組16只。
二、儀器與試劑
DKB-501S型超級恒溫水浴(上海精宏實驗設備有限公司),Hitachi 7600生化分析儀(日本Tokyo公司),多通道生理記錄儀(美國BiopacMP150);ZMN-7803型全自動組織包埋機(常州市華利電子有限公司),RM2126型輪轉式切片機(上海徠卡儀器有限公司),BA300型數碼生物顯微鏡(中國麥克奧迪實業集團有限公司),酶標儀(SUNRISE),TD5A 型臺式低速離心機(湖南凱達科學儀器有限公司);SOD和MDA檢測試劑盒均購置于南京建成生物技術研究所(批號:20150625)。
三、大鼠熱應激模型制備
使用超級恒溫水浴,連接有機玻璃夾層水循環艙,保持室溫為23.0~24.0℃,控制水溫,保持熱循環艙實測溫度為38℃、40℃、42℃,相對濕度40%~60%,風速0~0.2m/s,穩定l h以上。將大鼠置于大小合適固定器中,放入溫度分別為38℃、40℃、42℃熱倉內,1h/d,連續14d,實時監測熱倉內溫度,使倉內溫度保持穩定,控制入倉時間,對照組除不接受熱應激外,其它處理與熱應激組相同。
四、相關指標的檢測
(一)性行為能力的觀察
分別于熱應激7d和14d,參照Agmo[5]方法進行,在安靜的室內分別將每組的每只雄性大鼠放置于50cm×35cm×20cm的干凈的大鼠籠中適應5min,隨后投入到同批飼養的正常雌性大鼠形成1對1的配對,觀察30min。觀察放置雌性大鼠后,雄性大鼠的第一次撲捉時間即撲捉潛伏期,同時觀察雄性大鼠在30min內對雌性大鼠的撲捉次數。
(二)精子相對計數測定
分別于熱應激7d和14d后,大鼠脫椎處死后,取出雙側附睪,在盛有2mL生理鹽水(提前預熱至37℃)的潔凈培養皿中進行剝離術,使儲存在附睪中的精子游離出來。剝離好的附睪放置于37℃的恒溫箱中孵育15~20min,取出過濾(4層濾紙)至EP試管。用移液槍取出100μL的精液,加入3%100μL的NaCl溶液中固定,輕輕混勻后取適量滴加至紅細胞計數板中,在顯微鏡下計數精子數。計數原則:對于壓線精子,只計數精子頭,數上不數下,數左不數右。視精子密度而定,若精子密度高,則取1滴精液涂片即可。涂好的涂片自然風干,待其干燥后,加入適量甲醇固定,待其干燥后,置于2%的伊紅染液中染色1h,染好后取出,以細小流水輕輕沖洗,自然干燥后即可在顯微鏡下觀察。在低倍顯微鏡下找到背景清晰精子重疊較少的部位。用高倍顯微鏡順序檢查精子形態,每只大鼠檢查完整的精子500條。
(三)血清和睪丸組織SOD和MDA檢測
分別于熱應激的7d和14d后,經大鼠腹主動脈取血,將血液置于肝素處理過的冰浴試管內,將睪丸組織切碎勻漿,分別置于3 000×g的離心機內離心30min,分別取血清和上清液,進行氧化損傷指標的檢測,SOD和MDA試劑盒均購置于南京建成生物技術研究所,嚴格按照相應試劑盒說明進行操作。
(四)數據處理和統計學分析
結 果
一、熱應激對雄性大鼠性行為的影響
正常雄性大鼠放置于雌性大鼠后(29.37±3.65)s開始撲捉,在30 min內撲捉雌鼠的次數可達(41.28±5.16)次;42℃熱應激7d后,雄性大鼠表現為少動,撲捉潛伏期明顯延長至(40.20±5.31)s,在30 min內撲捉的次數也顯著減少至(29.38±3.81)次,與正常對照組比差異異均具統計學意義(P<0.05);42℃熱應激14d后大鼠的撲捉潛伏期顯著延長、撲捉次數顯著減少,與正常對照組比差異異均具統計學意義(P<0.05),(見表1)。
二、熱應激對雄性大鼠精子質量的影響
分別于熱暴露的7d和14d后,取出雙側附睪,觀察熱應激組大鼠與正常對照組大鼠的精子數量及精子的致畸率變化,結果顯示,高溫度組7d、14d后和中溫度組14d后精子相對計數明顯減少,精子畸形率明顯增加(P<0.05),差異均具統計學意義。(見表2)。

表1 熱應激7 d和14 d后對雄性大鼠性行為的影響(n=8)

表2 熱應激7 d和14 d后對雄性大鼠精子質量的影響(n=8)
三、熱應激對雄性大鼠組織和血清中SOD活性和MDA含量的影響
分別于熱應激的7d和14d后,經大鼠腹主動脈取血并收集血清,將睪丸組織切碎勻漿取上清液,取待測樣本嚴格按照試劑盒說明進行操作,高溫組7d、14d后和中溫度組14d后與正常對照組相比,血清和睪丸組織中SOD的活性顯著降低(見圖1),血清和睪丸組織中MDA的含量顯著增加(P<0.05),差異均具統計學意義(見圖2)。
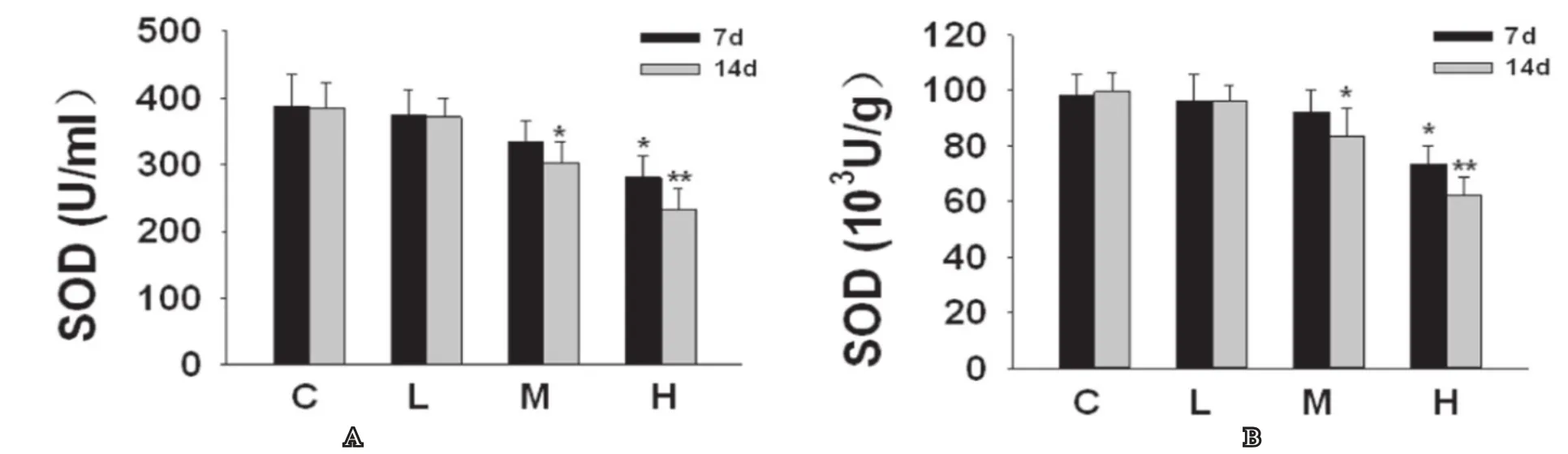
圖1 熱應激后7d和14d對大鼠血清和睪丸組織中的SOD活性的影響圖2A為熱應激后7d和14大鼠血清中SOD活性的變化;圖1B為熱應激后7d和14d大鼠睪丸組織中SOD活性的變化;C:正常對照組,L:低溫度組,M:中溫度組,H:高溫度組;與正常對照組相比較,*:P<0.05, **:P<0.01
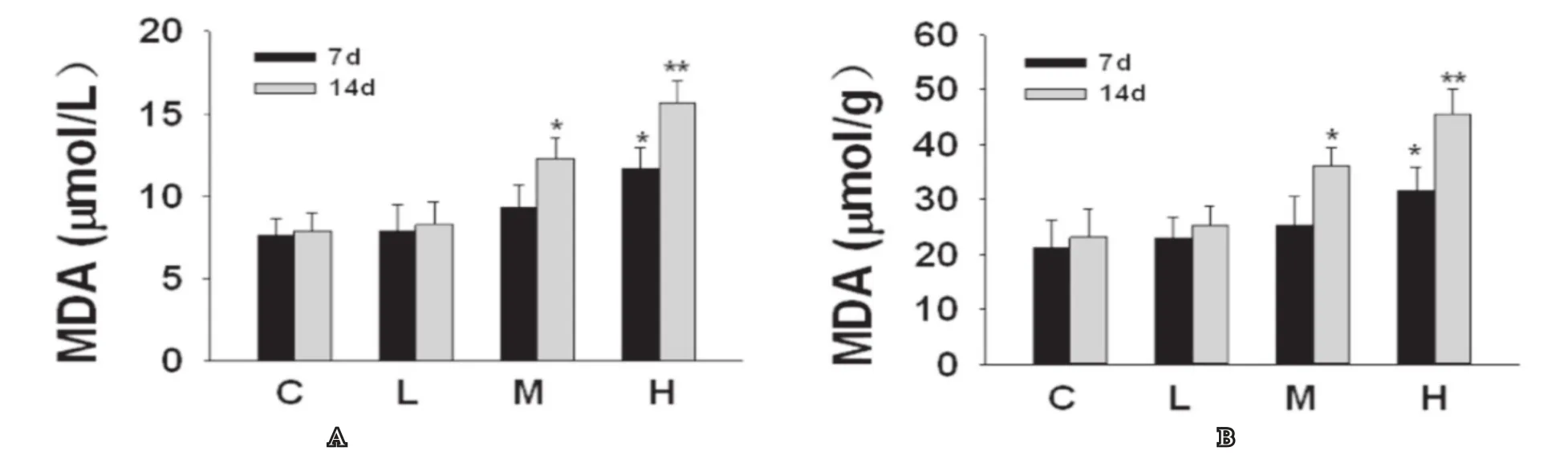
圖2 熱應激后7d和14d對大鼠血清和睪丸組織中的MDA含量的影響圖2A為熱應激后7d和14d大鼠血清中MDA含量的變化,圖2B為熱應激后7d和14d大鼠睪丸組織中MDA含量的變化;C:正常對照組,L:低溫度組,M:中溫度組,H:高溫度組; 與正常對照組相比較,*:P<0.05, **:P<0.01
討 論
雄性生殖系統對溫度變化敏感,熱應激對雄性生殖系統產生不良的影響,由于睪丸中血管相對缺乏,血流不暢,散熱困難,所以易出現過熱而造成睪丸損傷。研究表明,短時間的熱應激可引起雄性大鼠可逆性的睪丸損傷[6]。本研究表明,持續高溫環境可引起精子活力下降,存活率降低,畸形率增加等。有研究表明熱應激能夠引起代謝改變,從而影響雄性生殖系統[4]。熱應激過程中睪丸和生精細胞產生過氧化物、一氧化氮等活性氧族(ROS)和活性氮族物質(RNS)[7],它們與精子的生理功能有關。當ROS的產生超過生殖系統抗氧化系統的清除能力時,精子受活性氧的過氧化傷害則會對精子產生毒性作用,引起精子膜脂質過氧化,導致其形態、功能及代謝異常,甚至導致雄性不育。丙二醛(MDA)是過氧化脂質的分解產物,通過MDA的測定可反應體內自由基產生的程度。超氧化物歧化酶(SOD)是細胞中主要的抗氧化酶之一,它在機體清除氧自由基(ROS)的過程中起著關鍵作用。本實驗結果表明,本研究分別在熱應激的第7天和第14天,進行了大鼠的性行為觀察,并完成了精子相對計數和精子畸形率的分析,同時測定了睪丸組織和血清中SOD的活性以及MDA的含量,實驗結果提示,高溫環境暴露的過程中熱應激可以隨時間和強度聚集,導致精子的相對數量減少而精子的畸形率增加,熱應激模型組大鼠血清和睪丸組織內MDA含量均較正常對照組高,而熱應激模型組大鼠血清和睪丸組織內SOD水平顯著下降。這些結果提示,熱應激對雄性大鼠生殖系統的影響,其作用機制可能與生殖細胞的氧化損傷有關。
1 Bouchama A, Knochel JP, Heat stroke. N Engl J Med 2002; 346 (25): 1978-1988
2 Kurowicka B, Dietrich GJ, Kotwica G. Effect of neonatal or adult heat acclimation on testicular and epididymal morphometry and sperm production in rats. Reprod Biol 2015; 15(1): 1-8
3 Wang Y, Jin S, Li N, et al. Systematic study of stressinducible protein 1 (Stip1) in male reproductive system and its expression during stress response. Gene 2015;554(1): 58-63
4 Hou Y, Wang X, Lei Z, et al. Heat-stress-induced metabolic changes and altered male reproductive function. J Proteome Res 2015; 14(3): 1495-1503
5 Agmo A. Male rat sexual behavior. Brain Res Brain Res Protoc 1997; 1(2): 203-209
6 Tenorio BM, Ferreira Filho MB, Jimenez GC, et al. Extremely low-frequency magnetic fields can impair spermatogenesis recovery after reversible testicular damage induced by heat. Electromagn Biol Med 2014;33(2): 139-146
7 Pino JA, Osses N, Oyarzún D, et al. Differential effects of temperature on reactive oxygen/nitrogen species production in rat pachytene spermatocytes and round spermatids. Reproduction 2013; 145(2): 203-212
(2015-08-28收稿)
Heat-stress-induced male reproductive function changes in rats*
Gao Juntao**, Wan Peng, Wang Chunyan, Xie Wei
Department of Physiology, Jilin Medical College, Jilin 132013, China
Corresponding author: Gao Juntao, E-mail: 15948628662@163.com
Objective To investigate the heat-stress-induced male reproductive function changes in rats and exploreits mechanism. Methods Total of 64 male wistar rats with clean degree were randomly divided into the control group and the heat stress groups with 38℃, 40℃, 42℃. Heat exposure (1h/d) lasted for 14 d. Sex ability of rats was assessed including the capture incubation period (CIP) and the capture time (CT). After heat exposure, the number of sperm count and sperm deformity, the superoxide dismutase (SOD), and malondialdehyde (MDA) were detected. Results Under 42℃ heat exposure, capture incubation period (CIP) of rat was prolonged and the capture time (CT) was reduced signifi cantly (P<0.05)on 7d, 14d and under 40℃ heat exposure on 14d. Under 42℃ heat exposure, relative sperm count and the activity of SOD in serum and testicular tissue were decreased signifi cantly (P<0.05), whereas sperm malformation rate and the content of MDA in serum and testicular tissue were increased signifi cantly (P<0.05) on 7d, 14d and under 40℃ heat exposure on 14d.. All the above-mentioned indexes had no signifi cant changes compared with those of the control group. Conclusion Heat stress can affect male reproductive system, and its mechanism may be related to the oxidative damage of germ cells.
heat; germ cells; oxidative stress
10.3969/j.issn.1008-0848.2015.11.004
R 691.6
資助: 國家自然科學基金(31071042); 吉林省衛生廳科學技術研究項目(2012Z066)
**通訊作者: E-mail: 15948628662@163.com

