從第17屆世界地震工程大會看橋梁抗震研究的近期進(jìn)展
李紅旭,黃勇,郭恩棟
(1.中國地震局工程力學(xué)研究所地震工程與工程振動重點實驗室,黑龍江 哈爾濱 150080;2.地震災(zāi)害防治應(yīng)急管理部重點實驗室,黑龍江 哈爾濱 150080)
引言
第17屆世界地震工程大會(The 17th World Conference on Earthquake Engineering,17WCEE),于2021年9月27日至10月2日,在日本仙臺召開,是繼第2屆(1960年)和第9屆(1988年)之后,第3次在日本舉辦,會議使用語言為英語。世界地震工程大會,每四年舉辦一次,受全球范圍內(nèi)新冠肺炎疫情的影響,原定于2020年召開的17WCEE推遲了1年舉辦,并采用線下和線上混合的形式,開展了現(xiàn)場報告、遠(yuǎn)程報告和錄像報告。17WCEE的主題是:“走向抗災(zāi)韌性社會(Towards Disaster Resilient Society)”。17WCEE參會文章共有約3 000篇,比上屆多出近900篇,參會人員包括來自70多個國家和地區(qū)的地震工程界人士,參會注冊人數(shù)超過3 000人。世界地震工程大會,是全世界范圍內(nèi)地震工程領(lǐng)域最高層次的國際學(xué)術(shù)會議,旨在展示和交流地震工程領(lǐng)域?qū)W術(shù)研究的最新成果,參會文章可以在一定程度上反映當(dāng)前地震工程領(lǐng)域的最新研究進(jìn)展情況。
黃勇等[1]針對第16屆世界地震工程大會(16WCEE)中關(guān)于橋梁抗震研究的文章,進(jìn)行了分類整理,并提出了一些體會。文中將結(jié)合黃勇等[1]的研究方法,針對17WCEE中關(guān)于橋梁抗震研究的文章,進(jìn)行分類并與16WCEE文章的數(shù)量規(guī)模進(jìn)行對比研究,還將介紹17WCEE中關(guān)于橋梁抗震研究文章的主要內(nèi)容,以探討橋梁抗震領(lǐng)域近期的研究進(jìn)展,進(jìn)而探究橋梁抗震研究未來發(fā)展的熱點方向。
1 橋梁抗震文章統(tǒng)計
17WCEE的報告形式包括:口頭報告和張貼報告。在17WCEE中,與橋梁相關(guān)的文章約有120篇,其中,口頭報告,主要集中在:橋梁抗震性能、橋梁隔震和控制、橋梁評估和加固、橋梁和基礎(chǔ)設(shè)施等4個專題中;張貼報告,主要集中在:抗震設(shè)計和易損性分析、試驗研究、抗震裝置的反應(yīng)、近斷層反應(yīng)和土結(jié)相互作用、橋梁和特殊結(jié)構(gòu)的評估與加固、大跨度橋梁和拱橋、橡膠支座的特點等7個專題中。此外,還有一些橋梁相關(guān)文章,分散在區(qū)域地震風(fēng)險和韌性評估、海嘯災(zāi)害、恢復(fù)和韌性、各種抗震加固方法、低損傷韌性結(jié)構(gòu)、機(jī)器學(xué)習(xí)等專題中。在17WCEE中,與橋梁相關(guān)的專題分會場的會議主題、報告編號及報告數(shù)量,見表1。

表1 17WCEE與橋梁相關(guān)的專題分會場Table 1 Special topic of branch venues about bridge in the 17WCEE
為了便于與16WCEE開展對比研究,文中在研究17WCEE文章時,將結(jié)合黃勇等[1]對橋梁抗震領(lǐng)域文章的分類方式,按照橋梁抗震相關(guān)專題報告的主要研究內(nèi)容,分為:減隔震裝置、橋梁地震反應(yīng)分析、橋墩的抗震性能、橋梁易損性、橋梁相關(guān)試驗、橋梁抗震驗算用地震動的選取與合成、其他橋梁相關(guān)研究等幾大類。17WCEE的文章分類及各分類的占比,如圖1所示。16WCEE和17WCEE中橋梁相關(guān)文章的研究方向分類對比,如圖2所示。
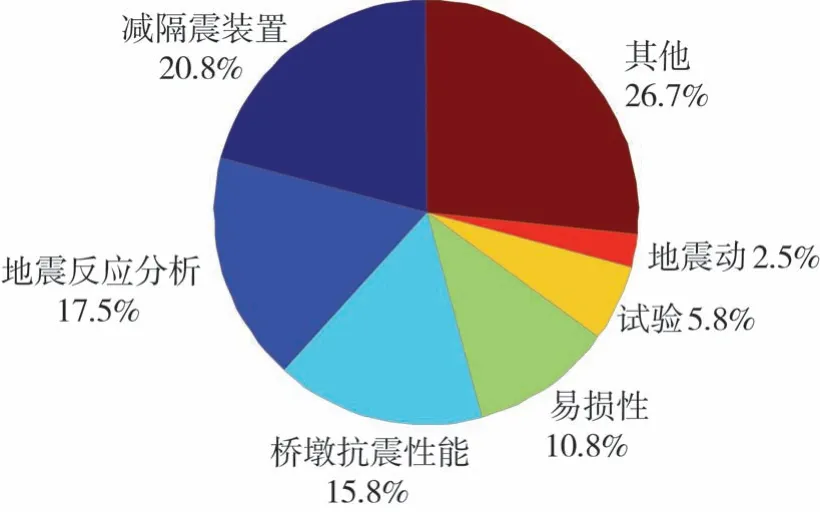
圖1 橋梁相關(guān)文章的分類及占比Fig.1 Classification and proportion of the papers about bridge
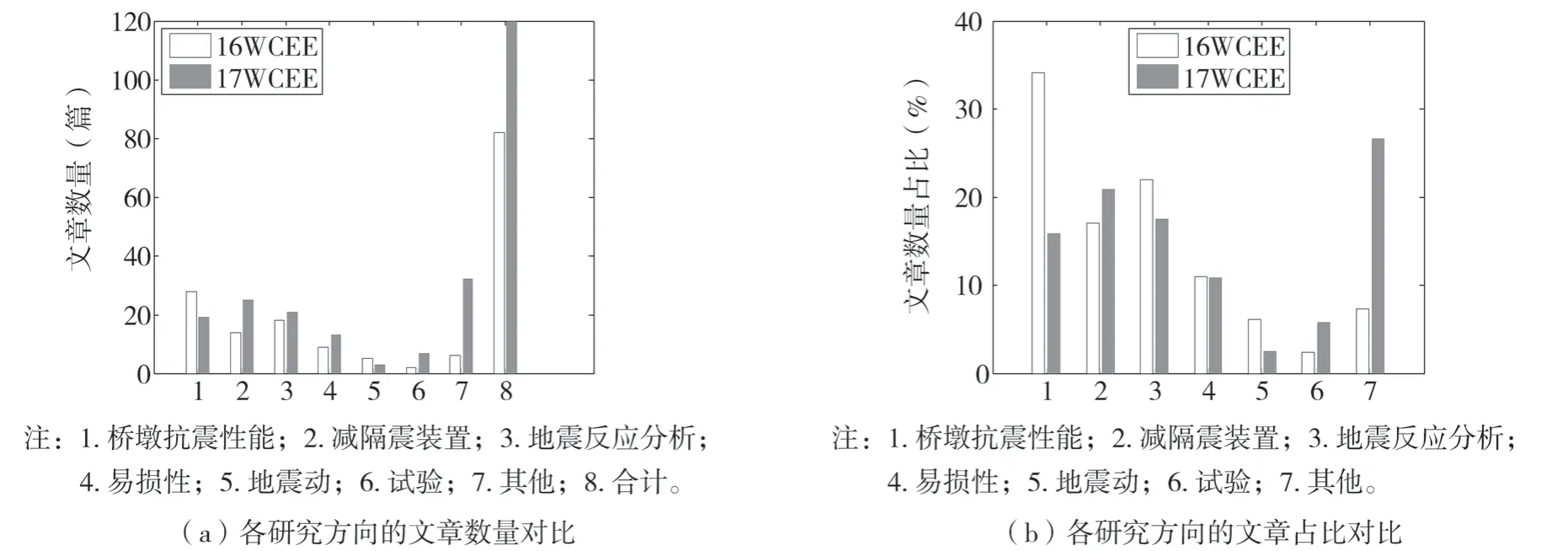
圖2 最近兩屆世界地震工程大會橋梁相關(guān)文章研究方向的對比Fig.2 Comparison of the papers about bridge for different research directions between the two latest WCEEs
從圖1和圖2(b)可以看出,減隔震裝置、橋梁地震反應(yīng)分析、橋墩的抗震性能、橋梁易損性,這4類研究文章在兩屆世界地震工程會議中,均占有較大的比重。從圖2可以看出,與16WCEE相比,在17WCEE橋梁相關(guān)文章中,減隔震裝置、試驗、其他研究,這3類研究文章的數(shù)量占比有所增加;橋墩抗震性能、地震反應(yīng)分析、地震動,這3類研究文章的數(shù)量占比有所減少;易損性研究文章的數(shù)量占比變化不大。與16WCEE相比,17WCEE橋梁相關(guān)文章的研究方向,分布更為均勻,其他研究的文章也占有較大比例,這說明,橋梁抗震領(lǐng)域的研究方向,越來越趨于平衡和廣泛,這有利于橋梁抗震研究的全面發(fā)展。另外,從圖2(a)可以看出,從橋梁相關(guān)文章的總數(shù)量來看,16WCEE關(guān)于橋梁文章約有80篇,而17WCEE關(guān)于橋梁文章達(dá)到120篇,17WCEE關(guān)于橋梁文章數(shù)量比16WCEE多了將近一半。
2 主題(特邀)報告中關(guān)于橋梁抗震的內(nèi)容
2.1 橋梁的抗震設(shè)計、維修與加固研究
日本國土技術(shù)政策綜合研究所Hoshikuma研究員的特邀報告[2],題目為:《日本公路橋梁的抗震設(shè)計、加固及維修(Seismic Design,Retrofit and Repair of Road Bridges in Japan)》。首先,報告介紹了日本公路橋梁的抗震設(shè)計和維修加固的歷史發(fā)展過程。然后,報告介紹了2011年東日本大地震和2016年日本熊本地震造成的橋梁震害現(xiàn)象,并指出,這兩次地震中很多橋梁的嚴(yán)重?fù)p壞,都是由海嘯和地面破壞造成的;結(jié)合橋梁修復(fù)的實際案例,闡釋了考慮海嘯和地面破壞作用的設(shè)計理念對規(guī)范修訂的影響。最后,根據(jù)橋梁損壞的經(jīng)驗教訓(xùn),報告對橋梁抗震的方法提出了建議:(1)路線的規(guī)劃,應(yīng)盡量遠(yuǎn)離海嘯和地面破壞嚴(yán)重的區(qū)域;(2)橋梁設(shè)計時,應(yīng)多設(shè)置冗余結(jié)構(gòu)系統(tǒng),以最大限度地減少海嘯和地面破壞對橋梁性能的影響;(3)應(yīng)多設(shè)置韌性結(jié)構(gòu)系統(tǒng),以加快橋梁震后功能的恢復(fù)速度;(4)改進(jìn)路網(wǎng)在不可預(yù)見的極端地震事件中的抗震性能。
2.2 橋梁地震易損性、韌性與多災(zāi)害研究
新西蘭坎特伯雷大學(xué)Palermo教授的主題報告[3],題目為:《橋梁地震易損性、韌性與多災(zāi)害研究(Seismic bridge vulnerabilities,resilience and multi-hazards)》。首先,報告以新西蘭2011年Canterbury地震和2016年Kaikoura地震中橋梁的震害特點為例,討論了在地震及土體液化和滑坡等次生災(zāi)害的作用下,結(jié)構(gòu)形式的魯棒性、結(jié)構(gòu)系統(tǒng)的冗余度以及結(jié)構(gòu)地震反應(yīng)的可預(yù)測性。接著,報告討論了橋梁抗震理念向韌性系統(tǒng)(resilience system)和恢復(fù)極限狀態(tài)(recovery limit states)轉(zhuǎn)變的必要性,以及目前的研究進(jìn)展。然后,報告介紹了2016年新西蘭在連接基督城的Wigram和Magdala之間的橋梁上,應(yīng)用韌性提升理念,設(shè)計了無粘結(jié)后張預(yù)應(yīng)力筋與墩底埋置可替換耗能裝置結(jié)合的搖擺機(jī)制橋墩。最后,報告討論了多災(zāi)害、結(jié)構(gòu)老化和氣候改變等因素,對橋梁韌性提出的挑戰(zhàn)。
上述主題(特邀)報告,在一定程度上代表了橋梁抗震研究的前沿動態(tài),為未來相關(guān)研究奠定了基礎(chǔ),對未來橋梁抗震的研究具有一定的指導(dǎo)意義。
3 專題報告中關(guān)于橋梁抗震的內(nèi)容
針對17WCEE文章中,關(guān)于橋墩的抗震性能、地震保護(hù)裝置、地震反應(yīng)分析、易損性、斜拉橋、拱橋和曲線橋等幾個相對熱門的橋梁抗震研究方向,本章將進(jìn)行詳細(xì)介紹和分析。
3.1 橋墩抗震性能研究
橋墩,是橋梁最為關(guān)鍵的構(gòu)件之一,它可以決定橋梁在地震荷載下的整體性能[4],橋墩抗震性能的研究,對提升橋梁的整體抗震性能至關(guān)重要。
在17WCEE文章中,關(guān)于橋墩抗震性能的主要研究對象,包括:預(yù)制節(jié)段拼裝橋墩、鋼管橋墩和空心截面鋼筋混凝土橋墩等。采用的研究方法通常是:數(shù)值模擬、擬靜力試驗和振動臺試驗等[1]方法。
預(yù)制節(jié)段拼裝橋墩,具有天然的連接縫,地震作用下,通過在連接縫處形成塑性鉸或在連接縫處安裝耗能裝置,可以起到耗能的作用;在橋墩修復(fù)時,可以僅修復(fù)或替換部分破壞的節(jié)段,而保留其他完好的節(jié)段。此外,與整體現(xiàn)澆式橋墩相比,預(yù)制節(jié)段拼裝橋墩,更適合應(yīng)用在希望快速建造的橋梁、以及施工現(xiàn)場不便于大體積澆筑的橋梁中。因此,預(yù)制節(jié)段拼裝橋墩,具有施工速度快、交通影響小、抗震性能好和修復(fù)經(jīng)濟(jì)便利等優(yōu)點,得到了業(yè)界的關(guān)注,使用預(yù)制節(jié)段橋墩的加速施工橋梁技術(shù),在中低地震活動區(qū)被廣泛采用[5-6]。
預(yù)制拼裝橋墩,如果連接方法適當(dāng),可以形成搖擺墩,使其成為低損傷、自復(fù)位結(jié)構(gòu)構(gòu)件,滿足可恢復(fù)性設(shè)計的理念[1]。搖擺橋墩,是一種重要的橋墩抗震理念和形式。混合搖擺橋墩,也稱為耗能控制搖擺橋墩或連接系統(tǒng),在橋梁行業(yè)中越來越受歡迎。混合搖擺橋墩的主體,通常是預(yù)制混凝土橋墩,采用后張法與基礎(chǔ)和蓋梁連接,在搖擺界面處設(shè)有耗能裝置或耗能桿。在該抗震設(shè)計系統(tǒng)中,為避免應(yīng)變集中,鋼筋束和橋墩混凝土不粘合或部分粘合,耗能桿在搖擺界面附近不與混凝土粘合;主筋提供自復(fù)位力,以減少結(jié)構(gòu)永久變形和耗能桿的屈服,進(jìn)而提高結(jié)構(gòu)的抗震耗能能力[7]。
在16WCEE文章中,預(yù)制節(jié)段拼裝橋墩,就是橋梁抗震領(lǐng)域的熱門研究方向,在17WCEE文章中,熱度不減,許多文章針對預(yù)制節(jié)段拼裝橋墩,開展了相關(guān)研究。在17WCEE文章中,針對預(yù)制節(jié)段拼裝橋墩的研究,包括:橋墩的抗震機(jī)理[7-8]、形式優(yōu)化改進(jìn)[9-10]以及新材料的應(yīng)用[11]等內(nèi)容。
按照連接縫部位不同,Yang等[12]將預(yù)制混凝土橋墩分為:Non-emulative連接橋墩(墩身有連接縫、墩底不插入承臺、墩和承臺連接縫在承臺外,非整體澆筑橋墩)、Emulative連接橋墩(墩身無連接縫、墩底插入承臺、墩和承臺連接縫在承臺內(nèi),整體澆筑橋墩)和Hybrid連接橋墩(墩身有連接縫,墩底插入承臺,墩和承臺連接縫在承臺內(nèi),混合澆筑橋墩)等3類橋墩,如圖3所示,并通過有限元模擬,對比分析了這3類預(yù)制混凝土橋墩系統(tǒng)的性能,研究了預(yù)制節(jié)段之間的連接縫位置對橋墩抗震性能的影響。
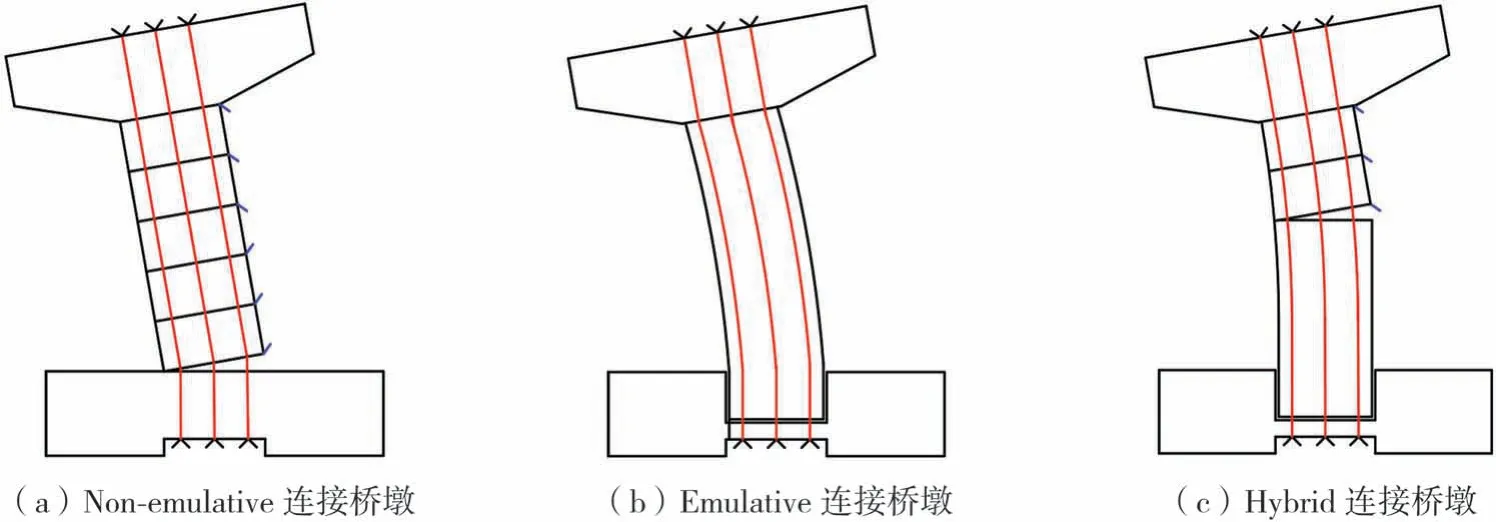
圖3 預(yù)制混凝土橋墩不同連接縫位置示意圖[12]Fig.3 Precast concrete piers with different positions of connections[12]
Liang等[13]又將Non-emulative連接橋墩分為:純搖擺(Purely Rocking)橋墩、混合搖擺(Hybrid Rocking)橋墩和滑動搖擺(Sliding Rocking)橋墩等3類橋墩,并通過數(shù)值模擬,進(jìn)行偽動力循環(huán)加載,評估了這3類Non-emulative連接橋墩的抗震性能差異。針對Non-emulative連接橋墩,Xu等[6]通過實驗室擬靜力試驗,研究了橋墩與承臺采用灌漿套筒連接和采用超高性能混凝土(ultra-high performance concrete,UHPC)連接這2種連接方法對橋墩抗震性能的影響。試驗結(jié)果表明:2種不同連接方法的結(jié)構(gòu),抗震性能均能滿足要求,但是,2種連接的結(jié)構(gòu)破壞模式不同,采用灌漿套筒連接的預(yù)制橋墩的破壞模式為鋼筋斷裂,采用超高性能混凝土連接的預(yù)制橋墩的破壞模式為在連接區(qū)域上方的普通核心混凝土被壓碎。
在17WCEE關(guān)于橋墩抗震性能的文章中,研究的橋墩的截面形狀和材料,多種多樣。17WCEE文章研究的橋墩類型,主要包括:鋼管搖擺橋墩[14-15]、鋼管混凝土搖擺橋墩[16]、帶有鋼筋混凝土網(wǎng)的鋼管混凝土橋墩(concrete filled steel tubular built-up column with RC web,CFST-RC)[17]、空心矩形截面鋼管橋墩[18]、空心圓形截面鋼筋混凝土橋墩[19]、剛構(gòu)預(yù)應(yīng)力混凝土空心橋墩[20]、圓形截面和矩形截面鋼筋混凝土橋墩[21]和素混凝土橋墩[22]等截面形式的橋墩。
在17WCEE中,關(guān)于橋墩震后維修加固的方法,也不盡相同。Miyahara等[20]提出了使用高流動性混凝土填充修復(fù)的方法,Soberón等[23]對比研究了使用混凝土、鋼、碳纖維外殼等3種橋墩加固的方法,Takahashi等[24]提出了使用可更換塑性鉸外殼的橋墩維修的概念。
此外,通過擬合計算,Julian等[25]提出了鋼筋混凝土橋墩位移能力與墩高的關(guān)系公式。Rai等[26]通過數(shù)值模擬,分析了城市軌道交通用高架橋C形立面橋墩的地震易損性。
3.2 地震保護(hù)裝置性能研究
地震保護(hù)裝置,是特殊的非結(jié)構(gòu)構(gòu)件,在地震作用時,往往先于結(jié)構(gòu)構(gòu)件破壞,發(fā)生彈塑性形變,起到減震耗能的作用,震后通常可以更換。地震保護(hù)裝置,是專門為抗震而設(shè)置的,是結(jié)構(gòu)抗震的特色構(gòu)件,在橋梁抗震領(lǐng)域具有重要的地位,得到了抗震領(lǐng)域的廣泛認(rèn)可和應(yīng)用。地震保護(hù)裝置,一般包括:阻尼器、隔震裝置、防落梁裝置和加入新材料實現(xiàn)地震保護(hù)等措施。
阻尼器,對于建筑物減震耗能的作用顯著。17WCCE中的一些文章[27-31],研究了不同種類的阻尼器自身的性能以及阻尼器在結(jié)構(gòu)中發(fā)揮的減震作用。
橋梁隔震裝置,一般包括:支座和隔震器。在17WCEE文章中,關(guān)于支座的文章[32-43],主要是從支座自身的力學(xué)性能、破壞機(jī)理、本構(gòu)關(guān)系、布設(shè)位置、損傷識別以及支座對橋梁地震響應(yīng)的影響等方面開展研究。橋梁的隔震器,通常是由彈性材料(例如:氯丁橡膠、天然橡膠、高阻尼橡膠)和增強(qiáng)材料交替層制成的彈性裝置[44]。在17WCEE文章中,關(guān)于隔震器的設(shè)計和研究,包括:非粘合纖維增強(qiáng)彈性隔震器(unbonded fiber reinforced elastomeric isolator,U-FREI)[45]、“V型連接器”[46]、曼斯納格(Mesnager)鉸[47]等隔震器,Matsuzaki[48]還研究了強(qiáng)地震動作用下隔震橋梁的地震反應(yīng)特性、以及隔震器和橋墩極限承載力的關(guān)系。
關(guān)于防落梁裝置的研究,在17WCEE文章中,Iwatsubo等[49]和Yuan等[50]研究了盤繞拉索限位器(coiled cable restrainer,CCR),Sun等[51]分析了帶有防落梁系統(tǒng)的曲梁橋的非線性地震響應(yīng)情況。
使用新材料,也可以實現(xiàn)地震保護(hù)作用。在17WCEE文章中,用于實現(xiàn)地震保護(hù)作用的新材料,包括:形狀記憶合金(shape memory alloy,SMA)[52-54]、碳纖維增強(qiáng)聚合物(carbon fiber reinforced polymer,CFRP)[55]、高性能纖維增強(qiáng)水泥基復(fù)合(high-performance fiber-reinforced cementitious composites,HPFRCC)材料[56]等新材料。
此外,Hino等[57]研究了地梁對橋梁的地震保護(hù)作用,Chen等[58]提出了采用串并聯(lián)慣性系統(tǒng)(series-parallel inerter system,SPIS),來防止具有搖擺基礎(chǔ)的高墩產(chǎn)生過大的搖擺角。Huber等[59]還介紹了應(yīng)用于墨西哥城際軌道交通橋TOLUCA高架橋的阻尼器、隔震器和連接系統(tǒng)等抗震保護(hù)裝置。
3.3 橋梁地震反應(yīng)分析
橋梁地震反應(yīng),可以直接反映橋梁在地震期間的運動情況。橋梁地震反應(yīng)分析,是研究橋梁抗震能力的基礎(chǔ),也是驗證橋梁抗震措施有效性的重要手段。有限元數(shù)值模擬,是進(jìn)行橋梁地震反應(yīng)分析的重要方法。在17WCEE中,很多文章都是通過有限元數(shù)值模擬,研究橋梁的地震反應(yīng)情況,進(jìn)而深入探究一些更為復(fù)雜的問題。
基于有限元數(shù)值模擬開展橋梁地震反應(yīng)分析,Dallaire等[60]評估了阻尼比和阻尼修正系數(shù)對典型公路橋梁地震反應(yīng)的影響;Martinez等[61]對比了不同阻尼模型下橋梁地震響應(yīng)的差異,研究了粘性阻尼模型假設(shè)對多跨橋梁地震非線性分析的影響;Betancour等[62]通過對4座懸臂施工橋梁抗震性能的對比,研究了基于位移和基于力的設(shè)計方法的差異;Motamedi等[63]模擬了橋梁在不同損傷狀態(tài)下的頻率及力的重分布情況;Wang等[64]驗證了其開發(fā)的基于能力的非彈性位移譜;Aldea等[65]研究了橋臺和主梁方向存在斜角的橋梁的地震響應(yīng)行為;Scott等[66]研究了標(biāo)準(zhǔn)橋墩和標(biāo)準(zhǔn)橋梁的地震響應(yīng)對輸入?yún)?shù)值的敏感性在SAP/CSiBridge和OpenSees有限元軟件中存在的差異以及差異產(chǎn)生的原因。
土結(jié)相互作用或水結(jié)相互作用,對橋梁的地震反應(yīng)有一定的影響。在17WCEE文章中,一些研究[67-70]考慮了土結(jié)相互作用的影響。Dong等[71]考慮了水結(jié)相互作用的影響。
橋梁的地震反應(yīng)分析,可以揭示實際震害的發(fā)生機(jī)理。在17WCEE中的一些文章,針對2016年日本熊本地震中的公路橋梁的震害現(xiàn)象[72]、大切-大橋(Ohkirihata Bridge)支座的破壞現(xiàn)象[73]、田原山大橋(Tawarayama Bridge)主梁與橋臺碰撞以及支座破壞的現(xiàn)象[74],針對2018年0206花蓮地震中的橋梁震害現(xiàn)象,進(jìn)行了橋梁地震反應(yīng)分析,討論了震害現(xiàn)象的發(fā)生機(jī)理[75]。
此外,Mackie等[76]數(shù)值模擬了橋臺在地震作用下的力-位移本構(gòu)關(guān)系和地震響應(yīng)情況。Clemente等[77]采用力學(xué)方法,研究了在水平地震荷載作用下,兩跨砌體拱橋在拱圈和橋墩形成塑性鉸的倒塌機(jī)理。
3.4 橋梁地震易損性分析
對于結(jié)構(gòu)或系統(tǒng)的抗震性能的概率性評價來說,地震易損性分析,具有壟斷性地位,常常作為一種評價結(jié)構(gòu)抗震能力的方法,廣泛應(yīng)用于橋梁抗震研究的很多領(lǐng)域中。
在17WCEE文章中,橋梁地震易損性研究的對象,主要包括:構(gòu)件[44,78]、橋梁[8,53,58,79-82]、橋梁所在交通網(wǎng)絡(luò)[83-85]等。一些文章[45,86-88]在開展地震易損性研究時,還重點考慮了土結(jié)相互作用。
此外,Kappos等[89]開發(fā)了用于評估普通橋梁和加固后橋梁易損性的在線數(shù)據(jù)庫和軟件。
3.5 斜拉橋、拱橋、曲線橋的抗震研究
在17WCEE中,一些文章開展了斜拉橋的抗震研究。通過數(shù)值模擬,Berton等[90]對法國的Saint Nazaire大橋、Utsunomiya等[91]對坐落于日本東京灣的Tsurumi Tsubasa大橋,進(jìn)行了地震反應(yīng)分析和特性研究。Zhong等[92]通過實驗室加載試驗,研究了斜向阻尼器系統(tǒng)(oblique damper system,ODS)的力學(xué)性能,并將斜向阻尼器系統(tǒng)應(yīng)用在了中國的武漢長江二橋高速公路大橋上。日本的Shin Nakagawa大橋在2011年東日本大地震中發(fā)生了損壞并在震后進(jìn)行了修復(fù)和加固,Siringoringo等[93]基于無線傳感器網(wǎng)絡(luò),對該修復(fù)后的橋梁開展了連續(xù)的地震響應(yīng)監(jiān)測,并分析了監(jiān)測記錄。此外,Soberón等[94]研究了某斜拉橋橋塔的延性性能。Wang等[95]總結(jié)了大跨度橋梁橋塔的分析常用方法,包括:增量動力分析法(incremental dynamic analysis,IDA)、模態(tài)推覆分析法(modal pushover analysis,MPA)和適應(yīng)性推覆分析法(adaptive pushover analysis,APA);基于等效位移原理(equal displacement principle),提出了更為高效、穩(wěn)定和合理的基于位移的推覆分析法(deformation-based pushover analysis,DPA);采用DPA法,對中國的蘇通大橋混凝土橋塔進(jìn)行了地震響應(yīng)分析。
在17WCEE中,一些文章開展了拱橋的抗震研究。Clemente等[77]進(jìn)行了兩跨砌體拱橋的地震反應(yīng)分析。針對山區(qū)常用的具有鋼橋面板的拱橋,Wang等[96]研究了拱肋內(nèi)傾角對橋梁抗震性能的影響。
在17WCEE中,一些文章開展了曲線橋的抗震研究。Chao等[97]通過數(shù)值模擬,對曲線橋梁進(jìn)行了抗震性能評價。Seo等[84]完成區(qū)域尺度的曲線橋梁地震易損性量化工作,研究了橋梁地震敏感性以及各種參數(shù)對地震易損性的影響。Sun等[51]對帶有防落梁系統(tǒng)的曲線梁橋,進(jìn)行了非線性地震響應(yīng)分析。Jiao等[98]研究小半徑的曲線橋,在地震作用下的碰撞效應(yīng)。
3.6 其他研究方向
17WCEE的文章,除開展本章介紹的主要研究方向外,還對橋梁抗震的許多其他研究方向進(jìn)行了一定的探索,開展了諸如車橋耦合[99-101]、抗震規(guī)范[102-107]、樁基礎(chǔ)[108-110]、交通網(wǎng)絡(luò)[82,111-112]、地震波[113-115]、海嘯[2,85,116-117]、機(jī)器學(xué)習(xí)[4,118-119]等與橋梁抗震相關(guān)的研究。
此外,Dong等[120]基于單自由度(single-degree-of-freedom,SDOF)系統(tǒng)的非線性動力學(xué)分析,研究了在近斷層脈沖型地震動作用下,具有旗形(flag-shaped,F(xiàn)S)滯回模型的自復(fù)位結(jié)構(gòu)的延性需求譜的一般特征,以及結(jié)構(gòu)特征對延展性需求譜的影響;Rashidov等[121]簡單介紹了烏茲別克斯坦橋梁總體情況和其使用的橋梁健康監(jiān)測方法;Hernández等[122]進(jìn)行了一系列現(xiàn)場測試,估計了土體的主要振動頻率、頻散曲線和剪切波速度剖面,并使用頻率分析和隨機(jī)子空間識別(stochastic subspace identification,SSI)方法,估計了橋梁的模態(tài)頻率和模態(tài)振型。
4 對未來橋梁抗震研究的啟示
通過對17WCEE文章的梳理和研讀,結(jié)合近些年來地震工程領(lǐng)域的研究進(jìn)展情況,綜合看來,橋梁抗震研究仍然會是工程抗震領(lǐng)域的重要研究議題之一,其研究熱點會與時俱進(jìn)。未來橋梁抗震的研究熱點,可能包括:可恢復(fù)性技術(shù)、新材料、舊橋維修加固、全壽命周期、區(qū)域(路網(wǎng))整體性、高新科技、將建筑工程抗震方法引入橋梁工程抗震中、計算機(jī)模擬多于實驗室試驗、多災(zāi)耦合與多荷載耦合等與橋梁抗震相關(guān)的研究,下面將對這些研究方向展開討論。
(1)可恢復(fù)性技術(shù)。基礎(chǔ)設(shè)施的抗震能力和可恢復(fù)性,是下一代先進(jìn)工程結(jié)構(gòu)的主要關(guān)注點。抗震結(jié)構(gòu)可恢復(fù)性技術(shù),包括:搖擺結(jié)構(gòu)、自復(fù)位結(jié)構(gòu)和便于更換部件結(jié)構(gòu)。在工程實踐中,有時還會選擇2種或2種以上的可恢復(fù)性技術(shù)相結(jié)合使用[27]。新的可恢復(fù)結(jié)構(gòu)形式和可更換部件,對橋梁抗震性能的提高將起到?jīng)Q定性作用,但從目前進(jìn)展來看,可恢復(fù)結(jié)構(gòu)形式和可更換部件的種類還不多。正是因為如此,可恢復(fù)性技術(shù),在近年來和未來的一段時間里,都是較為重要和熱點的橋梁抗震研究內(nèi)容之一。
(2)新材料。近年來,新材料不斷研發(fā),給整個科技屆的發(fā)展帶來了新的活力,有時甚至可以帶來顛覆性的革命。短期來看,新材料可以用于可更換部件,改善其在地震作用下的行為和性能。遠(yuǎn)期來看,新材料可能代替?zhèn)鹘y(tǒng)的鋼筋、混凝土、鋼材、石材和木材等,使橋梁更加輕便、環(huán)保、耐用、經(jīng)濟(jì),橋梁抗震性能也可能會有較大的提升。
(3)舊橋維修加固。橋梁,是跨越障礙、構(gòu)建立體交通的重要要素,第二次世界大戰(zhàn)以后,橋梁建設(shè)取得了突飛猛進(jìn)的發(fā)展,尤其是進(jìn)入21世紀(jì)以來,橋梁的數(shù)量和覆蓋范圍,都大幅提升。比如說,近年來,在中國新建的高速鐵路中,橋梁在線路總長中的占比經(jīng)常很高。同時,隨著經(jīng)濟(jì)和科技的發(fā)展,橋梁抗震規(guī)范也在不斷更新和完善,對橋梁的抗震性能要求水平越來越高。可以預(yù)期,未來會有越來越多的橋梁面臨維修加固和改造升級,如何通過維修使橋梁在震后恢復(fù)使用功能,如何通過加固使橋梁的抗震性能得到提升,將是一個非常有實際工程意義和有市場潛力的研究內(nèi)容。
(4)全壽命周期內(nèi)的橋梁抗震性能研究。一個橋梁項目的全壽命周期,應(yīng)該包括:設(shè)計、施工、服役(日常運營維護(hù))、維修加固等不同時間階段。從17WCEE的橋梁抗震文章來看,對于在不同時間階段的橋梁抗震的研究,往往是獨立的,大部分研究重點也都是服役期的橋梁,對其它時間階段橋梁的抗震研究較少。隨著橋梁全壽命周期鏈的延長以及橋梁全壽命周期監(jiān)測技術(shù)的發(fā)展,未來對全壽命周期內(nèi)的橋梁抗震性能的研究,將逐步全面完善。
(5)區(qū)域(路網(wǎng))整體性。在路網(wǎng)中,橋梁往往只占一部分,但橋梁又經(jīng)常處于比較關(guān)鍵的節(jié)點位置。在地震中,一座橋梁的交通中斷,往往會導(dǎo)致一整條甚至多條交通線路的中斷,同樣,在地震中,如果一個線路上橋梁以外的其他路段交通發(fā)生中斷,即便橋梁完好,交通也不能正常通行,橋梁的作用也無法發(fā)揮。在未來橋梁抗震的研究中,需要把橋梁放在路網(wǎng)的整體中研究,把整個路網(wǎng)或者一片區(qū)域的整體交通網(wǎng)絡(luò)結(jié)合起來一起研究。
(6)高新科技在橋梁抗震中的應(yīng)用。在橋梁抗震性能監(jiān)測和震后損傷評估等方面,充分利用高新科技,可以使橋梁抗震工作更為方便和精準(zhǔn)。尤其是衛(wèi)星遙感、無人機(jī)、機(jī)器學(xué)習(xí)、數(shù)字孿生、BIM、大數(shù)據(jù)、云計算、人工智能等高新科技,比較適合應(yīng)用在工作量大、重復(fù)性多、復(fù)雜性高的橋梁抗震研究中。隨著計算機(jī)和網(wǎng)絡(luò)技術(shù)的迅速發(fā)展,將高新科技應(yīng)用在橋梁抗震研究中,已成為一種趨勢,隨著科技的進(jìn)一步發(fā)展,未來高新科技在橋梁抗震中的應(yīng)用會取得更為創(chuàng)新和實用的研究成果。
(7)將建筑工程抗震方法引入橋梁工程抗震中。按建筑物用途不同,結(jié)構(gòu)工程往往被細(xì)化為建筑工程和橋梁工程2個分支分別開展研究,而這2個分支的抗震基本原理和思路方法,又都是相通的。例如,建筑工程里的抗震柱和橋梁工程里的抗震橋墩,隔震建筑的隔震支座和橋梁工程的隔震支座等,在抗震原理和方法上,都具有高度的相似性。因此,如果將建筑工程抗震的一些新的方法和理念引入到橋梁工程抗震中,將可能快速推進(jìn)橋梁抗震的研究和發(fā)展。
(8)計算機(jī)模擬多于實驗室試驗。從17WCEE文章來看,使用計算機(jī)模擬方法遠(yuǎn)多于實驗室試驗方法,這是因為,與實驗室試驗相比,計算機(jī)模擬,具有經(jīng)濟(jì)、快速、易修改、易重復(fù)、出錯率低等優(yōu)點。隨著計算機(jī)硬件和軟件的快速發(fā)展,計算機(jī)模擬,在橋梁抗震研究中正發(fā)揮著越來越大的作用。目前,橋梁抗震的研究,需要更為精細(xì)和高效的計算機(jī)模擬方法和軟件。因此,計算機(jī)模擬技術(shù)的發(fā)展,將可能對橋梁抗震研究產(chǎn)生較大的影響和作用。
(9)多災(zāi)耦合、多荷載耦合。地震的發(fā)生,有時會伴隨著火山的噴發(fā)、海嘯的形成、極端氣象等災(zāi)害的發(fā)生,隨著氣候變暖、海平面抬升,地震與其他災(zāi)害同時發(fā)生的可能性加大。此外,在地震發(fā)生時,有時橋梁除了需要承受地震荷載外,可能還要承受其他不可忽略的荷載,例如,施工階段的橋梁承受施工荷載、運營階段的橋梁承受車輛荷載和波浪荷載、風(fēng)力較大地區(qū)的橋梁承受風(fēng)荷載、嚴(yán)寒地區(qū)的橋梁承受溫度荷載和流冰荷載、受到車、船等碰撞的橋梁承受沖擊荷載等。從17WCEE文章看,在多災(zāi)耦合、多荷載耦合作用下的橋梁抗震研究,已經(jīng)初具規(guī)模,但還有繼續(xù)深入挖掘和拓展的潛力。
5 結(jié)語
世界地震工程大會,是世界地震工程界規(guī)模最大的學(xué)術(shù)會議交流平臺。17WCEE中,關(guān)于橋梁抗震的文章,在一定程度上代表了該領(lǐng)域近年來的研究進(jìn)展,能夠起到風(fēng)向標(biāo)和指示劑的作用。
文中針對17WCEE中,關(guān)于橋梁抗震方面的論文進(jìn)行了統(tǒng)計和分類,與上一屆會議進(jìn)行了對比研究,同時,分類梳理并介紹了17WCEE中橋梁抗震研究的主要內(nèi)容,對未來橋梁抗震研究可能的熱點方向進(jìn)行了預(yù)測和分析。文中的研究,對橋梁抗震研究未來的發(fā)展將發(fā)揮積極的推動作用。

