氫能制備技術研究進展
朱俏俏 程紀華(浙江省經濟信息中心)
?
氫能制備技術研究進展
朱俏俏程紀華(浙江省經濟信息中心)
論述了礦物燃料制氫、生物質制氫和水制氫等3類氫能制備技術,總結了各類技術的研究進展和優缺點,提出了未來的發展方向。氫能的大規模、低成本和高效制備是關鍵問題,礦物燃料制氫技術成熟,在其他制氫技術尚不成熟階段,可作為過濾性的制氫方式;但需要解決投資成本高、污染嚴重和碳排放量大等問題。綜合各類因素,認為熱化學循環水分解制氫工業化應用潛力巨大。
氫氣能源熱化學綜述
長期以來,由于煤炭、石油和天然氣為主的化石能源的急劇消耗帶來了氣候變化、環境污染和能源短缺等問題,迫使人類積極尋求安全穩定和清潔高效的替代能源。其中,氫能作為1種清潔、高效、可持續的“零碳”能源,引起了世界各國的普遍關注,美國、歐盟和日本等國家或地區均投入大量資金和技術力量開展基礎研究,以期盡早實現氫能的規模化和商業化應用[1]。為建立氫能體系[2](圖1),氫能的大規模、低成本和高效制備是首先需要解決的關鍵性難題。按照制氫原料和方法等進行劃分,分別介紹礦物燃料制氫、生物質制氫和水制氫技術的特點和局限性,提出適用于氫能經濟時代的氫能制備技術的發展方向。
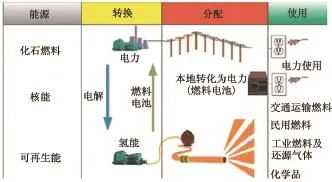
圖1 氫能體系
1 礦物燃料制氫方法
作為當今最常用的能源,煤、石油和天然氣等含碳氫的化石燃料是目前制氫的主要原料,并且生產工藝相對成熟,但是存在儲量有限、污染嚴重和碳排放量大等缺陷。
1.1煤制氫
煤制氫可分為煤的氣化和煤的焦化,這2種方法的共同之處是利用某種方法將固態煤轉換成氫氣等氣態產物。煤的氣化指在高溫常壓或加壓條件下,與水蒸氣、氧氣等氣化劑發生不完全氧化反應,生成的合成氣經凈化、一氧化碳變換以及氫氣提純等處理后獲得高純度的氫氣[3]。煤的焦化指在隔絕空氣的條件下將煤加熱到1173~1273 K,直接生成焦炭和焦爐煤氣(氫氣體積分數達到50%以上)[4]。目前,煤制氫主要存在投資成本高、污染嚴重和碳排放量大等問題,將來要想獲得推廣應用,應設法降低裝置投資成本和控制二氧化碳排放。
1.2天然氣制氫
天然氣制氫技術主要包括水蒸氣重整、部分氧化、自熱重整、絕熱催化裂解等。水蒸氣重整工藝較為成熟,在高溫高壓條件下,甲烷與水蒸氣經催化反應和水煤氣變換反應最終生成氫氣[5]。天然氣部分氧化重整制氫指甲烷與氧氣先進行部分氧化反應,再進行水煤氣變換反應,最終制得氫氣。第1步反應釋放的熱量用于驅動第2步反應,因而該法相比水蒸氣重整工藝,具有能耗低、反應速率快和操作空速大等優勢;但存在高純廉價氧來源不足、催化材料反應穩定性差及操作體系安全性弱等局限。自熱重整制氫集成了水蒸氣重整和部分氧化重整技術的特點,即甲烷同時與水蒸氣、氧氣發生水蒸氣重整反應和部分氧化反應,氧化反應放出的熱量直接用于水蒸氣重整反應,最后通過一氧化碳的水煤氣變換進一步生成氫氣[6]。催化分解制氫可直接生成碳和氫氣,因此,無需額外分離操作便可以制得高純氫氣,但需研發出更高效的催化劑以及解決好固態碳的市場應用,才能實現該方法的大規模應用。
1.3石油制氫
石油制氫的原料是石油深加工后的殘余物以及常壓/減壓渣油等重油,由于市場價值低,將其用于制氫相比其他原料更具價格優勢。一般采用重油部分氧化方法制取氫氣,即在反應溫度高達1423~1588 K條件下,重油中的碳氫化合物與水蒸氣、氧氣發生反應,先生成一氧化碳和氫氣,再將一氧化碳與水蒸汽進行水煤氣變換,繼續轉化成氫氣。該制氫方法的主要缺點在于重油部分氧化后的氣體中存在硫化物,做脫硫處理會增加設備投資費用[7]。
2 生物質制氫方法
生物質是1種可再生能源,具有資源分布廣、總體儲量大等優點。同時,它也是氫的載體,相比化石燃料具有硫氮含量低、灰分少、對環境污染小等優勢,但存在能量密度較低、資源分散的不足;因此,生物質制氫可實現分散、低效向集中、高效能源的轉變。目前,利用生物質制氫可分為2類:生物質熱化學轉化制氫和生物法制氫[8]。
2.1生物質熱化學轉化制氫
生物質熱化學轉化制氫是指通過熱化學反應,比如氣化、裂解、超臨界轉化等,將生物質轉化成富氫氣體。目前,應用最廣泛的是直接將生物質在873~1073 K高溫條件下進行氣化反應,生成一氧化碳和氫氣,再通過水煤氣變換反應進一步生成氫氣。氣化所需熱能也可通過太陽能直接供應。將生物質原料與水混合,可以在超臨界條件下制取氫氣。此外,生物質可以先在高溫無氧條件下熱裂解制取生物油,生物油再重整制氫。雖然目前生物質法制氫在技術上是最具規模化前景的工藝方法,但存在一些難以解決的問題,比如進料方式復雜、產物焦油含量高等。
2.2生物法制氫
生物法制氫是指在常溫常壓下利用微生物將生物質降解得到氫氣,此過程既可以充分利用資源,又可以起到污染整治的目的,因而受到世界各國的重視。根據微生物、產氫底物和產氫機理,生物制氫可以分為暗發酵、光生物(光發酵和光解水)和光暗發酵耦合制氫3種類型。
3 水制氫方法
水作為自然界中最豐富的資源之一,用來制氫不僅原料充足,而且對環境無污染。根據采用的不同分解技術,將水制氫方法分成電解水制氫、光解水制氫、熱解水制氫和熱化學循環水分解制氫。
3.1電解水制氫
電解水制氫技術已經實現工業化應用,全球約4%的氫氣都來源于電解水,其原理是在電驅動下,電解池中的水在陰極還原成氫氣,陽極氧化成氧氣[9]。針對電解水方法的改進主要集中在電解池,包括電極、電解質等。已開發了堿性電解池、聚合物薄膜電解池和固體氧化物電解池等種類,電解效率由70%提高到90%,但考慮發電效率,實際上電解水制氫的能量利用效率不足35%;因此,該方法通常意義上不具競爭力。未來的發展方向是與太陽能、風能、水力資源以及地熱等清潔能源相結合,從而降低制氫成本。
3.2光解水制氫
太陽能是最為清潔而又取之不盡的自然能源,光解水制氫是太陽能光化學轉化與儲存的最佳途徑,意義十分重大。光解水制氫技術經歷了光電化學池(PEC)、光助絡合催化和半導體光催化3個主要階段[10]。光電化學池通過光陽極吸收太陽光中約3%的紫外光,產生電子通過外電路流向陰極,水在陰極接受電子生成氫氣。光電化學池制氫效率低、結構比較復雜,因此不易放大。光助絡合催化以三雙吡啶釕為光敏劑,在AM1.5模擬日光照射下光電轉化效率達7%左右。雖然效率比光電化學池有所提高,但還需添加催化劑和電子給體等,且絡合物成本高、穩定性差,故較難推廣應用。半導體光催化分解水制氫的研究現已成熟,主要原理是利用光催化劑(TiO2、過渡金屬氧化物、層狀金屬氧化物以及能利用可見光的復合層狀物等)分解水制得氫氣。現今主要工作還是圍繞高效光催化劑的研制和改進以提高產氫效率。
3.3熱解水制氫
高溫熱解水制氫就是將水加熱到一定的高溫,將水分解成氫氣和氧氣,最后通過分離制得純氫的過程。這是1個很強的吸熱反應,當反應溫度提高到4700 K時,反應的吉布斯自由能才能降為零。常溫下平衡轉化率極小,在溫度高于2500 K時,分解率僅為4%,3000 K以上才有實際應用的可能。考慮到高溫熱源難以匹配、對反應器適用材料要求苛刻以及氫氧混合存在爆炸隱患等問題,水的直接熱解實用性不強。
3.4熱化學循環水分解制氫
考慮到水直接熱分解需要極高的溫度,相關研究人員提出了熱化學循環水分解制氫的概念[11]。利用1種或多種中間物與水發生反應,生成物再通過轉化生成原先的中間物,經過一系列的化學反應將水分解成氫氣和氧氣,中間物無損耗可循環使用。雖然相比于高溫熱解水和電解水制氫方法,熱化學循環制氫步驟更繁瑣,系統變復雜,但是其存在諸多優點,比如:反應溫度基本低于1273 K,熱源易匹配,可以結合太陽能、核能等新能源;制氫效率較高,可達50%左右;能源利用效率更高;在不同反應模塊內生成氫氣和氧氣,無需額外分離裝置。
根據循環過程中使用的不同物質,一般將熱化學循環水分解制氫分成4大類:金屬氧化物體系、金屬鹵化物體系、含硫體系以及電解-熱化學聯合的雜化體系。
3.4.1金屬氧化物體系
該體系使用金屬氧化物作為中間物,一般是通過活潑金屬/低價態金屬氧化物與高價態金屬氧化物之間進行相互轉換來實現水的分解[12]。
對于金屬氧化學熱化學循環的研究包括鐵氧化物、鋅氧化物、鎂氧化物、錳氧化物、鈰氧化物、錫氧化物、鐵酸鹽等復合金屬氧化物及其摻雜體系等。金屬氧化物經過熱化學循環分解水制氫時,第1步分解反應所需溫度較高,故一般考慮與集中太陽能熱源相耦合。該體系優點在于步驟簡單,氫氣和氧氣在不同反應生成,所以不存在高溫氣體分離困難等問題;但同時也存在一些不足,包括過程溫度高、熱效率低、產氫量小、材料要求高、集中太陽能熱源有待改進以及連續操作困難等。
3.4.2金屬鹵化物體系
金屬鹵化物體系是采用金屬鹵化物與水反應,再經過一系列化學反應(一般至少4步)后制得氫氣和氧氣。該體系相比金屬氧化物體系反應步驟增多,但熱效率不一定降低。
其中,最著名的是日本東京大學發明的絕熱UT-3循環[13]。該循環最高溫度在1030 K左右,比較容易實現,比如采用高溫氣冷堆或者太陽能供熱等。使用的金屬Ca、Fe都廉價易得,有利于降低成本。反應過程熱效率可以高達35%~40%,如果同時發電,效率還可以提高10%。存在的問題是CaBr2水解反應速率較慢、CaO溴化反應燒結嚴重及耐腐蝕廉價材料研制等。
3.4.3含硫體系
含硫循環體系主要包括:硫碘(SI或IS)循環、硫酸-硫化氫循環、硫酸-甲醇循環和硫酸鹽循環等。其中,硫碘循環最早由美國GA公司[14]提出,隨后得到廣泛關注和研究。目前除美國外,法國、意大利、德國、日本、韓國、中國和印度等國家的相關科研機構均選擇SI循環作為未來太陽能或者核能制氫的首選流程。整個閉路循環實現凈輸入H2O和合適的熱量即可生成H2和O2(圖2)。
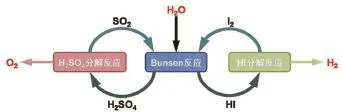
圖2 熱化學硫碘循環水分解制氫原理
3.4.4雜化體系
雜化體系是熱化學過程和電解過程聯合組成的體系,簡化了熱化學循環分解水制氫流程,而且降低了電解溫度,可以實現較高的熱效率。目前,研究較多的雜化體系主要有硫酸-溴雜化循環、硫酸雜化(Westinghouse)循環、烴雜化循環、金屬-金屬鹵化物雜化循環和金屬-金屬雜化循環等。其中,金屬-金屬鹵化物雜化循環的銅-氯(Cu-Cl)循環是近些年的研究熱點,加拿大原子能公司和美國阿爾貢國家實驗室都對其進行了持續研究。
該循環最主要的優點在于反應最高溫度只有800 K左右,對材料要求低,且與核能耦合非常合適。據理論計算銅氯循環制氫效率可達43%。
4 總結與展望
氫能是1種清潔高效的能源載體,同時對環境友好、零碳排放,在資源環境約束日益趨緊的背景下,被公認為是1種理想的替代能源。為了盡早步入氫能經濟時代,氫能的大規模、低成本和高效制備是亟待解決的問題。按照制氫原料和方法劃分,包括礦物燃料制氫、生物質制氫和水制氫。礦物燃料制氫技術成熟,在其他制氫技術尚不成熟階段,可作為過渡性的制氫方式;但需重點解決投資成本高、污染嚴重和碳排放量大等問題。生物質制氫原料來源廣泛,屬于可再生能源,應用前景光明,但產氫速率慢和效率低是最大的局限。電解水制氫是制備高純度氫氣的最主要來源,盡管技術成熟、工藝簡單,但由于采用直接電解方式,綜合考慮發電效率,能量轉化效率不具備競爭優勢。光解水制氫利用取之不盡的太陽能,未來工業化應用潛力巨大,需要在光能利用效率和產氫速率等方面有所突破;如能充分利用可見光的能量進行水解制氫,將極大提升光能利用效率和產氫速率。高溫熱解水制氫原理簡單,但實用性不強,高溫設備、氫氧分離和分解效率都是目前的瓶頸。熱化學循環水分解制氫可耦合核能、太陽能甚至是工業廢熱進行高效制氫,每一步反應條件溫和,理論上不會排放任何污染物;若能在高溫耐腐蝕材料等方面實現突破,將是最有希望實現工業化規模應用的技術方式。
[1]倪萌,LEUNG M K H,SUMATHY K.太陽能制氫技術[J].可再生能源,2004(3):29-31.
[2]SHERIF S A,BARBIR F,VEZIROGLU T N.Wind energy and the hydrogen economy—review of the technology[J].Solar Energy,2005,78(5):647-660.
[3]祁威,張蕾,張磊,等.煤催化熱解制氫的研究進展[J].中國煤炭,2007,33(10):57-58.
[4]李永亮,郭烈錦,張明顓,等.高含量煤在超臨界水中氣化制氫的實驗研究[J].西安交通大學學報,2008,42(7):919-924.
[5]DING Y,ALPAY E.Adsorption-enhanced steam-methanereforming[J].ChemicalEngineeringScience,2000,55(18):3 929-3 940.
[6]AYABES,OMOTOH,UTAKAT,etal.Catalyticautothermal reforming of methane and propane over supportedmetalcatalysts[J].AppliedCatalysis A:General,2003,241(1):261-269.
[7]DOMENICHINIR,GALLIOM,LAZZARETTOA.Combined productionofhydrogenandpowerfromheavy oilgasification:Pinchanalysis,thermodynamic andeconomicevaluations[J].Energy,2010,35(5):2 184-2 193.
[8]NI M,LEUNG D Y,LEUNG M K,et al.An overview of hydrogenproductionfrombiomass[J].Fuelprocessing technology,2006,87(5):461-472.
[9]WANG M,WANG Z,GONG X,et al.The intensification technologiestowaterelectrolysisforhydrogenproduction-Areview[J].RenewableandSustainable Energy Reviews,2014,29(0):573-588.
[10]GLASSCOCK J A,BARNES P R,PLUMB I C,et al.Enhancementofphotoelectrochemicalhydrogen production from hematite thin films by the introductionofTiandSi[J].TheJournalof PhysicalChemistryC,2007,111(44):16477-16 488.
[11]FunkJE,ReinstroR.Energyrequirementsin productionofhydrogenfromwater[J].Industrial&Engineering Chemistry Process Design and Development,1966,5(3):336-342.
[12]Xiao L,Wu S Y,Li Y R.Advances in solar hydrogenproductionviatwo-stepwater-splitting thermochemical cycles based on metal redox reactions[J].Renewable Energy,2012,41(0):1-12.
[13]KameyamaH,YoshidaK.ReactorDesignforthe Ut-3ThermochemicalHydrogen-ProductionProcess[J].International Journal of Hydrogen Energy,1981,6(6):567-575.
[14]KNOCHE K F,CREMER H,BREYWISCH D,et al.Experimental and theoretical investigation of thermochemical hydrogen production[J].InternationalJournalofHydrogenEnergy,1978,3(2):209-216.
10.3969/j.issn.2095-1493.2015.12.018
2015-08-03)
朱俏俏,博士,經濟師,2013年畢業于浙江大學(工程熱物理專業),從事應對氣候變化、燃煤電廠低碳化改造和新能源利用工作,E-mail:zqq@zei.gov.cn,地址:浙江省杭州市西湖區環城西路33號-2,310006。
中國清潔發展機制基金贈款項目“浙江省應對氣候變化統計核算制度研究及能力建設”,項目編號:2013102。

