萊茵衣藻BBS1基因RNAi載體的構建及應用
陳利紅 李麗麗 高利芬 周俊飛 李甜甜 彭海
(江漢大學 系統生物學研究院,武漢 430056)
萊茵衣藻BBS1基因RNAi載體的構建及應用
陳利紅 李麗麗 高利芬 周俊飛 李甜甜 彭海
(江漢大學 系統生物學研究院,武漢 430056)
巴德-畢氏綜合癥(Bardet-Biedl syndrome,BBS)是一種由多種基因突變造成、與原生纖毛功能缺失相關的疾病,包含12種致病基因,分別為BBS1-12。旨在通過對衣藻BBS1基因進行RNAi干擾來研究其在衣藻中的功能。首先搭建衣藻快捷簡單的RNAi骨架載體;再用RT-PCR克隆萊茵衣藻BBS1基因的一段cDNA 序列于中間載體pEASY-T1上;測序后通過兩次酶切連接到RNAi骨架載體上,經菌液PCR、酶切和測序驗證,成功構建BBS1基因的RNAi干涉載體。經基因槍介導法轉化萊茵衣藻CC503,轉基因衣藻具有明顯不同于對照的表現型,趨光性發生了改變。
萊茵衣藻;RNAi載體;BBS1 基因;趨光性
萊茵衣藻(Chlamydomonas reinhardtii)屬于綠藻門、團藻目、衣藻科,是真核單細胞生物。進化上比較古老,介于高等植物和動物之間。衣藻的培養條件簡單、生長周期短、光合效率高、遺傳背景清楚,是重要的能源作物,素有“綠色酵母”之稱[1]。其生物學特性與高等植物和動物密切相關,如纖毛病理學[2],是目前用于研究纖毛的模式生物中最為廣泛使用的一個[3]。
近年來,人們關于纖毛的知識大多來自于對萊茵衣藻的研究,如我們對纖毛結構的了解,“鞭毛內運輸”的機制的發現以及與纖毛相關疾病的確定等[3]。其中,巴德-畢氏綜合癥(Bardet-Biedl syndrome,BBS)就是一種由多種基因突變造成、與原生纖毛功能缺失相關的疾病。包含12種致病基因,分別為BBS1-12[4,5]。BBS患者的癥狀包括視網膜衰退、腎囊形成、多指(趾)癥、嗅覺失敏、高血壓、肥胖癥乃至精神發育遲滯癥等[5]。最近的研究發現BBS蛋白位于纖毛或基體,它們參與了纖毛的組裝過程和信號傳導過程[6]。在萊茵衣藻中,抑制BBS5的表達,纖毛將不能形成[6];BBS1或BBS4基因突變的萊茵衣藻喪失趨光性[4],但是其失去趨光性的分子機制尚不清楚,有待人們進一步深入研究。
2007年萊茵衣藻基因組測序的完成為萊茵衣藻反向遺傳學的研究提供了可能。RNA干擾(RNA interference,RNAi)是指在進化過程中高度保守、由雙鏈RNA(double-stranded RNA,dsRNA)誘發、同源mRNA高效特異性降解的現象[7,8]。它是一種高效的特異性強的基因阻斷技術,近年來發展迅速,目前已成為功能基因組研究領域中一種簡單、有效的代替基因敲除的遺傳工具,在一定程度上起到了基因Knock-down的效果[9,10]。因此若用RNAi技術對衣藻BBS1進行研究,將會促進人們深刻了解和認識萊茵衣藻趨光性的分子機制,同時有可能揭示出“纖毛相關疾病”發生的分子機理,為BBS1基因功能的進一步揭示及衣藻趨光性分子機制的闡明奠定基礎。
1 材料與方法
1.1 材料
試材萊茵衣藻CC503,購自于美國Duke大學衣藻中心。藻株接種到固體TAP(Tris-Acetate-Phosphate)平板上進行繼代培養。
菌株大腸桿菌DH5α為本實驗室保存。pEASY-T1 Cloning Kit購自于北京全式金生物技術有限公司,中間載體pChlamy_3載體質粒購自于Invitrogen公司。反轉錄試劑及各種內切酶購自于NEB公司,各種Taq聚合酶購于大連寶生物公司。
1.2 方法
1.2.1 衣藻RNAi骨架載體的搭建
1.2.1.1 pGH-intron中間載體的構建 利用CTAB 法提取萊茵衣藻基因組DNA,以其為模板,根據已經發表的磷酸核酮糖激酶(Phosphoribulokinase)序列信息(GenBank登錄號:AAA33090.1),設計一對引物PRF1:5'-GTGAGCAAGAGATGCGGC-3',PRR1:5'-CTGGTGGGGAGGAGGGAG-3',PCR擴增其第4段內含子,連接到pEASY-T1載體,并進行測序,獲得磷酸核酮糖激酶的第4段內含子序列,即間隔序列。將設計好的兩端帶有合適多克隆位點的間隔序列委托捷瑞生物工程有限公司進行合成,并構建到由該公司提供的pGH載體上,形成中間載體pGH-intron。
1.2.1.2 pChlamy_RNAi骨架載體的構建 以pGH-intron為載體的基本骨架,利用PCR技術設計4條引物分別擴增pChlamy_3載體上的啟動子序列,引物 為HSPF1:5'-AACTGCAGTCGCTGAGGCTTGACATG-3'(下劃線部分為PstⅠ酶切位點)與HSPR1:5'-GGGGTACCTTTAAGATGTTGAGTGACTTC-3'(下劃線部分為KpnⅠ酶切位點);擴增含有終止子(3'UTR)和潮霉素標記完整表達框序列,引物為UTRHYGF1:5'-GCTCTAGACCGCTCCGTGTAAATGGA-3'(下劃線部分為XbaⅠ酶切位點)與UTRHYGR1:5'-AGAATGCGGCCGCAGTACCATCAACTGACG-3'(下劃線部分為NotⅠ酶切位點);擴增產物酶切后相繼插入到pGH-intron的多克隆位點之間,并進行測序驗證,從而形成衣藻的RNAi骨架載體,命名為pChalmy-RNAi載體。
1.2.2 BBS1基因干涉片段的獲得 為確認cDNA選取片段對BBS1基因干擾效果的影響,選取了BBS1基因上的兩段序列進行干擾,克隆出來的片段分別命名為BBS1.1和BBS1.2。具體方法如下:TRIzoL提取萊茵衣藻總RNA,并用M-MuLV 反轉錄酶進行cDNA第一條鏈的合成。然后再以合成的cDNA為PCR模板,用BBS1.1F與BBS1.1R引物對及BBS2.1F與BBS2.1R引物對進行PCR擴增,擴增產物分別連接到pEASY-T1載體上并測序,形成pEASY-T1-BBS1.1/2.1中間載體,獲得BBS1基因兩段干涉片段BBS1.1和BBS2.1。 其中克隆BBS1基因上這兩段序列所用的引物如下:
BBS1.1F:5'-GCTCTAGAGGGGTACCAGTCCAACCCAAACGATTAC-3'(下劃線部分分別為XbaⅠ和KpnⅠ酶切位點);BBS1.1R:5'-GATTCCATATGGACTAGTGTCGCCAAACAGATTACAAG-3'(下劃線部分分別為NdeⅠ和SpeⅠ酶切位點);BBS2.1F:5'-GCTCTAGAGGGGTACCCGGGCGTATGTCAAGGTC-3'(下劃線部分分別為XbaⅠ和KpnⅠ酶切位點);BBS2.1R:5'-GATTCCATATGGACTAGTGCACCAGGAAGGGTATCG-3 '(下劃線部分分別為NdeⅠ和SpeⅠ酶切位點)。
帶總苞菩提子卵圓形,長7-10毫米,直徑6-8毫米,琺瑯質,堅硬,有光澤,按壓不破,有白、灰、藍紫等各色,基端之孔大,易于穿線成串。但其穎果小,含淀粉少,常不飽滿.一般不做藥或食用。此種疑似民間所稱草珠子。
1.2.3 BBS1基因 RNAi載體的構建 酶切含有BBS1基因正向目的片段的pEASY-T1-BBS1.1/2.1中間載體質粒,與同樣經KpnⅠ和SpeⅠ酶切的pChlamy_ RNAi骨架載體連接,獲得含有BBS1基因正向目的片段的pChlamy_RNAi_BBS1.1/2.1_F 中間載體。
酶切含有BBS1基因反向目的片段的pEASYT1-BBS1.1/2.1中間載體質粒,與同樣經NdeⅠ和XbaⅠ酶切的含有BBS1基因正向目的片段的pChlamy_RNAi_BBS1.1/2.1_F 中間載體連接,獲得含有BBS1基因正向和反向目的片段的pChlamy_ RNAi_BBS1.1/2.1_FR RNAi載體。
1.2.4 BBS1基因RNAi載體的轉化與篩選 取對數期生長的無細胞壁的萊茵衣藻CC503,用基因槍方法轉化,轉化后在弱光下培養2 d后,將固體平板上的萊茵衣藻轉移至含10 mg/L潮霉素的50 mL液體培養基中進行篩選,培養7-10 d直至液體培養基中綠色完全褪去,再取2 mL涂在固體平板上進行固體篩選(10 mg/L hygromycin),7 d左右長出單克隆,挑單克隆至液體培養。
1.2.5 Real-time PCR分析BBS1基因的沉默效果分別提取CC503野生型及轉pChlamy_RNAi_BBS1.1/ 2.1_FR質粒的萊茵衣藻總RNA。反轉錄合成cDNA第一鏈,然后以其為Real-time PCR的模板;S26 RNA作為內參[11],進行Real-time PCR擴增。檢測野生型及轉pChlamy_RNAi_BBS1.1/2.1_FR質粒的萊茵衣藻中目標基因mRNA的表達變化,以確定對目標基因的干擾效果。所用內參及靶基因引物對如下:S26F:5'-CGCCCTGCCCAAGATTTA-3';S26R:5'-CGCGGCTGTGGATAGCA-3';BBS1QF:5'-GGGCGTATGTCAAGGTC-3';BBS1QR5:5'-GCACCAGGAAGGGTATCG-3'。
1.2.6 萊茵衣藻趨光性分析 分別取對數生長期的野生型CC503及轉基因萊茵衣藻于培養皿中,然后用錫箔紙包嚴,只留一定大小的空隙以便光源射入,2 h后觀察兩株系萊茵衣藻的趨光性變化。
2 結果
2.1 衣藻RNAi骨架載體的搭建
利用PCR技術,擴增了衣藻磷酸核酮糖激酶蛋白的第4段內含子,然后連接到pEASY-T1載體,并進行測序,大小為497 bp(圖1)。在該段序列兩端設計合適的多克隆酶切位點,委托上海捷瑞生物工程有限公司進行合成,并構建到由該公司提供的pGH載體上,形成中間載體pGH-intron。

圖1 萊茵衣藻磷酸核酮糖激酶第4段內含子的PCR產物
利用PCR技術,設計合適的含有相應酶切位點的引物,分別擴增Invitrogen公司pChlamy_3載體上的啟動子序列及含有終止子和潮霉素標記完整表達框序列(圖2),PCR產物酶切后相繼連接到中間載體pGH-intron上,并測序驗證,形成衣藻RNAi載體的基本骨架,命名為pChalmy-RNAi載體(圖3)。

圖2 萊茵衣藻啟動子和3'UTR與潮霉素表達框序列的PCR產物
2.2 BBS1基因干涉片段的獲得
根據phytozome數據庫公布的BBS1基因(g17944.t1)報道的序列,設計了兩對引物分別擴增BBS1基因上兩段序列,然后連接到pEASY-T1載體,并進行測序形成pEASY-T1-BBS1.1/2.1中間克隆載體,擴增產物片段大小分別為188 bp和229 bp,結果與預期大小一致(圖4)。另外,由于我們設計的每條引物上均含有正向插入位點和反向插入位點合適的酶切位點,因此中間載體pEASY-T1-BBS1.1/2.1上相當于既含有靶基因的正向片段序列又含有反向片段序列,因此無需再進行反向片段的克隆,節省了構建時間和實驗成本。

圖3 衣藻RNAi骨架載體構建示意圖

圖4 BBS1基因干涉片段的PCR擴增
2.3 BBS1基因RNAi載體的構建
用KpnⅠ和SpeⅠ 酶切含有BBS1基因正向目的片段的pEASY-T1-BBS1.1/2.1中間載體,然后與同樣經這兩個酶酶切的pChlamy_RNAi骨架載體連接,獲得含有BBS1基因正向目的片段的pChlamy_ RNAi_BBS1.1/2.1_F RNAi 載體。由于靶基因片段較小,因此用KpnⅠ和NdeⅠ進行酶切,多了中間的內含子序列,片段大小750 bp左右(圖5-A),結果與預期大小一致,表明獲得了含有BBS1基因正向目的片段pChlamy_RNAi_BBS1.1/2.1_F 中間載體。
用NdeⅠ和XbaⅠ酶切含有BBS1基因反向目的片段的pEASY-T1-BBS1.1/2.1中間載體質粒,與同樣經這兩個酶酶切的含有BBS1基因正向目的片段的pChlamy_RNAi_BBS1.1/2.1_F 中間載體連接,獲得含有BBS1基因正向和反向目的片段的pChlamy_ RNAi_BBS1.1/2.1_FR RNAi載 體, 經Kpn I和Xba I酶切鑒定,結果(圖5-B)表明大小與預期大小一致。
2.4 萊茵衣藻的轉化及轉基因藻株的檢測與分析
采用基因槍法將pChlamy_RNAi_BBS1.1/2.1_FR RNAi 載體轉化萊茵衣藻CC503。轉化后先在含有潮霉素的液體培養基上進行初步篩選,再涂在固體平板上進行篩選。然后隨機挑取轉干涉片段BBS1.1或BBS2.1 RNAi質粒的轉基因衣藻單克隆(每個干涉片段選取10個單克隆)進行提取DNA,以擴增pChlamy_3載體上啟動子序列的引物對HSPF1和HSPR1進行PCR檢測。結果(圖6)顯示,擴增條帶大小約500 bp,與預期大小一致,其中只有一個單克隆未擴增出目標條帶,陽性轉化率高達95%,證明了轉化和篩選方法的可行性。
2.5 Real-time PCR分析BBS1基因的沉默效果
取野生型CC503及轉pChlamy_RNAi_BBS1.1/ 2.1_FR質粒的萊茵衣藻,分別提取總RNA。其中轉pChlamy_RNAi_BBS1.1_FR質粒獲得的陽性轉化子后代命名為BBS1.1_n(n代表哪個單克隆),轉pChlamy_RNAi_BBS2.1_FR質粒獲得的陽性轉化子后代命名為BBS2.1_n(n代表哪個單克隆)。以其反轉錄合成的cDNA第一鏈為Real-time PCR模板,進行BBS1基因沉默效果分析。其中熒光定量PCR數據采用2-ΔΔCt法分析。結果(圖7)表明,針對BBS1基因設計的RNAi干擾片段,確實抑制了BBS1的表達。

圖6 轉基因衣藻的PCR檢測
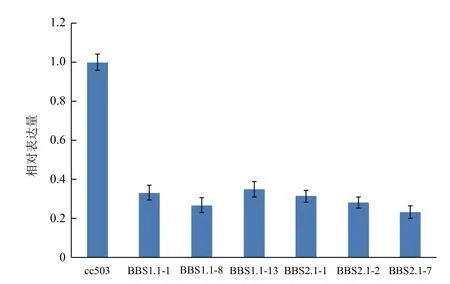
圖7 BBS1基因的mRNA表達水平
2.6 萊茵衣藻趨光性分析
分別取對數生長期的野生型CC503及轉基因萊茵衣藻,放入一定體積的培養皿中,然后用錫箔紙包嚴,只留一定大小的空隙以便光源射入,2 h后,觀察兩株系萊茵衣藻的趨光性變化。結果(圖8)顯示,本研究所設計的針對BBS1基因上兩段干擾片段的干擾效果均較好,野生型萊茵衣藻CC503絕大部分移動到靠近光源的一側,而干擾BBS1基因后的轉基因萊茵衣藻對光線不敏感。

圖8 萊茵衣藻的趨光性分析
3 討論
目前萊茵衣藻中已經有相應的RNAi載體,但其構建步驟較為繁瑣,需要多次酶切和連接才能構建成功[12,13],而且其轉化后陽性克隆子的篩選效果也不理想。本研究搭建的RNAi載體只需在靶基因片段兩段加上合適的酶切位點,克隆得到的cDNA片段再經兩次酶切與連接即可得到目的基因的RNAi載體,試驗方法簡單易行,大大節約了構建時間與實驗成本。
隨后,針對BBS1基因設計的兩個干涉片段被構建到我們所搭建的RNAi載體上,并轉化萊茵衣藻CC503。 轉化后的藻株先在固體平板上長2 d后,轉移到含有潮霉素的液體篩選培養基上再培養一周,綠色褪去后又涂在固體平板上進行篩選,長出的單克隆95%都是陽性,比未經液體培養基篩選,轉化后直接涂在固體篩選培養基上獲得的單克隆陽性率(4%)提高了幾十倍。因此該篩選方案,不僅減少了工作量,還節約了實驗成本,值得同行借鑒。
對轉化BBS1基因后的藻株進行抑制效果分析結果表明,選取的兩個干涉片段對BBS1基因均起到了明顯的抑制作用,改變了萊茵衣藻的趨光性,說明BBS1基因在調控衣藻趨光性信號通路中起著重要作用。但其如何調控衣藻趨光性信號通路,具體由哪些基因參與,尚不清楚,是我們進一步要研究的重點。我們將應用本實驗室的高通量測序平臺,對轉BBS1基因的藻株與對照進行轉錄組測序及分析,以找到其調控的信號網絡及網絡中的關鍵基因,為萊茵衣藻趨光性分子機制的闡明奠定基礎。
另外,研究發現有些BBS患者具有不同程度的嗅覺喪失,在BBS1或BBS4基因敲除掉的老鼠中嗅覺纖毛數目降低[14]。BBS蛋白位于纖毛或基體,它們參與了纖毛的組裝過程和信號傳導過程。在線蟲中,BBS蛋白是連接和協調“鞭毛內運輸”蛋白顆粒中的蛋白質A和B復合體,是纖毛形成所必需的[15]。在斑馬魚中,BBS1基因突變后,沒有影響纖毛的形成,而是影響其運動性。在衣藻中,抑制BBS5的表達,纖毛將不能形成。突變BBS1、BBS4或者BBS7 基因,破壞了衣藻的趨光性[4],但并不影響鞭毛的組裝,其趨光性的分子機制及是否影響鞭毛的運動尚未闡明,有待于進一步研究。
除此之外,本研究所構建的RNAi骨架載體直接可應用到衣藻中其它基因功能的研究,為后期進行BBS1基因所參與的信號通路中其它的功能基因的鑒定及同行進行衣藻功能基因的研究提供了寶貴的載體資源。因此,本研究具有較好的理論價值和應用價值。
4 結論
本研究成功構建了衣藻的RNAi骨架載體,并將衣藻中BBS1基因的干涉片段構建到該骨架載體上,轉化衣藻CC503;抑制了BBS1基因表達,改變了衣藻的趨光性。
[1] Goodenough UW. Green yeast[J]. Cell, 1992, 70(4):533-538.
[2] Merchant SS, Prochnik SE, Vallon O, et al. The Chlamydomonas genome reveals the evolution of key animal and plant functions[J]. Science, 2007, 318(5848):245-250.
[3] 柳林, 紀偉. 纖毛疾病和與之相關的基因[J]. 現代生物醫學進展, 2012, 12(2):373-375.
[4] Lechtreck KF, Johnson EC, Sakai T, et al. The Chlamydomonas reinhardtii BBSome is an IFT cargo required for export of specific signaling proteins from flagella[J]. The Journal of Cell Biology,2009, 187(7):1117-1132.
[5] 潘俊敏. 衣藻、纖毛與“纖毛相關疾病”[J]. 中國科學C輯:生命科學, 2008, 38(5):399-409.
[6] Oeffner F, Moch C, Neundorf A, et al. Novel interaction partners of Bardet-Biedl syndrome proteins[J]. Cell Motility and the Cytoskeleton, 2008, 65(2):143-155.
[7] Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible cosuppression of homologous genes in trans[J]. The Plant Cell,1990, 2(4):279-289.
[8] Bass BL. Double-stranded RNA as a template for gene silencing[J]. Cell, 2000, 101(3):235-238.
[9] Kusaba M. RNA interference in crop plants[J]. Current Opinion in Biotechnology, 2004, 15(2):139-143.
[10] Wesley SV, Helliwell CA, Smith NA, et al. Construct design for efficient, effective and high-throughput gene silencing in plants[J]. The Plant Journal:For Cell and Molecular Biology,2001, 27(6):581-590.
[11] Simon DF, Descombes P, Zerges W, et al. Global expression profiling of Chlamydomonas reinhardtii exposed to trace levels of free cadmium[J]. Environmental Toxicology and Chemistry / SETAC, 2008, 27(8):1668-1675.
[12] 李興涵, 費小雯, 鄧曉東. 萊茵衣藻磷酸果糖激酶RNAi載體構建及其對萊茵衣藻油脂積累的影響[J]. 廣東農業科學,2014, 10:155-159.
[13] 鄧曉東, 蔡佳佳, 費小雯. 萊茵衣藻磷脂二脂酰甘油酰基轉移酶3 在三酰甘油合成中的功能研究[J]. 水生生物學報,2014, 38(4):745-750.
[14] Kulaga HM, Leitch CC, Eichers ER, et al. Loss of BBS proteins causes anosmia in humans and defects in olfactory cilia structure and function in the mouse[J]. Nature Genetics, 2004, 36(9):994-998.
[15] Ou G, Blacque OE, Snow JJ, et al. Functional coordination of intraflagellar transport motors[J]. Nature, 2005, 436(7050):583-587.
[16] Kim YH, Epting D, Slanchev K, et al. A complex of BBS1 and NPHP7 is required for cilia motility in zebrafish[J]. PLoS One,2013, 8(9):e725.
(責任編輯 馬鑫)
Construction and Application of the RNAi Vector for BBS1 Gene in Chlamydomonas reinhardtii
Chen Lihong Li Lili Gao Lifen Zhou Junfei Li Tiantian Peng Hai
(Institute for System Biology,Jianghan University,Wuhan 430056)
Bardet-Biedl syndrome is a disease caused by mutations of various genes and associated with afunction of primary cilia. There are 12 disease-causing genes of BBS1-12 respectively. This study aimed to understand the function of BBS1 gene in Chlamydomonas reinhardtii through RNAi interference technology. Firstly, the fast and simple RNAi backbone vector was constructed. Subsequently, a cDNA in BBS1 gene was cloned into media vector pEASY-T1 using RT-PCR. After sequencing, the target fragment was inserted into the RNAi backbone vector through the twice enzyme digestion. Verified by PCR testing, enzyme digestion and sequencing, the RNAi vector of BBS1 gene was successfully constructed. The phenotype of transgenic C. reinhardtii CC503 transformed into BBS1 RNAi plasmid by gene gun was significantly different from that of the control and their phototaxis changed compared to the control.
Chlamydomonas reinhardtii;RNAi vector;BBS1 gene;phototaxis
10.13560/j.cnki.biotech.bull.1985.2015.07.016
2014-11-12
武漢市人力資源和社會保障局“衣澡冷適應的系統生物學研究”項目
陳利紅,女,博士,助理研究員,研究方向:植物分子生物學;E-mail:clh101@126.com
彭海,男,博士,副教授,研究方向:分子遺傳學;E-mail:penghai138@163.com

