低溫下饑餓脅迫對大黃魚血清生化指標的影響
徐浩張東玲陳慶凱葉坤王志勇
(1. 集美大學水產學院 農業部東海海水健康養殖重點實驗室,廈門 361021;2. 福建省寧德市水產技術推廣站,寧德 352100)
低溫下饑餓脅迫對大黃魚血清生化指標的影響
徐浩1張東玲1陳慶凱2葉坤1王志勇1
(1. 集美大學水產學院 農業部東海海水健康養殖重點實驗室,廈門 361021;2. 福建省寧德市水產技術推廣站,寧德 352100)
研究了在低溫(13℃)下饑餓脅迫對9月齡大黃魚血清生化指標的影響。將400尾大黃魚隨機分成兩組,一組為實驗組,不投喂飼料;另一組為對照組,定時投喂飼料。實驗開始30 d后,測定大黃魚11種血清生化指標。結果顯示,實驗組大黃魚血清的尿酸(UA)、尿素(UREA)、總膽固醇(TC)、谷丙轉氨酶(ALT)含量極顯著高于對照組(P<0.01),甘油三酯(TG)、鈣離子(Ca2+)含量顯著高于對照組(P<0.05);而白蛋白(ALB)、谷草轉氨酶(AST)含量極顯著低于對照組(P<0.01);血糖(GLU)、總蛋白(TP)、鎂離子(Mg2+)含量在實驗組與對照組之間則無顯著性差異。實驗組血清中的蛋白質代謝產物和脂類物質明顯高于對照組,但是血糖和總蛋白含量沒有顯著差異。
低溫;饑餓脅迫;大黃魚(Larimichthys crocea);血清生化指標
大黃魚(Larimichthys crocea Richardson)隸屬于鱸形目(Performs)、石首魚科(Sciaenidae)、黃魚屬(Larimichthys),俗稱黃魚、黃瓜魚、黃花魚等,為暖溫性、集群洄游性的中下層魚類,南至南海雷州半島、北達山東半島均有分布。大黃魚肉質細膩鮮美、高蛋白、低膽固醇,富含EPA、DHA等高度不飽和脂肪酸,是我國傳統的高價值經濟魚類[1]。大黃魚生長的適應溫度為13-33℃,最適生長溫度為18-25℃,海水溫度低于13℃或高于33℃,都將影響大黃魚的攝食、生長和繁殖[2]。大黃魚的生長受到許多外界環境因素的影響,如水溫、溶氧等,對于越冬期的大黃魚而言,低溫往往會對其造成大面積的凍傷,從而引起大量死亡[3-5]。
血液是水產動物體內循環系統的重要組成部分,具有生理調節、生理防御、物質運輸等功能,而且是衡量魚類健康及營養情況、攝食與代謝情況、外界環境適應情況等的直接和重要的生理生化指標,同時也為研究動物生理提供重要的參考依據[6]。魚類對低溫、饑餓等外界脅迫的適應性具有階段性,在受到脅迫的初期,魚類會利用自身調節來抵抗和適應外界環境,魚體的異常情況無法檢測[7]。但是相對長期的脅迫,會對魚體的血液生化指標產生明顯的影響,這為了解魚體的生理狀況提供了直接的依據[8]。國內外研究者針對溫度和饑餓脅迫對血液生化指標的影響已有一些報道[9-11],但有關低溫下饑餓脅迫對大黃魚血液生化指標的影響未見報道。
本研究通過測定大黃魚血液中蛋白含量、血糖、酶活、無機鹽離子等的含量,分析低溫下饑餓脅迫對大黃魚血液生化指標的影響,為大黃魚越冬期是否投喂提供科學依據。
1 材料與方法
1.1 材料
實驗用大黃魚于2013年2月采自福建寧德市橫嶼島水產有限公司養殖漁排,所有的實驗魚來自同一養殖網箱。選擇健康、魚體表面無創傷的大黃魚400尾,體重為(60±12)g,體長為(13±3)cm。
1.2 方法
實驗魚從海區網箱中取回后在養殖場水泥池中暫養一周,水溫為(13±0.5)℃,每天7:00換水一次,每日8:00和16:00各投一次,投喂量占大黃魚總質量的1%,并且及時清理殘餌,防止水質惡化。暫養后,將400尾大黃魚隨機分成實驗組和對照組,每組各200尾,每組設置3個平行,每個平行60尾魚,剩下的大黃魚放回大池養殖。實驗組不投喂飼料,對照組按照暫養期間的方式投喂。在13℃溫度下養殖30 d后取樣,每平行分別采集20尾大黃魚的血液。
采樣前將大黃魚用丁香酚進行麻醉,以減少采樣時人為操作對實驗的影響。采取尾靜脈取血的方法,將血液放置在4℃冰箱中靜置4-6 h后離心(5 000 r/min)10 min,小心吸取上層血清-80℃保存待用,以測量血清中的總蛋白(TP)、白蛋白(ALB)、血糖(GLU)、甘油三酯(TG)、總膽固醇(TC)和無機鈣離子(Ca2+)、鎂離子(Mg2+)等生化指標。
1.3 血清生化指標的測定
血清生化指標使用BS-180生化分析儀(深圳邁瑞生物醫療電子股份有限公司),所用的試劑盒也購自深圳邁瑞生物醫療電子股份有限公司。
1.4 數據處理
采用SPSS 17.0進行獨立性t檢驗處理實驗數據,實驗數據均寫成平均數x-±s標準差的形式。
2 結果
2.1 血清中血糖、脂類及蛋白質代謝產物含量的比較
結果如圖1所示,實驗組大黃魚的血糖(GLU)與對照組沒有顯著性差異;而實驗組的總膽固醇(TC)和尿酸(UA)、尿素(UREA)極顯著高于對照組(P<0.01),甘油三酯(TG)的含量顯著高于對照組(P<0.05)。
2.2 血清中蛋白質含量與酶活性的比較
如圖2所示,饑餓脅迫30 d后,實驗組的總蛋白(TP)含量與對照組相比無顯著性差異,而白蛋白(ALB)含量要顯著低于對照組(P<0.05)。就血清酶活性而言,實驗組的谷丙轉氨酶(ALT)活性極顯著高于對照組(P<0.01),相反,谷草轉氨酶(AST)活性極顯著低于對照組(P<0.01)。
2.3 血清中無機物離子含量的比較
低溫下長期的饑餓脅迫對大黃魚血清無機鹽離子含量的影響如圖3所示,實驗組的血清鈣離子(Ca2+)含量顯著高于對照組(P<0.05),而鎂離子(Mg2+)含量與對照組無顯著性差異(P>0.05)。
3 討論
糖類、脂類、蛋白質和無機鹽離子是血清的重要組成成分,這些成分含量變化也反映了魚類生理狀態。血糖(GLU)是生物體內重要的能源物質,短期的饑餓脅迫會使魚類的血糖降低,而本研究中長期的饑餓脅迫下,實驗組和對照組的大黃魚血糖并未出現顯著性差異,這可能是因為魚類是變溫動物,低溫下魚類需要很少的能量就可以維持正常的生命活動,同時魚體內的脂肪和蛋白質經過糖異生途徑轉化成葡萄糖,使血糖濃度維持在相對穩定的狀態[12]。
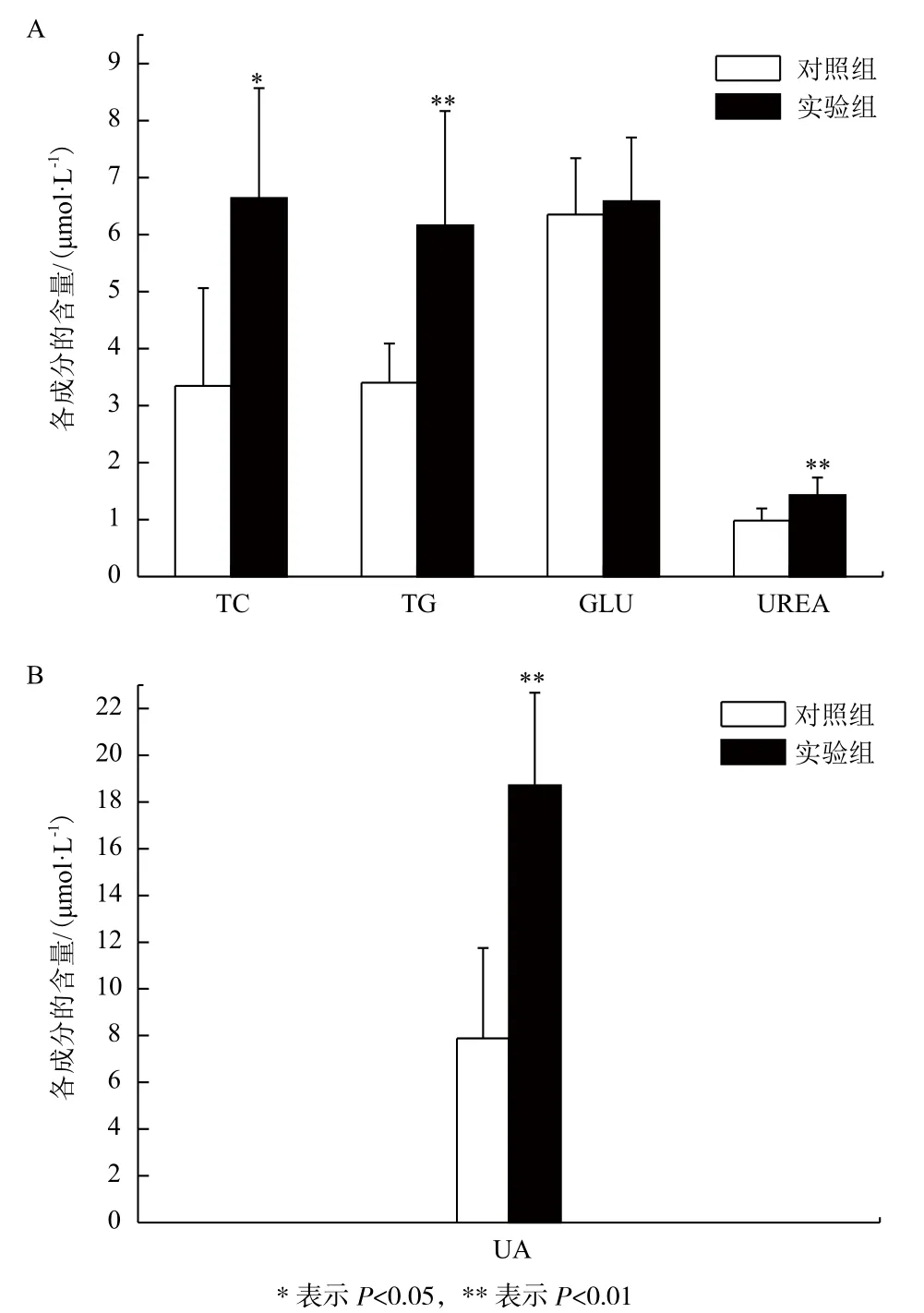
圖1 饑餓脅迫下各組之間血糖、脂類、蛋白質代謝產物的比較
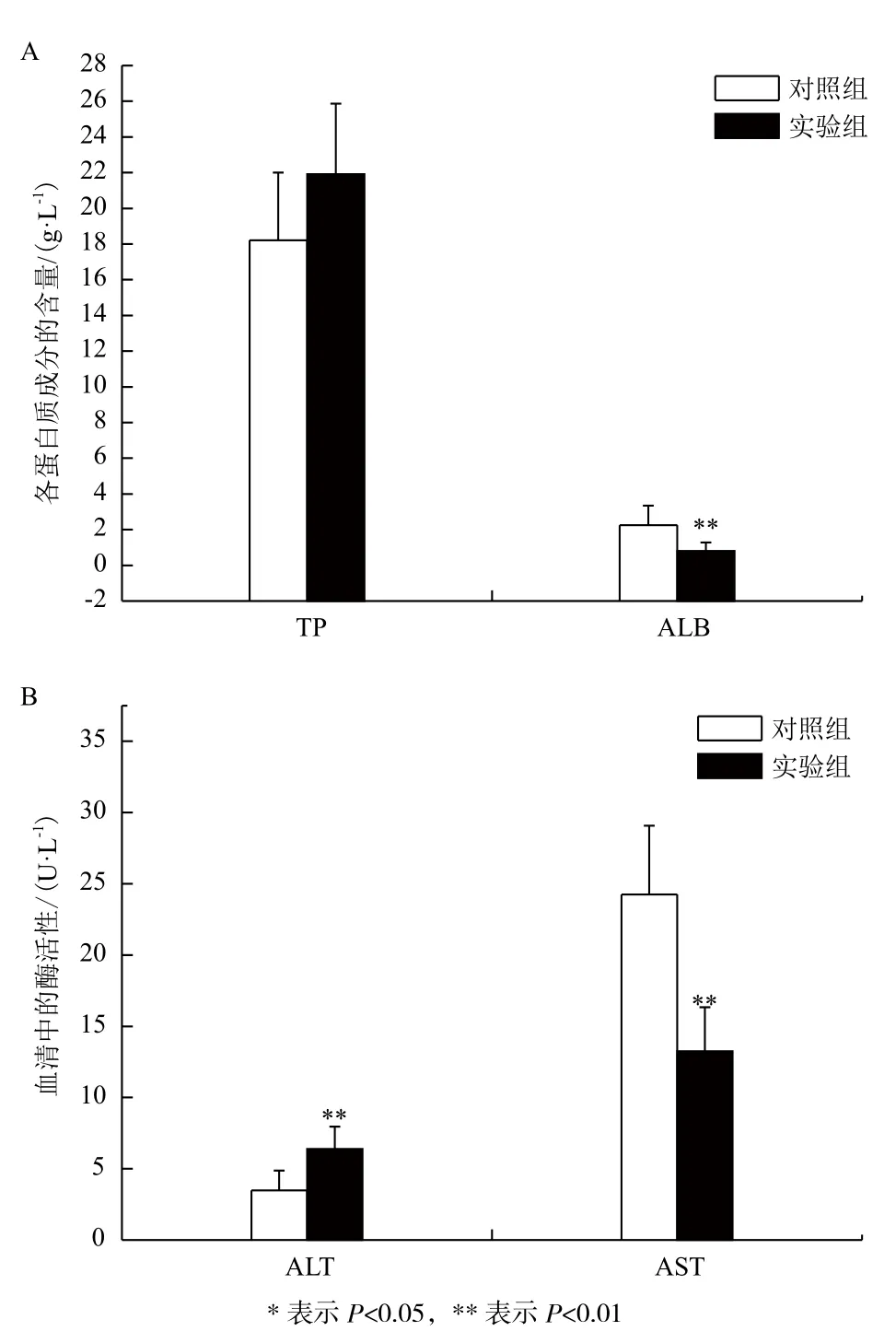
圖2 血清中蛋白質成分含量及酶活性的比較
膽固醇是血液中脂蛋白的重要組成成分,使得蛋白質可以在血液中運輸。它還是細胞膜的主要成分,對穩定細胞膜的正常功能起到了關鍵作用[13]。本研究中實驗組大黃魚的血清膽固醇含量極顯著高于對照組,這可能是由于糖異生途徑是在肝臟中進行,而實驗組大黃魚蛋白質糖異生作用增強,血清中起運輸功能的膽固醇也會明顯增多[14]。甘油三酯是魚類體內儲能的主要形式,同時也是魚類御寒的主要物質[15]。短時間的饑餓脅迫會使大黃魚血清的甘油三酯含量顯著降低[16],但是本研究經過長時間的饑餓脅迫,實驗組大黃魚血清的甘油三酯含量顯著高于對照組,這可能與脂肪的糖異生途徑有關系,組織中的甘油三酯通過血液進入肝臟中,作為能源物質被消耗。
血清中的蛋白質也是魚類重要的生化指標,直接反映了魚體的健康狀況和代謝水平。血清中的總蛋白主要是維持血漿膠體滲透壓及pH值,同時也具有免疫、運輸、營養等功能[17]。其中白蛋白主要起到了營養的作用[18]。本研究結果顯示,實驗組大黃魚的血清總蛋白與對照組無顯著差異,而實驗組的血清白蛋白極顯著低于對照組,這可能是由于白蛋白為提供能量而大量被消耗。血清酶是反映機體健康水平的重要生化指標,在正常情況下,血清酶主要在細胞中,在血清中的含量相對較低且穩定,當組織細胞受到一些環境或者其它因素的影響受損,大量的轉氨酶會進入血液中,血清中的ALT和AST含量明顯升高[19]。其中,ALT主要存在于肝臟細胞中,是肝臟損傷水平的重要指標[20]。長期的饑餓脅迫使肝臟受損,從而實驗組大黃魚血清ALT極顯著高于對照組;AST主要存在于心肌細胞中,它反映了心肌的受損程度[8],本研究中實驗組的AST含量極顯著低于對照組,可能是由于低溫下攝食,大黃魚的活動強度增加,這反而增加了心臟的負擔,使心肌細胞受損。
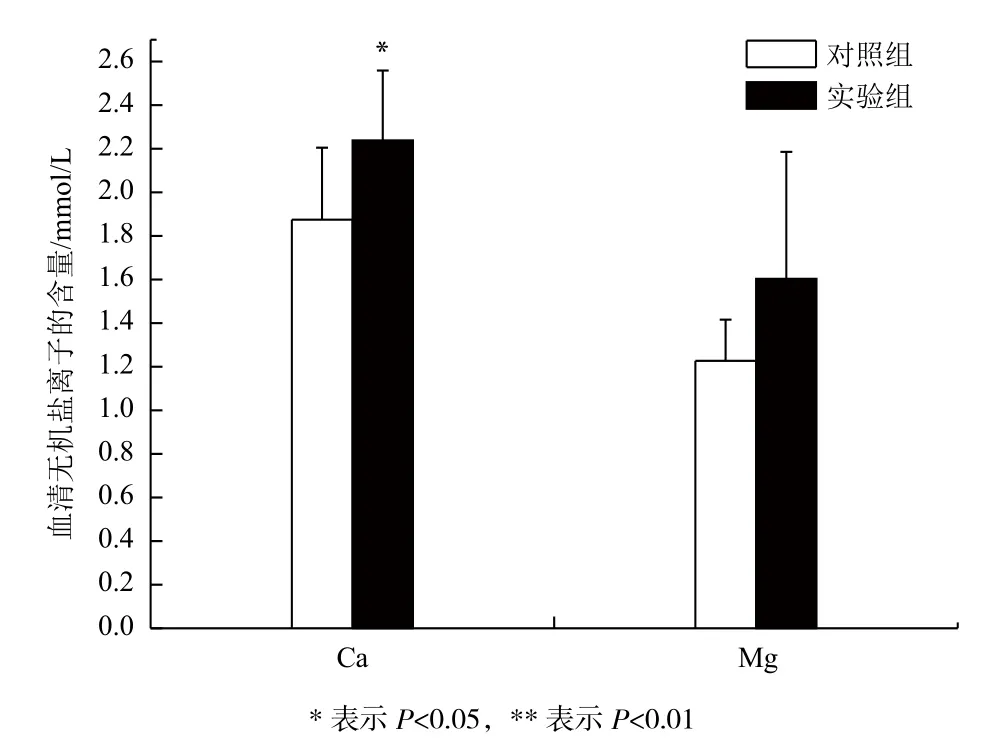
圖3 血清中無機鹽離子含量的比較
血清的無機鹽離子是調節體液滲透壓、維持酸堿平衡的重要因素,與血清中的有機成分相比,無機鹽離子對外界環境的改變并不敏感,而且影響因素也較多[21]。其中,Ca2+和Mg2+是血清中必不可少的部分,血清Mg2+是多種酶的激活劑,參與了多種生理生化反應;血清Ca2+在脂肪代謝過程中起到了重要的作用[22-26]。本研究實驗組中的血清Mg2+與對照組沒有顯著性差異,而實驗組的血清Ca2+要顯著高于對照組,這可能是由于脂肪代謝過程中脂肪細胞內的大量Ca2+外流,從而導致血清Ca2+含量升高。
總之,低溫下,飽食投喂增加了大黃魚在低溫下的活動,影響其心臟功能;不投喂則會增強糖異生途徑,增加大黃魚肝臟的負擔。根據大黃魚養殖業者的經驗,在冬季低溫期到來之前提前停止投喂飼料有助于提高養殖大黃魚越冬成活率,表明低溫下飽食投喂對大黃魚生理機能的影響大于饑餓造成的影響。對于這些影響及其機理進行深入細致地研究,不僅可以為越冬期養殖大黃魚的管理提供理論依據,也可以豐富魚類生理學研究資料,具有顯著的理論意義。
4 結論
本研究利用低溫下饑餓處理的大黃魚,測定其11種血清生化指標,實驗結果顯示,低溫下饑餓脅迫對大黃魚各項血清生化指標產生了不同程度的影響,并一定程度影響了大黃魚肝臟的功能。
[1] 蘇永全. 大黃魚養殖[M]. 北京:海洋出版社, 2004.
[2] 王武. 魚類增養殖學[M]. 北京:中國農業出版社, 2000.
[3] 汪卯全. 低溫冰凍引起的魚類病害及對策[J]. 中國水產,2009(2):55-56.
[4] 胡玉珍. 低溫選擇大黃魚子代SSR分析及越冬季節生理生化指標變化[D]. 寧波:寧波大學, 2011.
[5] 阮成旭, 吳德峰, 袁重桂. 溫度對大黃魚(Pseudosciaena crocea)幼魚生長和養殖水質的影響[J]. 廣州大學學報:自然科學版, 2013(2):36-39.
[6] 周玉, 郭文場, 楊振國, 等. 魚類血液學指標研究的進展[J].上海水產大學學報, 2001(2):163-165.
[7] Ishioka H. Series of Fisheries Book[M]. Tokyo:Kosesha Kosekaku, 1982.
[8] 冀德偉, 李明云, 王天柱, 等. 不同低溫脅迫時間對大黃魚血清生化指標的影響[J]. 水產科學, 2009(1):1-4.
[9] 陳曉鵬. 饑餓對黑鯛(Sparus macroephalus)血液指標的影響[J].水產科技, 2008(4):19-25.
[10] 陳智. 低溫脅迫對荷那龍羅非魚血液生理生化指標的影響[D]. 湛江:廣東海洋大學, 2011.
[11] 劉波, 何慶國, 唐永凱, 等. 饑餓脅迫對吉富羅非魚生長及生理生化指標的影響[J]. 中國水產科學, 2009(2):230-237.
[12] 陳超, 施兆鴻, 薛寶貴, 等. 低溫脅迫對七帶石斑魚幼魚血清生化指標的影響[J]. 水產學報, 2012, 36(8):1249-1255.
[13] Levels C. The effect of aggressive lowering of low-density lipoprotein cholesterol levels and low-dose anticoagulation on obstructive changes in saphenous-vein coronary-artery bypass grafts[J]. 1997,
[14] 石桂城, 董曉慧, 陳剛, 等. 飼料脂肪水平對吉富羅非魚生長性能及其在低溫應激下血清生化指標和肝臟脂肪酸組成的影響[J]. 動物營養學報, 2012, 24(11):2154-2164.
[15] 常玉梅, 曹鼎臣, 孫效文, 等. 低溫脅迫對鯉血清生化指標的影響[J]. 水產學雜志, 2006, 19(2):71-75.
[16] 朱站英, 華雪銘, 于寧, 等. 草魚蛋白質和脂肪代謝對饑餓脅迫的響應[J]. 水產學報, 2012(5):756-763.
[17] Luk'ianenko VI, Khabarov MV, Luk'ianenko VV. Heterogeneityand polymorphism of functionally specialized blood proteins in migratory fish:The case study of the North Caspian population of the Russian sturgeon during sea and river periods of life. 1. Albumins[J]. Biology Bulletin of the Russian Academy of Sciences, 2002, 29(3):293-299.
[18] 馮廣朋, 莊平, 章龍珍, 等. 溫度對中華鱘幼魚血液生化指標的影響[J]. 生態學雜志, 2010(10):1973-1978.
[19] 蔡林婷, 李思源, 葛明峰, 等. 3種致病弧菌感染對大黃魚血液生化指標的影響[J]. 漁業科學進展, 2013, 34(2):66-72.
[20] Srivastava AR, Kumar S, Agarwal GG, et al. Blunt abdominal injury:serum ALT-A marker of liver injury and a guide to assessment of its severity[J]. Injury, 2007, 38(9):1069-1074.
[21] 鄭宗元, 黃朝芳, 葉元土, 等. 11 種礦物元素對斑點叉尾鮰 魚種生長的影響[J]. 內陸水產, 2001, 9:3-5.
[22] Luke A. Roy, 劉興旺. 低鹽度水體中不同鉀、鎂離子水平對南美白對蝦成活、生長及呼吸代謝的影響[J]. 飼料與畜牧,2010(6):8-12.
[23] 侯文杰, 臧維玲, 劉永士, 等. 鹽度及鈣鎂離子含量對對蝦消化酶及免疫酶的影響[J]. 江蘇農業科學, 2013(7):222-225.
[24] 張靈燕. 鈣鎂離子濃度及鹽度馴化對褐牙鲆幼魚血清滲透壓的影響及其滲透調節機制的研究[D]. 青島:中國海洋大學,2010.
[25] Bucher HC, Cook RJ, Guyatt GH, et al. Effects of dietary calcium supplementation on blood pressure:a meta-analysis of randomized controlled trials[J]. Jama, 1996, 275(13):1016-1022.
[26] Price PA, Faus SA, Williamson MK. Warfarin-induced artery calcification is accelerated by growth and vitamin D[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2000, 20(2):317-327.
(責任編輯 李楠)
Effects of Starvation on Serum Biochemical Indexes in Large Yellow Croaker(Larimichthys crocea)at Low Temperature
Xu Hao1Zhang Dongling1Chen Qingkai2Ye Kun1Wang Zhiyong1
(1. Key Laboratory of Mariculture in the East China Sea of Ministry of Agriculture,Fisheries College,Jimei University,Xiamen 361021;2. Fishery Technical Extension Station of Ningde City,Ningde 352100)
The study was conducted to investigate the effects of starvation on serum biochemical indexes in 9-month-old large yellow croaker(Larimichthys crocea)at low temperature(13℃). Four hundred fishes were randomly divided into 2 groups, one group as control group was fed with formula feed, and the other as experimental group was starved. Eleven serum biochemical indexes were examined 30 d after experiment started. The results revealed that the UA, UREA, TC, and ALT of experimental group were extremely significantly higher than control group(P < 0. 01);while the ALB and AST of experimental group were extremely significantly lower than control group(P < 0. 01). Compared to control group, the TG and Ca2+of experimental group were significantly higher(P < 0. 05). There was no significant difference in both TP and Mg2+between experimental and control group.
low temperature;starvation;large yellow croaker(Larimichthys crocea);serum biochemical indexes
10.13560/j.cnki.biotech.bull.1985.2015.06.031
2014-10-10
國家自然科學基金重點支持項目(U1205122),福建省高校產學研重大專項(2011N5010)
徐浩,男,碩士研究生,研究方向:水產生物遺傳育種;E-mail:xh4513377@gmail.com
王志勇,教授,博士生導師,研究方向:水產養殖遺傳育種學,水產生物技術;E-mail:zywang@jmu.edu.cn

