食用傘菌海藻糖代謝相關基因調控及生物工程應用
劉建輝,尚曉冬,李亞鵬,趙 妍,譚 琦,*
(1.農業部應用真菌資源與利用重點開放實驗室,國家食用菌工程技術研究中心,上海市農業遺傳育種重點實驗室,上海市農業科學院食用菌研究所,上海201403;2.上海海洋大學食品學院,上海201306)
食用傘菌海藻糖代謝相關基因調控及生物工程應用
劉建輝1,2,尚曉冬1,*,李亞鵬1,2,趙 妍1,譚 琦1,2,*
(1.農業部應用真菌資源與利用重點開放實驗室,國家食用菌工程技術研究中心,上海市農業遺傳育種重點實驗室,上海市農業科學院食用菌研究所,上海201403;2.上海海洋大學食品學院,上海201306)
海藻糖是一種能夠在外界脅迫條件下發揮其特殊抗逆保護作用的二糖,廣泛分布于古細菌、細菌、真菌及動植物體內。該文對海藻糖的理化性質及其生物學特性作了簡要的概述,介紹了食用傘菌中海藻糖合成代謝途徑及其相關酶基因調控的研究進展,對食用傘菌中與海藻糖代謝相關酶基因在生物工程中的應用進行了展望。
海藻糖,食用傘菌,代謝,調控,生物工程
海藻糖(α,α-trehalose)由兩個α,α-1,1糖苷鍵連接的葡萄糖單元組成,是一種結構穩定的非還原性雙糖,在自然界中分布廣泛。在早期人們認為海藻糖只是一種貯藏性糖類,直到1985年,才逐漸發現其具有許多異于其他雙糖的特殊作用,海藻糖能夠作為一種高效保護物質,幫助細胞成分抵抗外界不利條件,如饑餓、高溫、冷凍、干燥、高滲透壓、重金屬和有毒試劑等。在脅迫條件下,胞內海藻糖含量迅速上升,保護多種生物大分子,從而保護生命本身[1-2]。而無論是生物體內的海藻糖,還是外源性海藻糖,對生物體和生物大分子都有非特異性的保護作用,存在潛在的研究及工業應用價值,因此海藻糖已成為當今國際研究和開發的熱點。國外研究較為深入,包括海藻糖的作用機制、代謝調控途徑和應用研究等;國內多集中在海藻糖的功能和提取工藝上。然而至今國內外對海藻糖的研究多集中在植物、昆蟲、細菌及酵母菌中,而應用于食用傘菌的研究相對較少,主要在白靈側耳(Pleurotus eryngii var.tuoliensis)[3]、草菇(Volvariella volvacea(Bull.:Fr.)Sing.)[4]、灰樹花(Grifola frondosa(Dicks.)Gray)[5]、糙皮側耳(Pleurotus ostreatusJacq.)[6]、裂褶菌(Schizophyllum commune Fr.)[7]、鳳尾菇(Pleurotus sajor-caju(Fr.)Singer)[8]等上有部分報道。食用傘菌正常生長發育過程十分復雜,需要受到外界脅迫刺激及調控,而海藻糖的代謝及相關酶基因調控的研究,對于揭示其生長發育過程中的抗逆機制及對極端環境的適應機制具有重要作用。本文對食用傘菌中海藻糖的代謝途徑與相關酶基因調控機制進行了綜述,旨在了解其中海藻糖的代謝調控因子及機制,從而為食用傘菌的栽培工藝提供參考,實現其進一步應用。
1 海藻糖的特性
1.1 海藻糖的理化特性
海藻糖是W iggers于1832年從黑麥麥角菌中首次發現的。隨后法國化學家Berthelot在小亞細亞沙漠里一種象鼻蟲分泌的糖蜜中也發現了該糖,并將其命名為海藻糖[9]。從那以后在大量有機體中都發現了海藻糖的存在,包括嗜極古細菌、細菌、藻類、酵母、絲狀真菌、植物、昆蟲和其他無脊椎動物。海藻糖由兩個吡喃環葡萄糖分子連結而成,是一種穩定的非還原性二糖。1930年Bredereck首先利用核磁共振技術闡明了海藻糖的化學結構,化學名為α-D-吡喃葡萄糖基-α-D吡喃葡萄糖苷(α-D-glucopyranosyl-α-D-glucopyranoside),其分子式為C12H22O11·2H2O,相對分子量為378.33。其分子結構對稱,分子結構式如圖1所示。
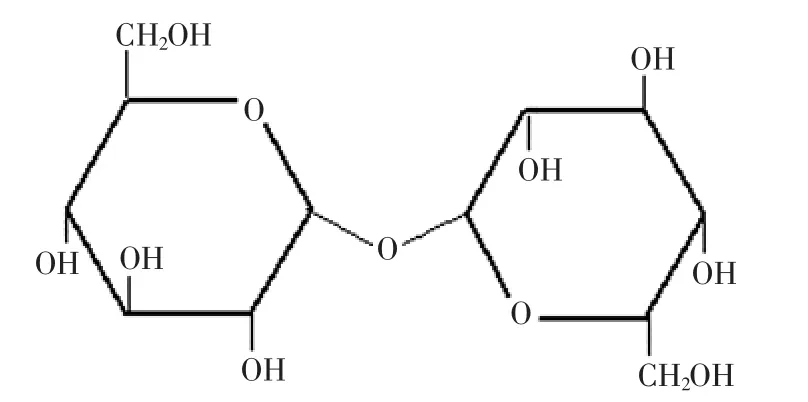
圖1 α,α-型海藻糖構象式Fig.1 Structure ofα,α-trehalose
在α-D吡喃葡萄糖中,由一個氧原子和五個碳原子形成一個六元環,這種六元結構是很穩定的。而成環之后在1號位形成了半縮醛羥基,羥基的化學性質非常活潑,通過1,1糖苷鍵的連接,兩個吡喃葡萄糖分子結合成為α,α-海藻糖,因此其理化性質十分穩定,是天然雙糖中最穩定的。并且海藻糖無毒性,無色無臭,口感稍帶甜味,低熱值,具有明顯的化學惰性和極強的穩定性。
1.2 海藻糖的生物學作用
早期研究發現,在真菌及其孢子萌發的最初階段,海藻糖可以作為能量的來源[10]。在昆蟲中,海藻糖存在于血液內,作為提供飛行能量的主要糖分[11]。近些年來,有很多研究者認識到許多生物體在外界脅迫條件下(如饑餓、脫水、干旱、高溫、冷凍、高滲透性、重金屬及有毒試劑等),都能通過調節胞內海藻糖的合成,保護生物體本身,抵御外界不良環境的傷害[12-14]。而且少量外源海藻糖就可顯著提高細胞抗脅迫的能力[15]。大量研究結果表明[16],海藻糖對生物體的這種保護作用主要是由于它可以非特異地穩定細胞內生物膜、蛋白質和核酸等生物大分子的結構。
海藻糖是一種典型的應激代謝產物。當生物體生長環境良好時,體內不積累海藻糖;而當生物體處于脅迫環境時,體內就會迅速積累海藻糖[12,17],而且這些海藻糖會隨著不良環境的解除而被降解。海藻糖合酶基因是繼谷氨酸、脯氨酸、甜菜堿合成酶基因之后又一個與抗逆相關的基因[18]。Elena Garre和Em ilia Matallana[19]的研究表明,釀酒酵母(Saccharomyces cerevisiae H.)中存在三種海藻糖酶Nth1p,Nth2p和Ath1p參與細胞內海藻糖的轉移,胞內海藻糖有助于鹽滲透后細胞的恢復。劉秀明等[3]通過測定白靈側耳熱敏感型菌株和耐熱性菌株經高溫脅迫后恢復培養期間,菌絲體內海藻糖代謝相關酶活性和基因相對表達量的變化,研究海藻糖代謝途徑的應激響應;發現高溫脅迫后恢復培養期間,海藻糖含量迅速降至對照水平,合成海藻糖方向海藻糖磷酸化酶(Trehalose phosphorylase,TreP)活性急劇下降,6-磷酸海藻糖合成酶(trehalose-6-phosphate synthase,TPS)活性和6-磷酸海藻糖合成酶基因(tps1)表達量顯著增加,降解海藻糖的酶被激活,參與海藻糖的降解。Kong等[20]對白靈側耳熱激后,探究NO對海藻糖積累的調控,結果發現在溫度刺激下,杏鮑菇菌絲中海藻糖的積累與外源NO有關,熱激可能是通過調控NO的調控途徑從而調控海藻糖積累的。
內源性海藻糖在外界脅迫條件下保護生物體起到了關鍵的作用,而外加的海藻糖對蛋白質、酶與細胞膜等活性物質也均有明顯的保護作用[21]。Kong等[20]也證實了通過外源海藻糖處理,可以顯著緩解高溫脅迫對白靈側耳的氧化脅迫損傷。劉秀明等[22]通過對外源海藻糖對高溫脅迫下白靈側耳氧化損傷的緩解效應的研究,發現外源海藻糖處理可以顯著降低高溫脅迫下菌絲體內產生速率、H2O2含量、脂氧合酶(LOX)活性和巴比妥酸鹽反應物質(TBARS)含量水平,緩解高溫脅迫所引發的氧化損傷;另外,外源海藻糖對超氧化物歧化酶(SOD)活性有保護和提高的作用,對過氧化氫酶(CAT)和抗壞血酸過氧化物酶(APX)活性有抑制作用,對過氧化物酶(POD)活性影響不明顯。王永紅等[4]研究了海藻糖溶液對草菇(Volvariella volvacea(Bull.:Fr.)Sing.)菌種低溫保藏的效果,結果表明不耐受低溫的草菇菌種在海藻糖溶液的保護下,能夠在4~6℃下存活至少8個月以上,而未經海藻糖溶液保護的草菇菌種會自溶而導致死亡;而且經過了海藻糖溶液低溫保護的草菇菌種分泌的次生代謝產物及基因指紋圖譜都沒有發生改變;采用海藻糖溶液保護的草菇菌種,在4~6℃低溫下保藏8個月后活化,活化后的菌種采用清水低溫保藏,1個月后仍然具有生存活性,并能產生厚垣孢子。
2 食用傘菌海藻糖代謝途徑及其相關酶基因調控
雖然海藻糖代謝過程中只涉及到幾種代謝產物和相關酶反應,但是其調節和控制機制卻是相當的復雜。傘菌中海藻糖的合成途徑有兩種,一是TPS/TPP途徑,另一個是日本學者在擔子菌灰樹花中發現的TreP途徑[5]。
2.1 合成代謝途徑及相關酶基因調控
2.1.1 TPS/TPP途徑 所謂TPS/TPP途徑,是指由6-磷酸海藻糖合成酶(trehalose-6-phosphate synthase,TPS)催化尿苷二磷酸(Uridine Diphosphate,UDP)葡萄糖和6-磷酸葡萄糖合成6-磷酸海藻糖(Trehalose-6-phosphate,T6P),再在6-磷酸海藻糖磷酸酯酶(Trehalose-6-phosphate phosphatase,TPP)作用下,將6-磷酸海藻糖去磷酸化生成海藻糖和無機磷酸的生物學過程[23],反應式如下:

在單核生物中,編碼這些酶的基因只有單一的操縱子,而且在真核生物中是多基因操縱[24]。在真菌體內,6-磷酸海藻糖合成酶(TPS)和6-磷酸海藻糖磷酸酯酶(TPP),兩種酶形成了復合物,是由tps1,tps2,tps3和tsl1 4種基因編碼形成的復合單元。編碼6-磷酸海藻糖合成酶(TPS)和6-磷酸海藻糖磷酸酯酶(TPP)兩種酶的基因分別為tps1和tps2。tps1和tps2具有合成海藻糖的催化活性,而tps3和tsl1對于整合海藻糖合成酶復合物和在沒有明顯酶活時的調控具有重要的作用[25],即tsl1和tps3編碼的蛋白起穩定基因復合體的作用。通過研究6-磷酸海藻糖合成酶(TPS)和6-磷酸海藻糖磷酸酯酶(TPP)的系統發生學關系,發現它們是共同演化的,具有同源性。
6-磷酸海藻糖合成酶(TPS)是反應的關鍵酶,不僅作為代謝酶也作為壓力調控者。除了在海藻糖的生物合成中起作用,TPS也能夠控制糖原進入糖酵解和糖誘導的信息傳遞。許多基因被大量誘導表達是細胞處于逆境時的一個顯著特征[26],通過研究這些基因的啟動子發現,至少有一個順式反應元件存在于啟動子中,稱之為逆境應答元件(stress responsive element,簡稱STRE)或熱激反應元件(heat shock element,簡稱HSE),這些元件的核心序列為CCCCT或AGGGG。這些元件會受到轉錄激活蛋白Msn2p/ Msn4p的正調控[27]。在應激反應中,并不是所有的STRE都參與其中,一般只有一個STRE起作用,并且只有在其他的順式或反式作用因子的作用下,STRE才能受到Msn2p/Msn4p的正調控。此外,這些順式或反式作用因子還決定了參與海藻糖代謝途徑所需要基因的特異性。張芳[28]通過對南極低溫酵母Guehomyces pullulans 17-1菌株中的tps1分析發現,在它的啟動子中存在2個HSE和1個STRE應激反應元件的核心序列,所以推測當G.pullulans 17-1菌株處于高溫、低溫逆境環境時,tps1基因也會被誘導表達,幫助細胞抵御不良環境的影響。
由于在食用菌中關于海藻糖合成酶相關基因的克隆、表達及其調控研究較少,但是通過借鑒酵母菌中的相關研究,也能找到食用菌中代謝調控的研究方向。Fang Zhang等[29]指出,當G.pullulans 17-1菌株處于25℃高溫培養下,菌體內海藻糖含量、TPS酶活及tps1基因的相對表達量明顯升高;而在10℃低溫培養下,菌體內海藻糖含量、TPS酶活及tps1基因的相對表達量比在15℃培養下的菌體低。所以對G.pullulans 17-1菌株來說,海藻糖在抵御高溫脅迫時具有重要的作用。Ming-Zhe An等[30]通過構建tps1過表達載體的酒精發酵酵母菌株,在酒精發酵條件下,TPS的活性及海藻糖的含量顯著升高,而且生長的臨界溫度由36℃升高到了42℃,說明tps1基因的過表達對于提高菌株耐熱性有顯著的影響。在酵母中發現,海藻糖生物合成的中間介質6-磷酸海藻糖,能夠調控糖酵解過程中葡萄糖的代謝流[8]。
人們普遍認為,6-磷酸海藻糖合成酶(TPS)是反應的關鍵,對于6-磷酸海藻糖磷酸酯酶(TPP)的基因表達量、酶性質等的研究還比較少。僅有Sang-Eun Han[31]在研究鳳尾菇中海藻糖磷酸化酶時,構建了tps1、tps2突變體及雙突變體,結果表明tps1突變體、雙突變體在葡萄糖上不能生長;tps2缺失突變體能夠在葡萄糖上生長;而擁有空質粒的轉化子也不能在葡萄糖上生長。說明只有6-磷酸海藻糖磷酸酯酶(TPP)存在的情況下,是不能利用葡萄糖的。
2.1.2 TreP途徑 所謂TreP途徑,是由海藻糖磷酸化酶(Trehalose phosphorylase,TreP)催化D-葡萄糖與1-磷酸-α-D葡萄糖合成海藻糖。該反應是可逆性反應。其反應過程如下:

日本學者Saito K從擔子菌灰樹花中發現了一種新的海藻糖合成酶(Trehalose synthase,TSase),該酶也可特異利用D-葡萄糖與1-磷酸-α-D葡萄糖合成海藻糖[5]。TSase實際上也是一種海藻糖磷酸化酶(TreP),因為它也可以催化上述反應的逆反應,即通過磷酸化作用分解海藻糖。隨后研究學者在多種食用真菌中發現此酶,之后便對這種酶的特性進行了進一步研究。
A lexandra Schwarz等[6]研究了糙皮側耳中海藻糖磷酸化酶的特性及α-α海藻糖合成的應用。通過變性聚丙烯酰胺凝膠電泳(SDS-PAGE)技術,提取自糙皮側耳的海藻糖磷酸化酶的分子量大約在55ku,分解和合成海藻糖的最適pH分別為6.8和6.2。在缺乏前體物質α-α海藻糖、甘油和聚乙二醇及溫度為30℃的情況下,海藻糖磷酸化酶的半衰期(half-life)大約為1h。
Christian EIS等[7]研究了裂褶菌中真菌海藻糖磷酸化酶的動力學機制、反應的pH相關性和一些結構特性。研究發現海藻糖磷酸化酶擁有有序的BiBi動力學機制,即磷酸鹽在生成α-α海藻糖之前形成,而α-D-葡萄糖在α-D-1-磷酸葡萄糖之前形成。在高pH及低pH下正反應和逆反應的最大反應速率及催化效率都有所下降,其相對pK值(平衡常數的負對數)分別為7.2~7.8和5.5~6.0。而且每個海藻糖磷酸化酶分子中都含有Mg2+。
Sang-Eun Han[8]對鳳尾菇中編碼海藻糖磷酸化酶的基因(PsTP)進行了克隆及其特性分析,實驗發現該基因能夠在子實體的菌絲體、菌蓋和菌柄中表達。海藻糖磷酸化作用的最適溫度是36℃。PsTP基因能夠和酵母菌的tps1,tps2雙突變體細胞互補,使他們在葡萄糖培養基中生長,轉化了PsTP基因的酵母能夠比非轉化突變體或轉化進空白對照的細胞多產生2~2.5倍的海藻糖。
目前看來,大量對TreP的研究只局限于體外實驗,且多數文獻致力于研究海藻糖磷酸化酶的代謝途徑、酶學性質及反應機制,而關于相關基因的克隆表達、真菌活細胞體內酶的變化及特定條件下相關酶及基因表達的變化情況卻鮮有研究,這也是以后的研究方向。
2.2 分解代謝途徑及相關酶基因調控
海藻糖的分解代謝途徑在真菌尤其是酵母菌中研究得比較透徹。關于海藻糖的合成及分解途徑,雖然科學家在自然界各生物體中發現了多種途徑,涉及到不同的酶的催化反應;但是,國內外研究成果發現,除了畢赤酵母(Pichia fermentans)是利用海藻糖磷酸化酶分解海藻糖以外,其余所有真菌都是通過海藻糖酶的水解反應分解海藻糖的[32-34]。
海藻糖酶的催化反應過程如下:

真菌中存在兩類海藻糖水解酶,即中性海藻糖水解酶(Neutral trehalase,NTH)和酸性水解酶(Acidic trehalase,ATH)[35]。
中性海藻糖酶存在于細胞溶質中,在pH7.0左右具有最大活性。這種酶受到轉錄水平上葡萄糖抑制的調控,也受一般壓力響應途徑的調控,是通過Msn2/Msn4轉錄因子和存在于nth1基因啟動子的抗壓力元件(STREs)的內在反應實現的[36-37]。自1984年Londesborough J和Varimo K[38]的研究以來,人們認為中性海藻糖水解酶是由nth1和nth2基因編碼。然而,近來在細胞外海藻糖存在下,Jules M等[39]描述了酵母中nth2編碼的海藻糖酶的活性。也就是說nth2基因也能編碼一種功能性的海藻糖酶,而且nth2與nth1有77%的同源性,但nth2所編碼蛋白質的功能還不是很明確。Elena Garre和Emilia Matallana[13]研究了釀酒酵母中參與細胞內海藻糖轉移的三種海藻糖酶Nth1p,Nth2p和Ath1p,研究發現,所有已知的海藻糖酶都可以參與到細胞內的調動、轉移,并影響酵母生長速率。雖然已經檢測到了nth2編碼的海藻糖酶轉錄水平的變化,但是海藻糖水平或是中性海藻糖酶活性水平與這些變化無關,其功能性質及基因特性有待進一步研究。
酸性海藻糖酶,由ath1基因編碼,在pH 4.5顯示出最大活力,而酸性海藻糖酶的位置定位依賴于它的活動情況,早期關于其位置存在爭議。典型說法認為是存在于液泡(Vacuole)中,而其他資料表明它定位于周質空間(perip lasm ic space)中[40]。但2007年Huang J[41]通過基因融合到綠色熒光蛋白GFP中的亞細胞定位實驗,確定了酸性海藻糖酶位于液泡中。它與中性海藻糖酶不具同源性,但不排除它參與內源性海藻糖的降解。酸性海藻糖酶的活性一般來說不受壓力的調控,因為在ath1基因的啟動子中缺少STRE序列。
酸性海藻糖和中性海藻糖具有獨特和獨立的作用,但卻都能夠參與細胞內海藻糖的調動、轉移,所以這兩種類型的海藻糖酶共存可能是一個普遍現象,在真菌中積累和分解海藻糖,同時又利用細胞外海藻糖為碳源。
3 相關酶基因的生物工程應用
近年來對于這一具有獨特性質的海藻糖,人們的研究逐步深入,對海藻糖的代謝調控機理、生產技術及其應用研究頗為活躍,而且海藻糖相關酶的生物工程(基因的克隆和表達)研究也成為熱點。
海藻糖最重要的生物學功能是其抗逆保護作用及能量儲備等,為了充分利用這些十分獨特的特性,各研究學者從兩個方面干擾海藻糖的合成與代謝調控途徑,從而實現海藻糖在生物體內的富集,不僅促進海藻糖的生產,還能夠利用海藻糖的抗逆功能構建轉基因植物。
一方面,是通過對合成海藻糖相關基因的克隆研究,構建其基因表達載體,并將該載體轉入生物體內,最終實現海藻糖的富集。而食用傘菌中的海藻糖合成相關酶的基因工程應用近幾年不是很多,僅有少數,多數注重于酵母的研究。如徐志祥等[42]通過RT-PCR方法從灰樹花菌絲體總RNA中克隆海藻糖合成酶基因,并將其在大腸桿菌中進行表達,酶活性測定發現其表達產物以包涵體形式存在,為低成本合成海藻糖提供了新的思路。因此,利用工程微生物和酶工程方法,能夠改進海藻糖的生產,提高質量,降低成本;另外,將合成海藻糖的相關酶基因導入到植物,構建重組抗逆植物,使植物體中積累海藻糖,從而使海藻糖發揮保護功能,能夠改良植物的某種不良性狀,達到優化育種的效果。Ibolya S等[43]在可干旱誘導的啟動子StDS2的驅動下將酵母的tps1基因轉入馬鈴薯得到了兩棵轉基因植株,結果發現該表達載體在轉化植株中僅有很低的tps1基因表達(可能由于染色體位置的作用),但對轉化植株觀察結果顯示這樣的表達量足以提高轉化植株的抗旱性。轉化植株與對照植株相比,萎蔫的時間延長,在CO2的飽和的最大水平上CO2的同化率也顯著提高,氣孔也有所減少,這足以使轉化植株具有較低的CO2固定率和提高抗旱性。張樹珍等[44]從擔子菌灰樹花中克隆海藻糖合成酶基因(TSase)并構建單子葉植物表達載體把它導入甘蔗,為獲得含海藻糖的具抗旱力的新品種提供一定的理論基礎。王自章等[45]把擔子菌灰樹花的海藻糖合酶基因(TSase)在由雙拷貝CaMV35S啟動子驅動下導入甘蔗,發現部分轉化植株根葉畸形、株型異常、生長緩慢;移栽到含PEG8000 17.4%(w/v)的MS培養基后,觀察到轉基因植株抗滲透脅迫能力增強。未來著重研究海藻糖積累與植物生長發育之間的關系,以更好地研究糖與基因表達調控之間的關系,相信通過轉化海藻糖合成酶有關基因增加體內海藻糖含量會成為作物抗逆品種選育的新方法。
另一方面就是通過抑制海藻糖酶的生物活性,阻斷海藻糖的分解途徑,以實現海藻糖在生物體內的富集[46]。山東大學微生物實驗室應用分子生物學技術,將釀酒酵母細胞內中性海藻糖酶基因剔除后,中性海藻糖酶活性隨即喪失,細胞內海藻糖含量提高至正常水平的3倍,因而改進了海藻糖的發酵生產工藝,提高了海藻糖的產量,促進了海藻糖的生產[47]。
通過對海藻糖代謝途徑的研究,可利用超表達或RNA干擾技術等基因工程技術改造菌株,上調或下調海藻糖酶表達,從而下調或上調生物內海藻糖含量,對于提高生物的抗逆性至關重要,是廣大微生物工作者的極大期望,并且具有一定的可行性,值得去探索。
4 討論
由于海藻糖獨特的生物學性質以及由此而帶來的變革性應用,吸引了人們的廣泛研究,包括其性質、作用機制、生產應用等。然而,關于海藻糖在食用傘菌中具體發揮作用的結構特征、代謝途徑及其相關酶基因調控的研究、內源性及外源性海藻糖對于食用傘菌生長發育過程中所發揮的作用仍然了解較少,真正應用于生產實踐尚處于起步階段。因此,對海藻糖代謝途徑的相關基因及生物工程的研究,在理論及實踐上都具有重大意義。
在理論研究方面,海藻糖代謝網絡及其相關酶基因調控的研究對于揭示生物抗逆機制及對極端環境的適應機制具有重要價值。食用菌中,大多數菇類子實體的產生都要依靠相應的環境變化刺激,如草菇適合于生長在高溫潮濕的環境,要在相對高溫、高濕的刺激下才會形成原基、產生子實體,溫度變化影響海藻糖含量、相關酶活及相關酶基因的表達量,進而會影響草菇的生物學性狀;而且草菇不耐低溫,細胞在低溫下缺乏對合成不飽和脂肪酸的調節,從而導致低溫對其的損害、液化甚至自溶死亡[48],外源性海藻糖能夠延長草菇的保鮮期,是草菇保藏的新方法。本實驗室在草菇全基因組測序工作的基礎上,對低溫處理下草菇菌絲體中海藻糖代謝途徑酶的基因表達量進行測定和變化分析,推測海藻糖與草菇抗低溫具有一定的相關性,海藻糖在細胞內的積累有利于增強草菇對低溫的耐受性。且發現未經外源性海藻糖處理的草菇子實體在4℃貯藏過程中沒有顯著性伸長,但菇體趨向萎縮塌陷,而外源性海藻糖處理組的子實體各項感官品質降低程度要顯著小于對照組,推測海藻糖、甘露醇處理能夠在一定程度上延長草菇子實體4℃的貯藏保鮮期[49]。金針菇菌絲生長溫度為21~24℃,而原基的形成需要搔菌處理及相應的低溫刺激,探究其生長發育期間海藻糖的代謝調控情況,有助于理解金針菇生長發育過程中的能量利用、代謝情況及現原基、子實體生長的作用機制;本實驗室根據金針菇的全基因組序列信息,得到海藻糖合成代謝調控途徑中涉及的6-磷酸海藻糖酶、6-磷酸海藻糖磷酸酯酶、海藻糖磷酸化酶、中性海藻糖酶和酸性海藻糖基因,目前其表達方面的研究正在進行中。因此,筆者希望通過對金針菇中海藻糖代謝調控的研究,以期揭示其正常生長發育過程中的變化規律,從而進一步指導其栽培工藝。
在應用方面,相關基因的克隆及生物工程應用已顯示出明顯的經濟效益。將海藻糖合成及分解的相關酶基因導入到相關生物體中,不僅能夠改進海藻糖生產工藝,還能夠獲得具有抗逆性的轉基因植物。雖然目前尚缺乏對食用傘菌海藻糖代謝網絡與其他糖代謝網絡的關系、海藻糖基因組水平的系統研究,但可以通過某些傘菌的全基因組及轉錄組測序工作,在基因水平上對海藻糖合成代謝途徑進行研究,通過調控外界脅迫條件,探究其變化機理的綜合研究,必然能獲得食用傘菌的生長發育調控機制,那么改善栽培工藝、縮短生長周期、提高生產質量也將成為可能。
[1]Hounsa CG,Brandt EV,Thevelein J,et al.Role of trehalose in survival of Saccharomyces cerevisiae under osmotic stress[J]. Microbiology,1998,144:671-680.
[2]Purvis JE Yomano LP,Ingram LO.Enhanced trehalose production improves growth of Escherichia coli under osmotic stress[J].Applied and Environmental Microbiology,2005,71(7):3761-3769.
[3]劉秀明,黃晨陽,陳強,等.肺形側耳高溫后恢復期間海藻糖代謝途徑研究[J].中國農業科學,2013,46(24):5188-5195.
[4]王永紅,郭俊,陳美標,等.海藻糖對草菇菌種的低溫保護效應研究[J].微生物學通報,2008,35(1):137-141.
[5]Saito K,YamazakiH,Ohnishi Y,etal.Production of trehalose synthase from a basidiomycete,Grifola frondosa in Escherichia coli[J].Applied Microbiology and Biotechnology,1998,50(2):193-198.
[6]Schwarz A,Goedl C,Minani A,etal.Trehalose phosphorylase from Pleurotus ostreatus:Characterization and stabilization by covalent modification,and application for the synthesis of,α,αtrehalose[J].Journal of Biotechnology,2007,129:140-150.
[7]Eis,C,WatkinsM,Prohaska T.Fungal Trehalose phosphorylase kinetic mechanism,pH-dependence of the reaction and some structural properties of the enzyme from Schizophyllum commune[J].Biochemical Journal,2001,356:757-767.
[8]Gancedo C,Flores CL.The importance ofa functional trehalose biosynthetic pathway for the life of yeast and fungi[J].Fems Yeast Research,2004,4:351-359.
[9]劉占磊,黃叢林,張秀海,等.海藻糖的應用及其合酶基因TPS在植物轉基因中的研究進展[J].中國農學通報,2009,25(6):54-58.
[10]Elbein AD.The metabolism ofα,α-trehalose.In:Tipson R. S.,Horton D.(Eds.),Advances in carbohydrate chemistry andbiochemistry[J].New York:Academic Press,1974,30:227-256.
[11]Wyatt GR,Kalf GF.The chemistry of insect hemolymph.II. Trehalose and other carbohydrates[J].Journal of General Physiology,1957,40(6):833-847.
[12]AndréVan Laere.Trehalose,reserveand/or stressmetabolite?[J].Fems Microbiology Letters,1989,63(3):201-210.
[13]Wiemken A.Trehalose in yeast,stress protectant rather than reserve carbohydrate[J].Antonie van Leeuwenhoek,1990,58(3):209-217.
[14]Panek AD.Trehalose metabolism-new horizonsin technological applications[J].Brazilian Journal of Medical and Biological Research,1995,28:169-181.
[15]Eroglu A,Mehmet T,Thomas LT.Beneficial effect of microinjected trehalose on the cryosurvival of human oocytes[J]. Fertility and Sterility,2002,77:152-158.
[16]Penna MS,Fernandes JRM.Stabilization against thermal inactivation promoted by sugars on enzyme structure and function:Why is trehalose more effective than other sugars?[J]. Archives of Biochemistry and Biophysics,1998,360(1):10-14.
[17]Wiemken A.Trehalose in yeast,stress protectant rather than reserve carbohydrote[J].Antonie Van Leeuwenhoek,1992,58(3):209-217.
[18]Liang Z,MA D Q,Tang L,et al.Expression of t e spinach betaine aldehyde dehydrogenase(BADH)gene in transgenic tobacco plants[J].Chinese Journal of Biotechnology,1997,13:153-159.
[19]Elena G,Emilia M.The three trehalases Nth1p,Nth2p and Ath1p participate in the mobilization of intracellular trehalose required for recovery from saline stress in Saccharomyces cerevisiae[J].Microbiology,2009,155:3092-3099.
[20]KongWW,Huang CY,Chen Q,etal.Nitric oxide is involved in the regulation of Trehalose accumulation under heat stress in Pleurotus eryngiivar var.tuoliensis[J].Biotechnology Letters,2012,34:1915-1919.
[21]Reshkin SJ,Cassano G,Womersley C,et al.Preservation of glucose transport and enzyme activity in fish intestinal brush border and basolateral membrane vesicles[J].Journal of Experimental Biology,1988,140:123-135.
[22]劉秀明,黃晨陽,陳強,等.外源海藻糖對高溫脅迫下肺形側耳氧化損傷的緩解效應[J].園藝學報,2013,40(8):1501-1508.
[23]De Smet KA,Weston A,Brown IN,et al.Three pathways for trehalose biosynthesis in mycobacteria[J].Microbiology,2000,146:199-208.
[24]Nelson A,Alfredo MV,Enrique M,et al.Insights on the evolution of trehalose biosynthesis[J].BMC Evolutionary Biology,2006,6(1):109-115.
[25]Eberhard O V.Biochemical and genomic regulation of the trehalose cycle in yeast:review of observations and canonical model analysis[J].Journal of Theoretical Biology,2003,223:55-78.
[26]Aranda JS,Salgado E,Taillandier P.Trehalose accumulation in Saccharomyces cerevisiae cells:experimental data and structural modeling[J].Biochemical Engineering Journal,2004,17:129-140.
[27]Schmitt AP,McEntee K.Msn2p,a zinc finger DNA-binding protein,is the transcriptional activator of the multistress response in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America,1996,93:5777-5782.
[28]張芳.南極低溫酵母Guehomyces pullulans 17-1菌株中海藻糖的合成與調控[D].青島:中國海洋大學,2013.
[29]Zhang F,Wang ZP,Chi Z,et al.The changes in Tps1 activity,trehalose content and expression of TPS1 gene in the psychrotolerant yeast Guehomyces pullulans 17-1 grown at different temperatures[J].Extremophiles:Life under Extreme Conditions,2013,17(2):241-249.
[30]An MZ,Tang YQ,Mitsumasu K,et al.Enhanced thermotolerance for ethanol fermentation of Saccharomyces cerevisiae strain by overexpression of the gene coding for trehalose-6-phosphate synthase[J].Biotechnology Letters,2011,33(7):1367-1374.
[31]Han SE,Kwon HB,Lee SB,etal.Cloningand characterization of a gene encoding trehalose phosphorylase(TP)from Pleurotus sajor-caju[J].Protein Expression and Purification,2003,30:194-202.
[32]Thevelein JM.Regulation of Trehalosemobilization in fungi[J].Microbiological Review,1984,48(1):42-59.
[33]Singer MA,Lindquist S.Thermotolerance in Saccharomyces cerevisiae:the yin and yang of trehalose[J].Canadian Metallurgical Quarterly,1998,16(11):460-468.
[34]Elbein AD,Pan YT,Pastuszak I,et al.New insights on trehalose:a multifunctional molecule[J].Glycobiology,2003,13(4):17-27.
[35]Arguelles JC.Physiological roles of trehalose in bacteria and yeasts:a comparative analysis[J].Archives of Microbiol,2000,174(4):217-222.
[36]Zahringer H,Burgert M,Holzer H,et al.Neutral trehalase Nth1p of Saccharomyces cerevisiae encoded by the NTH1 gene is a multiple stress responsive protein[J].FEBS Letters,1997,412(3):615-620.
[37]Zahringer H,Thevelein JM,Nwaka S.Induction of neutral trehalase Nth1 by heat and osmotic stress is controlled by STRE elements and Msn2/Msn4 transcription factors:variations of PKA effect during stress and growth[J].Molecular Microbiology,2000,135(2):397-406.
[38]Londesborough J,Varimo K.Characterization of two trehalases in baker's yeast[J].Biochemical Journal,1984,219:511-518.
[39]Jules M,Beltran G,Francois J,et al.New insights in yeast trehalose metabolism:NTH2 encodes a functional cytosolic trehalase,and deletion of TPS1 reveals a Ath1p-dependent trehalose mobilization[J].Applied and Environmental Microbiology,2008,l74:605-614.
[40]Jules M,Guillou V,Francois J,et al.Two distinct pathways for trehalose assimilation in the yeast Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2004,70(5):2771-2778.
[41]Huang J,ReggioriF,Klionsky DJ.The transmembrane domain of acid trehalase mediates ubiquitin-independent multivesicular body pathway sorting[J].Molecular Biology of the Cell,2007,18(7):2511-2524.
[42]徐志祥,李剛,王震宇,等.灰樹花海藻糖合成酶基因的克隆及其在大腸桿菌中的表達[J].微生物學報,2004,44(4):540-542.
[43]Ibolya S,Sandor D,Mihaly K,et al.Effects of drought on water content and photosynthetic parameters in potato plants expressing the trehalose-6-phosphate synthase gene of Saccharomyces cerevisiae[J].Planta,2008,227(2):299-308.
[44]張樹珍,鄭學勤,林俊芳,等.海藻糖合酶基因的克隆及轉化甘蔗的研究[J].農業技術學報,2000(8):385-388.
[45]王自章,張樹珍,楊本鵬,等.甘蔗根癌農桿菌介導轉化海藻糖合酶基因獲得抗滲透脅迫能力增強植株[J].中國農業科學,2003,36(2):140-146.
[46]李亞鵬,陳明杰,鮑大鵬,等.真菌中的海藻糖及其在低溫逆境下的作用[J].食用菌學報,2013,20(4):71-77.
[47]邵引剛,李峰,孫輝,等.海藻糖的應用及基因工程研究[J].安徽農業科學,2008,36(3):857-859.
[48]Li PH,Sakai A.Plant cold and freezing stresses[M].New York:Academic Press,1982:2.
[49]李亞鵬,陳明杰,趙妍,等.低溫脅迫下草菇海藻糖磷酸化酶基因表達變化研究[J].生物學雜志,2014,31(5):14-18.
Regulation of genes involved in metabolism of trehalose in edible Agaricomycetes and their applications in bioengineering
LIU Jian-hui1,2,SHANG Xiao-dong1,*,LIYa-peng1,2,ZHAO Yan1,TAN Qi1,2,*
(1.Key Laboratory of Applied Mycological Resources and Utilization,Ministry of Agriculture,National Engineering Research Center of Edible Fungi,Shanghai Key Laboratory of Agricultural Genetics and Breeding,Institute of Edible Fungi,SAAS,Shanghai201403,China;2.College of Food Science,Shanghai Ocean University,Shanghai201306,China)
Trehalose,as a unique disaccharide,plays special protective role against external stress conditionsand was widely distributed in archaea,bacteria,fungi,plants and animals. In this review,the physicochemicalproperties and biological characteristics of trehalose were introduced briefly and the metabolic pathways oftrehalose biosynthesis and catabolism in edible Agaricomycetes were summarized. In addition,the researchprogress of the regulation of trehalose metabolism-related enzyme genes was described in details. Thebioengineering applications of trehalose metabolism-related genes in edible Agaricomycetes were alsodiscussed.
trehelose;edible Agaricomycetes;metabolism;regulation;bioengineering
TS201.1
A
1002-0306(2015)08-0374-07
10.13386/j.issn1002-0306.2015.08.070
2014-07-18
劉建輝(1991-),女,碩士研究生,研究方向:食藥用菌遺傳與育種。
*通訊作者:譚琦(1963-),女,博士,研究員,研究方向:食用菌遺傳育種。尚曉冬(1973-),男,博士,研究員,研究方向:食用真菌栽培育種,食用菌菌種、產品質量檢測方法探索研究。
國家科技支撐項目“食用菌新品種培育及制種關鍵技術研究”(2013BAD16B02);上海市科技人才計劃項目(13XD1424700)資助。

