5種大黃制劑微生物限度檢查法的建立
李思 方李 吳晶晶等

[摘要] 目的 建立5種大黃制劑(保腎片、新保腎片、腎炎寧片、新腎炎膠囊、炎黃保腎膠囊)的微生物限度檢查方法。 方法 按照《中國藥典》(2010年版)微生物限度檢查法的規(guī)定,采用常規(guī)法、培養(yǎng)基稀釋法、薄膜過濾法對5種大黃制劑的細(xì)菌、霉菌和酵母菌進(jìn)行回收率測定,通過回收率試驗(yàn)測定制劑的抑菌性;采用直接接種法對制劑控制菌進(jìn)行測定。 結(jié)果 5種大黃制劑均有抑菌作用,均不可用常規(guī)法進(jìn)行細(xì)菌、霉菌和酵母菌測定;2種大黃制劑(保腎片、新保腎片)對枯草芽孢桿菌有較強(qiáng)的抑菌作用,可采用培養(yǎng)基稀釋法(0.2 mL/皿)進(jìn)行細(xì)菌數(shù)測定,霉菌和酵母菌可采用常規(guī)法檢查;1種大黃制劑(腎炎寧片)對枯草芽孢桿菌和白色念珠菌有較強(qiáng)的抑菌作用,可采用培養(yǎng)基稀釋法(0.2 mL/皿)進(jìn)行細(xì)菌、霉菌和酵母菌數(shù)測定;2種大黃制劑(新腎炎膠囊、炎黃保腎膠囊)對枯草芽孢桿菌和金黃色葡萄球菌有很強(qiáng)的抑菌作用,需采用薄膜過濾法對細(xì)菌數(shù)進(jìn)行測定,對白色念珠菌有較強(qiáng)的抑菌作用,可采用培養(yǎng)基稀釋法(0.2 mL/皿)進(jìn)行霉菌和酵母菌數(shù)測定。 結(jié)論 大黃具有明顯的抑菌性,嚴(yán)格按照《中國藥典》(2010年版)規(guī)定,建立合理適用的5種大黃制劑微生物限度檢查方法,以有效控制其質(zhì)量。
[關(guān)鍵詞] 大黃制劑;微生物限度檢查;方法驗(yàn)證;回收率
[中圖分類號] R927.1 [文獻(xiàn)標(biāo)識碼] A [文章編號] 1673-7210(2015)08(c)-0009-05
[Abstract] Objective To establish a method of microbial limit test for five Rhubarb preparations (Baoshen Tables, Xinbaoshen Tablets, Shenyannin Tablets, Xinshenyan Capsules, Yanhuangbaoshen Capsules). Methods According to the microbial limit test method set forth in Chinese Pharmacopoeia of 2010 edition, the conventional method, medium dilution method and membrane filtration method were used for the recovery determination of bactria, mould and yeast of five Rhubarb preparations, the antibacterial property of drugs were tested through the recovery determination, and control bacteria was determined by direct inoculation method. Results All of the five Rhubarb preparations showed strong bacteriostasis, and conventional method couldn't be used to determine the varieties of bacteria, mould and yeast. Two Rhubarb preparations (Baoshen Tablets, Xinbaoshen Tablets) of them had strong bacteriostasis on Bacillus subtilis, and culture medium dilution method (0.2 mL/plate) could be used for the bacteria number count, and molds and yeasts could be checked by conventional method. One Rhubarb preparation (Shenyanning Tablets) had strong bacteriostasis on Bacillus subtilis and Candida albicans, and culture medium dilution method (0.2 mL/plate) could be used for the bacteria, molds and yeasts number count. Two Rhubarb preparations (Xinshenyan Capsules, Yanhuangbaoshen Capsules) had very strong bacteriostasis on Bacillus subtilis and Staphylococcus aureus, and membrane filtration method should be used for the bacterial number count. Two preparations had strong bacteriostasis on Candida albicans, and culture medium dilution method (0.2 mL/plate) could be used for the molds and yeasts number count. Conclusion Rhubarb has obvious antibacterial activity. In strict accordance with the provisions of 2010 edition in Chinese Pharmacopoeia, suitable method of microbial limit test for five Rhubarb preparations should be established in order to effectively control the quality.
[Key words] Rhubarb preparation; Microbial limit test; Method validation; Recovery rate
《中國藥典》(2010年版)[1]強(qiáng)調(diào)對藥品的微生物限度檢查法進(jìn)行方法學(xué)驗(yàn)證,南京軍區(qū)南京總醫(yī)院制劑科(以下簡稱“我科”)制劑以中藥為主,多種中藥材和中藥單體化合物有不同程度的抑菌性,本研究以大黃制劑為例,目的是建立對抑菌性較強(qiáng)中成藥的微生物限度檢查方法,驗(yàn)證過程中當(dāng)采用常規(guī)法不能真實(shí)反映制劑微生物污染情況時,應(yīng)采用培養(yǎng)基稀釋法或薄膜過濾法等方法先消除供試品中的抑菌活性,再進(jìn)行微生物限度檢查,以有效控制制劑質(zhì)量。微生物限度檢查是控制制劑質(zhì)量的一項(xiàng)重要指標(biāo),制劑質(zhì)量控制是制劑生產(chǎn)銷售的關(guān)鍵,所以針對不同類型制劑建立安全有效的微生物限度檢查法對控制我科制劑的安全性有著至關(guān)重要的意義。
1 儀器與材料
1.1 儀器
PYX-DHS-40×50型隔水式電熱恒溫細(xì)菌培養(yǎng)箱(上海躍進(jìn)醫(yī)療器械廠);ML160型霉菌培養(yǎng)箱(上海躍進(jìn)醫(yī)療器械廠)。
1.2 樣品
選取我科自制制劑保腎片、新保腎片、腎炎寧片、新腎炎膠囊和炎黃保腎膠囊,每種制劑選取近期的3個批次作為驗(yàn)證樣品。
保腎片(批號:141230、150126、150202),新保腎片(批號:141227、150114、150128),腎炎寧片(批號:141223、150118、150210),新腎炎膠囊(批號:141230、150116、150204),炎黃保腎膠囊(批號:150112、150126、150209)均由我科提供。
1.3 試驗(yàn)菌株
金黃色葡萄球菌[編號CMCC(B)26003第3代],枯草芽孢桿菌[編號CMCC(B)63501第4代],大腸埃希菌[編號CMCC(B)44102第4代],白色念珠菌[編號CMCC(F)98001第3代],黑曲霉[編號CMCC(F)98003第3代]均由江蘇省食品藥品檢驗(yàn)所提供。
1.4 培養(yǎng)基
營養(yǎng)瓊脂培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130513),玫瑰紅鈉瓊脂培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:141010),營養(yǎng)肉湯培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130311),膽鹽乳糖培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:140212),MUG培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130307),改良馬丁培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130830),改良馬丁瓊脂培養(yǎng)基(北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130923)均由江蘇省食品藥品檢驗(yàn)所提供。按規(guī)定進(jìn)行的適用性檢查結(jié)果合格。稀釋劑為pH 7.0無菌氯化鈉-蛋白胨緩沖液,沖洗劑為0.1%蛋白胨(規(guī)格:250 g,北京三藥科技開發(fā)公司,中國藥品生物制品檢定所監(jiān)制,批號:130814)。
2 方法與結(jié)果
按《中國藥典》(2010年版)[1]一部附錄微生物限度檢查法進(jìn)行驗(yàn)證。
2.1 菌液制備[2]
2.1.1 金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌
用陽性菌專用接種環(huán)取適量金黃色葡萄球菌、大腸埃希菌和枯草芽孢桿菌新鮮培養(yǎng)物置已滅菌的10 mL營養(yǎng)肉湯培養(yǎng)基中,將接種這3株菌的培養(yǎng)基置于細(xì)菌培養(yǎng)箱(30~35℃)中培養(yǎng)18~24 h,分別取各培養(yǎng)物1 mL加至0.9%無菌氯化鈉溶液9 mL中,金黃色葡萄球菌10倍遞增稀釋至1/106,大腸埃希菌10倍遞增稀釋至1/10-7,枯草芽孢桿菌10倍遞增稀釋至1/105,分別制成每毫升含菌數(shù)為50~100 cfu的菌懸液。
2.1.2 白色念珠菌
用陽性菌專用接種環(huán)取適量白色念珠菌的新鮮培養(yǎng)物置已滅菌的10 mL改良馬丁培養(yǎng)基中,將接種好的培養(yǎng)基置于霉菌培養(yǎng)箱(23~28℃)中培養(yǎng)36~48 h,取培養(yǎng)物1 mL加至0.9%無菌氯化鈉溶液9 mL中,10倍遞增稀釋至1/105,制成每毫升含菌數(shù)為50~100 cfu的菌懸液。
2.1.3 黑曲霉
用陽性菌專用接種環(huán)取適量黑曲霉新鮮培養(yǎng)物置于改良馬丁瓊脂斜面培養(yǎng)基中,將接種好的培養(yǎng)基置于霉菌培養(yǎng)箱(23~28℃)中培養(yǎng)7 d,形成大量孢子,洗脫孢子過濾,取1 mL孢子液,制成孢子懸液,使之每毫升含孢子數(shù)為50~100 cfu。
2.2 供試液制備
取供試品(5種制劑每種各3個批次)10 g,加pH 7.0無菌氯化鈉-蛋白胨緩沖液至100 mL,用勻漿儀研勻,制成1∶10均勻混懸液作為供試液備用。
2.3 回收率測定
細(xì)菌、霉菌和酵母菌計(jì)數(shù)檢查方法的建立:若試驗(yàn)組的菌回收率均不低于70%,可按該供試液制備方法和計(jì)數(shù)方法測定供試品的細(xì)菌、霉菌和酵母菌數(shù);若任一次平行試驗(yàn)中試驗(yàn)組的菌回收率低于70%,應(yīng)建立新的方法,并重新驗(yàn)證。
2.3.1 常規(guī)法[3]
2.3.1.1 試驗(yàn)組 分別取上述5種制劑各3個批號的供試液(1∶10)1 mL,注入10個平皿中,2個一組分為5組,每組分別加入上述稀釋的5種菌懸液1 mL(50~100 cfu),每株試驗(yàn)菌平行制備2個平皿,細(xì)菌傾注營養(yǎng)瓊脂培養(yǎng)基,霉菌和酵母菌傾注玫瑰紅鈉瓊脂培養(yǎng)基,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h。
2.3.1.2 菌液組 取10個平皿,2個一組分成5組,分別取上述稀釋的5種菌懸液1 mL注入每組平皿中,每個菌平行制備2個平皿,細(xì)菌傾注營養(yǎng)瓊脂培養(yǎng)基,霉菌和酵母菌傾注玫瑰紅鈉瓊脂培養(yǎng)基,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h,測定所加入的試驗(yàn)菌數(shù)。
2.3.1.3 供試品對照組 每種培養(yǎng)基制備2個平皿,分別取上述5種制劑各3個批號的供試液(1∶10)1 mL分別注入,傾注培養(yǎng)基,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h,以測定供試品的本底菌數(shù)。
2.3.1.4 稀釋劑對照組 本品未用特殊方法處理和制備,所以未設(shè)置該組。
2.3.1.5 驗(yàn)證結(jié)果 依照下列公式,計(jì)算常規(guī)法項(xiàng)下5種大黃制劑的試驗(yàn)菌回收率:
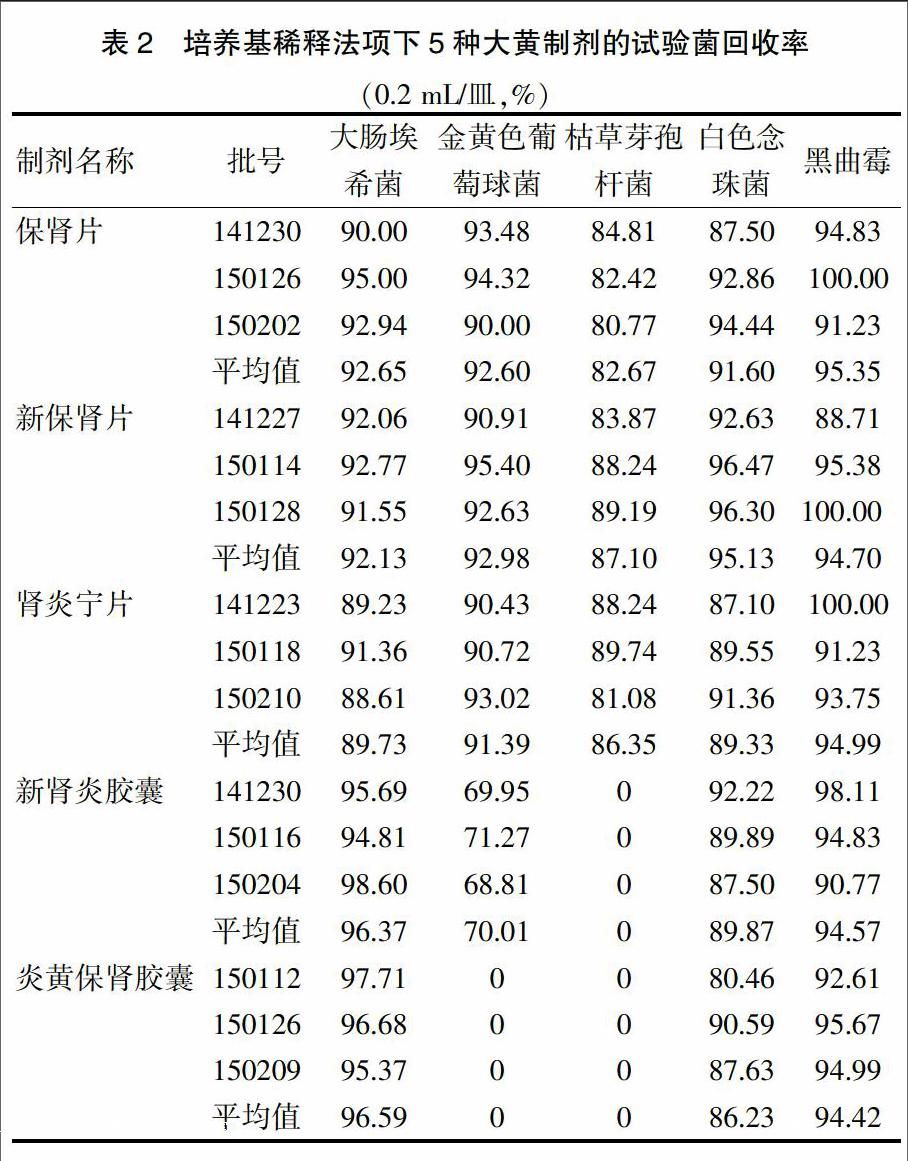
由表1可知,5種大黃制劑對枯草芽孢桿菌均有很強(qiáng)的抑菌作用,均需改用培養(yǎng)基稀釋法或薄膜過濾法重新驗(yàn)證;新腎炎膠囊和炎黃保腎膠囊對金黃色葡萄球菌有很強(qiáng)的抑菌作用;腎炎寧片、新腎炎膠囊和炎黃保腎膠囊對白色念珠菌有一定的抑菌作用;保腎片和新保腎片對白色念珠菌及黑曲霉均無抑制作用,回收率均達(dá)到70%以上,故可采用常規(guī)法測定這2個品種的霉菌和酵母菌數(shù)。
2.3.2 培養(yǎng)基稀釋法[4-5]
2.3.2.1 試驗(yàn)組 分別取上述5種制劑各3個批號的供試液(1∶10)0.2 mL置于10個平皿,2個一組分成5組,每株試驗(yàn)菌平行制備2個平皿,即供試液每平皿0.2 mL,依次加入上述稀釋的5種菌懸液1 mL(50~100 cfu),細(xì)菌傾注營養(yǎng)瓊脂培養(yǎng)基,霉菌和酵母菌傾注玫瑰紅鈉瓊脂培養(yǎng)基,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h。
2.3.2.2 菌液組 取10個平皿,2個一組分成5組,每個菌平行制備2個平皿,分別取上述稀釋的5種菌懸液1 mL注入每組平皿中,細(xì)菌傾注營養(yǎng)瓊脂培養(yǎng)基,霉菌和酵母菌傾注玫瑰紅鈉瓊脂培養(yǎng)基,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h,測定所加入的試驗(yàn)菌數(shù)。
2.3.2.3 供試品對照組 分別取上述5種制劑各3個批號的供試液0.2 mL置4個平皿中,營養(yǎng)瓊脂培養(yǎng)基和玫瑰紅鈉瓊脂培養(yǎng)基每種培養(yǎng)基制備2個平皿,即供試液每平皿0.2 mL,待凝固后,營養(yǎng)瓊脂培養(yǎng)基置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h,玫瑰紅鈉瓊脂培養(yǎng)基置霉菌培養(yǎng)箱(23~28℃)培養(yǎng)72 h,以測定供試品的本底菌數(shù)。
2.3.2.4 稀釋劑對照組 本品未用特殊方法處理和制備,所以未設(shè)置該組。
2.3.2.5 驗(yàn)證結(jié)果 依照下列公式,計(jì)算培養(yǎng)基稀釋法項(xiàng)下5種大黃制劑的試驗(yàn)菌回收率:
由表2可知,經(jīng)培養(yǎng)基稀釋(每平皿0.2 mL),保腎片、新保腎片和腎炎寧片3個品種對5株試驗(yàn)菌的回收率均高于70%,證明無抑菌作用。新腎炎膠囊和炎黃保腎膠囊對金黃色葡萄球菌和枯草芽孢桿菌抑菌作用較強(qiáng),采用培養(yǎng)基稀釋法不能完全消除其抑菌作用,需改用薄膜過濾法重新驗(yàn)證;對白色念珠菌和黑曲霉已無抑制作用,回收率均70%以上,可采用培養(yǎng)基稀釋法測定。
2.3.3 薄膜過濾法[6]
2.3.3.1 試驗(yàn)組 分別取上述新腎炎膠囊和炎黃保腎膠囊各3個批次的供試液(1∶10)1 mL,加入裝有100 mL沖洗液的過濾器中,經(jīng)減壓抽濾,每次約100 mL沖洗,共沖洗300 mL/膜,在最后一次沖洗液中依次加入上述稀釋的細(xì)菌(大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌)的菌懸液1 mL(50~100 cfu),抽濾干凈后取膜,菌面向上貼于凝固的營養(yǎng)瓊脂培養(yǎng)基上,置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h。
2.3.3.2 菌液組 分別取上述稀釋的細(xì)菌菌液(大腸埃希菌、金黃色葡萄球菌、枯草芽孢桿菌)1 mL,加入裝有100 mL沖洗液的過濾器中,經(jīng)減壓抽濾,每次約100 mL沖洗,共沖洗300 mL/膜,抽濾干凈后取膜,菌面向上貼于凝固的營養(yǎng)瓊脂培養(yǎng)基上,置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h。
2.3.3.3 供試品對照組 分別取上述新腎炎膠囊和炎黃保腎膠囊各3個批次的供試液(1∶10)1 mL,加入裝有100 mL沖洗液的過濾器中,經(jīng)減壓抽濾,每次約100 mL沖洗,共沖洗300 mL/膜,抽濾干凈后取膜,菌面向上貼于凝固的營養(yǎng)瓊脂培養(yǎng)基上,置細(xì)菌培養(yǎng)箱(30~35℃)培養(yǎng)48 h。
2.3.3.4 稀釋劑對照組 本品未用特殊方法處理和制備,所以未設(shè)置該組。
2.3.3.5 驗(yàn)證結(jié)果 依照下列公式,計(jì)算薄膜過濾法項(xiàng)下2種大黃制劑的試驗(yàn)菌回收率:
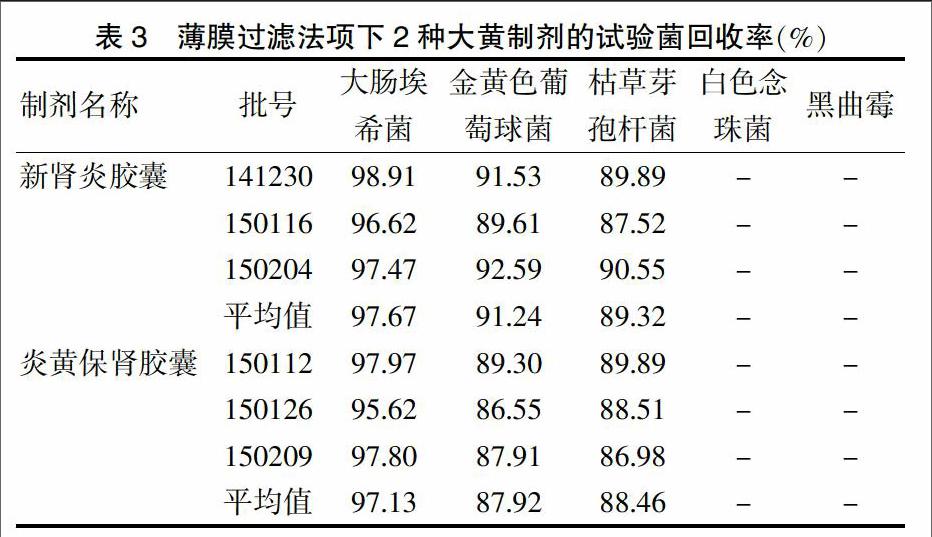
由表3可知,經(jīng)薄膜過濾后,新腎炎膠囊和炎黃保腎膠囊對大腸埃希菌、金黃色葡萄球菌及枯草芽孢桿菌的回收率均高于70%,證明已無抑菌作用,可采用薄膜過濾法對這2個品種進(jìn)行細(xì)菌計(jì)數(shù)檢查。
2.4 控制菌檢驗(yàn)方法驗(yàn)證
2.4.1 試驗(yàn)組
分別取上述5種制劑的供試液(1∶10)10 mL及92 cfu的大腸埃希菌,加入100 mL的膽鹽乳糖增菌培養(yǎng)基中,置30~35℃培養(yǎng)箱18~24 h,取上述培養(yǎng)物0.2 mL接種至含5 mL MUG培養(yǎng)基的試管內(nèi)培養(yǎng),于5、24 h在366 nm紫外燈下觀察,同時用未接種的MUG培養(yǎng)基作本底對照。
2.4.2 陰性菌對照組
分別取上述5種制劑的供試液(1∶10)10 mL及93 cfu的金黃色葡萄球菌,加入100 mL的膽鹽乳糖增菌培養(yǎng)基中,置30~35℃培養(yǎng)箱18~24 h,取上述培養(yǎng)物0.2 mL接種至含5 mL MUG培養(yǎng)基的試管內(nèi)培養(yǎng),于5、24 h在366 nm紫外燈下觀察,同時用未接種的MUG培養(yǎng)基作本底對照。
2.4.3 驗(yàn)證結(jié)果
由表4可見,采用常規(guī)法,控制菌(大腸埃希菌)能正常檢出,陰性對照未檢出金黃色葡萄球菌,符合《中國藥典》(2010年版)微生物限度檢查驗(yàn)證要求,所以常規(guī)法可用于這5種大黃制劑的控制菌檢查。
2.5 微生物限度檢查法建立
根據(jù)以上試驗(yàn)驗(yàn)證結(jié)果,建立5種大黃制劑的微生物限度檢查法,結(jié)果見表5。
3 討論
我國具有大量寶貴的中藥資源,而中草藥在生長過程中不斷與細(xì)菌抗?fàn)帲饾u成為天然的抑菌藥物[7],中成藥中含有較強(qiáng)抑菌成分時,要先排除抑菌成分的干擾[8],才能真實(shí)反映制劑污染微生物的狀況,有研究報(bào)道過大黃與其他多種藥材的抑菌性[9],大黃的抑菌作用相對都較強(qiáng)[10-11],所以建立大黃制劑微生物限度檢查法時,必須先消除其抗菌性,才能正確反映制劑的微生物污染情況。
本研究選取的5種制劑均以大黃藥材提取物為主要成分,大黃主要含蒽醌類化合物,主要包括蘆薈大黃素、大黃酸、大黃素、大黃酚、大黃素甲醚等,為大黃發(fā)揮抗菌作用的主要成分[12],尤其對金黃色葡萄球菌和鏈球菌等均有較強(qiáng)的抑制作用,5種制劑中保腎片、新保腎片和腎炎寧片含量測定以大黃酸、大黃素和大黃酚為主[13-14],新腎炎膠囊含量測定以大黃素為主,炎黃保腎膠囊含量測定以大黃酸為主。試驗(yàn)結(jié)果表明,5種大黃制劑中所含大黃蒽醌類成分含量不同,發(fā)揮抑菌作用效果也不同,含量愈高,抑菌作用也愈強(qiáng)。在對同一種中藥原料制劑進(jìn)行微生物限度檢查時,由于所含主要成分差異以及含量高低而導(dǎo)致抑菌作用不同,故排除抑菌干擾所采取的方法也不同,應(yīng)根據(jù)試驗(yàn)結(jié)果建立準(zhǔn)確合適的微生物限度檢查方法以保證制劑質(zhì)量。
[參考文獻(xiàn)]
[1] 國家藥典委員會.中國藥典[S].一部.北京:中國醫(yī)藥科技出版社,2010:附錄79-附錄88.
[2] 賓馳,顏棟林.4種醫(yī)院制劑微生物限度檢查方法驗(yàn)證[J].中國醫(yī)藥指南,2011,9(22):226-228.
[3] 黃英.14種中成藥微生物限度檢查方法研究[J].中國執(zhí)業(yè)藥師,2013,10(2):27-30.
[4] 方李,張心悅,吳晶晶,等.13種軟膏劑微生物限度檢查的方法驗(yàn)證討論[J].研究簡報(bào),2014,17(9):1580-1583.
[5] 方李,吳晶晶,錢琳娜,等.急支平喘軟膠囊微生物限度檢查的方法驗(yàn)證[J].安徽醫(yī)藥,2013,17(1):35-36.
[6] 于風(fēng)平,楊美琴,特玉香,等.含大黃、黃芩、黃連和黃柏藥材的中成藥微生物限度檢查法的建立[J].藥物分析雜志,2010,30(3):558-562.
[7] 李亞娜.中藥抑菌的研究現(xiàn)狀及思考[J].國際檢驗(yàn)醫(yī)學(xué)雜志,2014,35(2):198-200.
[8] 梁勤,喬登嫣,馬小明,等.甘肅道地中藥大黃、黃芩對多重耐藥菌的抑菌活性[J].西部中醫(yī)藥,2014,27(5):5-7.
[9] 費(fèi)娜,楊俊杰.大黃等四種中草藥體外抑菌活性比較[J].黑龍江醫(yī)藥科學(xué),2010,33(1):18-19.
[10] 宋麗琴.大黃不同炮制品的體外抑菌作用[J].海峽藥學(xué),2011,23(5):55-56.
[11] 陳子彬,豐浩榮,王祥和.烏司他丁聯(lián)合大黃對創(chuàng)傷后急性肺損傷的治療效果[J].解放軍醫(yī)藥雜志,2015,27(2):69-72.
[12] 彭苑霞,劉曉強(qiáng),溫羚玲,等.大黃等5味中藥及單體成分對臨床多重耐藥菌的抑制作用[J].中國實(shí)驗(yàn)方劑學(xué)雜志,2014,20(22):103-107.
[13] 陸崟,王銀娟,廖欣,等.腎炎寧片穩(wěn)定性考察[J].安徽醫(yī)藥,2013,17(2):191-193.
[14] 王曙東,喬立業(yè),方李,等.保腎片的質(zhì)量標(biāo)準(zhǔn)研究[J].研究論文,2014,17(8):1300-1302.
(收稿日期:2015-04-09 本文編輯:李亞聰)

