鐵基載氧體在化學鏈制氫中的應用研究
張 鑫,馬 波,梁 皓,尹澤群
(1.遼寧石油化工大學化學化工與環境學部,遼寧 撫順 113001;2.中國石化撫順石油化工研究院)
鐵基載氧體在化學鏈制氫中的應用研究
張 鑫1,馬 波1,梁 皓2,尹澤群2
(1.遼寧石油化工大學化學化工與環境學部,遼寧 撫順 113001;2.中國石化撫順石油化工研究院)
采用檸檬酸絡合法制備載體LaNiO3,浸漬法制備鐵基載氧體CeO2-Fe2O3/LaNiO3,并將其用于化學鏈制氫過程中。在劑烷比2∶1、進水量0.1 mL、常壓的實驗條件下,考察反應溫度對載氧體反應性能的影響。結果表明:氫氣產量隨Fe負載量的增加先增大后減小,最佳負載量為15%;助劑CeO2的添加,提高了載氧體的性能。5%CeO2-15%Fe2O3/LaNiO3載氧體在固定床反應器、還原溫度為800 ℃、氧化溫度為800 ℃、劑烷比為2∶1、進水量為0.1 mL的實驗條件下連續循環100次后仍保持高活性。
化學鏈制氫 載氧體 鈣鈦礦 甲烷
氫氣作為一種清潔能源,可用作能源載體和燃料。在煉油廠,氫氣主要用于加氫裂化、VGO加氫精制、餾分油加氫精制、石腦油加氫精制、芳烴飽和及異構化等。在工業生產中,氫氣與其它物質一起用來制造氨水和化肥,同時也應用到玻璃磨光、黃金焊接、氣象氣球探測中[1-2]。目前工業上最主要的制氫方法是天然氣水蒸氣重整制氫,該技術以天然氣為原料,制得合成氣,再經過水汽變換反應進行制氫,最后脫除CO2得到較純的氫氣,該過程流程長、能耗大。除此以外,該過程還要向大氣排放大量的溫室氣體,對環境不利[3-4]。
化學鏈制氫系統由燃料反應器、水蒸氣反應器和空氣反應器組成(見圖1)。在燃料反應器中,Fe2O3與燃料發生反應生成CO2和H2O,通過冷凝脫水富集純CO2,此時Fe2O3被還原為FeO,吸收熱量;在蒸汽反應器中,還原態的FeO與水蒸氣反應生成目標產物H2,此時FeO被氧化為Fe3O4;在空氣反應器中,Fe3O4被氧化為Fe2O3,放出熱量。反應式如下所示:
燃料反應器:

(1)
蒸汽反應器:

(2)
空氣反應器:

(3)
總反應:

(4)
此系統解決了化石燃料制取氫氣過程中大量的CO2排放問題以及分離氣體所需要的高能耗與設備投入。

圖1 化學鏈制氫示意
在化學鏈制氫過程中,載氧體既是晶格氧的載體,又是能量載體,制備價格低廉、高效、環境友好的載氧體對該技術至關重要[5]。目前,該過程多選用Fe基氧化物作載氧體,但是由于受到其還原過程中熱力學平衡的限制,燃料氣轉化率較低[6]。另外,高溫氧化再生過程中釋放的巨大熱量會造成載氧體顆粒逐漸燒結,降低了顆粒孔隙率和有效反應面積,導致載氧體的反應活性隨循環次數的增加而逐漸降低。因此,通常將Fe基氧化物負載到載體上。目前文獻中采用較多的載體主要有Al2O3、TiO2、MgO、SiO2、高嶺土、鋁酸鹽等[7-8],這些載體都是惰性載體,在反應過程中基本不參與反應,如果采用活性載體,既能為金屬氧化物提供支撐和分散的作用,又能參與反應、為反應提供一定的活性位,這種載體就可以提高載氧體的效率,具有很好的經濟性。鈣鈦礦[9]是一種具有獨特物理性質和化學性質的新型無機非金屬材料,其分子通式為ABO3,該類氧化物A位一般是稀土或堿土元素離子,B位為過渡元素離子,A位和B位皆可被半徑相近的其它金屬離子部分取代,調整晶體的結構及其缺陷和密度,從而形成陰陽離子點陣的缺陷和價態的不同,促進其吸收、釋放、儲存、傳輸氧并提供活性。鈣鈦礦結構中的離子半徑匹配應滿足下面關系式:

式中:RA,RB,RO分別代表A,B,O的離子半徑;t稱為容差因子。
Fan Liangshi等[10]以煤為原料、氣化后的合成氣為燃料,對Ni,Cu,Cd,Co,Mn,Fe基金屬氧化物作為載氧體進行實驗。結果表明,Fe2O3為載氧體時,氫氣產率最高,同時合成氣轉化率也很好。Zeng Liang等[11]以合成氣為燃料,Fe2O3為載氧體,在燃料反應器、蒸汽反應器和空氣反應器中進行循環實驗,結果表明,CO轉化率大于90%,99%CO2被富集。Yang Jingbiao等[12]以煤焦為原料,Fe2O3為載氧體,采用流化床反應器,用水蒸氣代替空氣作氧化劑,在反應溫度800 ℃、燃料反應器中空速5 680 mL/(g·h)、蒸汽反應器空速2 840 mL/(g·h)的條件下焦炭轉化率為97%,H2產量為167 mL/g Fe2O3。史奇良等[13]以CO為燃料,Fe2O3為活性組分,Al2O3和TiO2為載體,反應溫度為900 ℃,對Fe2O3(90%)+Al2O3(10%),Fe2O3(60%)+Al2O3(40%),Fe2O3(60%)+TiO2(40%)3種載氧體進行還原、水蒸氣氧化和空氣氧化循環實驗,評價結果表明:3種載氧體在循環中活性保持穩定,沒有出現失活和燒結現象;增加載氧體中惰性載體的含量可以提高載氧體的活性。Murugan A[14]以CO為原料,對La0.6Sr0.4Co0.2Fe0.8O3-δ(LSCF6428),La0.7Sr0.3FeO3-δ(LSF731),60%Fe2O3/Al2O3(Fe 60),20%NiO/Al2O3(Ni 20) 4種不同的載氧體制氫性能進行了比較,結果表明:100次還原氧化循環反應后,LSCF6428和LSF731鈣鈦礦穩定性和活性與Fe60和Ni20相當。隨著反應的進行,Fe60和Ni20產氫量降低,而且Ni20產生了積炭現象。程序升溫實驗結果表明,在開始的反應中,Fe60的產氫量高于LSF731,但是150個循環之后,兩者產氫量相當,LSF731表現出更好的循環性能和穩定性。梁皓等[15-17]研究了鎳基、鐵基和鈷基載氧體在化學循環制氫中的性能,以CH4為原料,Fe2O3/LaFeO3為載氧體,在反應溫度900 ℃、常壓下進行了還原氧化反應,評價結果表明:劑烷比為2∶1、進水量為0.1 mL、Fe質量分數為15%時載氧體性能最好,CH4轉化率達到60%,單次循環氫氣產量為45 mL。Ryden M[18]以CO為燃料,60%Fe2O3/MgAl2O4為載氧體,在流化床上對其進行評價,結果表明,在反應溫度為900 ℃時,75% CO氧化成CO2,氫氣產量為106 mL/g。
本研究采用LaNiO3作活性載體,Fe2O3作活性組分,CeO2作助劑,以CH4、水蒸氣和空氣為原料,考察載氧體的性能。
1 實 驗
1.1 載氧體制備
1.1.1 載體制備 ①稱取一定量的Ni(NO3)2·6H2O放入500 mL燒杯中,加入100 mL蒸餾水,然后把燒杯置于40 ℃水浴中。②稱取一定量的La(NO3)3·6H2O,放入裝有100 mL蒸餾水的燒杯中,攪拌至全部溶解。其中鎳離子與鑭離子的物質的量相等。把硝酸鑭溶液滴加到硝酸鎳溶液中,邊滴加邊攪拌。③取一定量的檸檬酸,檸檬酸與金屬離子總量摩爾比為1.2∶1,攪拌至全部溶解,待上述混合溶液攪拌30 min后,緩慢地加入檸檬酸溶液,邊滴加邊攪拌。④攪拌5 h后,綠色溶液脫水變成黏稠狀凝膠,將凝膠取出放入120 ℃的干燥箱中干燥過夜,以3 ℃/min的升溫速率從室溫升至400 ℃,恒溫焙燒3 h,再以10 ℃/min的升溫速率升至900 ℃,恒溫焙燒4 h,得到金屬氧化物載體LaNiO3。
1.1.2 負載活性組分 采用等體積浸漬法制備載氧體。首先稱取一定量的金屬氧化物前軀體Fe(NO3)3·9H2O、Ce(NO3)3·6H2O,加入適量蒸餾水溶解后混合均勻,稱取一定量的LaNiO3載體粉末,將上述溶液分多次與LaNiO3混合并充分攪拌,得到均勻的漿狀混合物。混合物在室溫下干燥8 h后,將其轉入干燥箱中于120 ℃下干燥8 h,然后轉入馬福爐中于900 ℃下焙燒4 h,使硝酸根徹底分解。最后,將得到的載氧體粉碎、篩分,選取40~60目之間的顆粒進行實驗。
1.2 載氧體表征
催化劑的X射線衍射測試在日本理學株式會社生產的D/Max-2500型X射線粉末衍射儀上進行,Cu靶,Kα輻射源,石墨單色器,管電壓40 kV,管電流80 mA。催化劑的程序升溫還原表征采用美國MiCromeritics公司生產的AutoChem 2910型化學吸附儀,在300 ℃、Ar氣氛下預處理60 min后冷卻至室溫,切換成10%H2+90%Ar的混合氣,流速為30 mL/min,待色譜基線平穩后,以10 ℃/min的升溫速率進行程序升溫還原,TCD檢測器。
1.3 載氧體性能評價
實驗裝置由進氣系統、反應系統、分析系統3部分組成。進氣系統由裝有氮氣、空氣、甲烷的鋼瓶組成。反應系統由等溫固定床連續流動反應體系和PID溫度控制器構成。反應管為內徑8 mm的不銹鋼反應器,外部由管式電爐均勻加熱,管式電爐內壁裝有直徑1 mm的K型熱電偶;反應管內部催化劑床層中也裝有直徑為1 mm的K型熱電偶測量床層溫度。反應系統的壓力為常壓。采用Agilent7820A氣相色譜儀進行分析。
取40~60目的載氧體2.5 g,與石英砂等體積混合,裝填反應管中,上、下兩端由石英砂填充。先在N2(流量為50 mL/min)氣氛下將裝置升溫至300 ℃,然后換成空氣(流速為20 mL/min)預處理l h,再用N2(流速為90 mL/min)吹掃,升至反應溫度。待溫度穩定后,通入N2(流速為90 mL/min)與CH4(流速為10 mL/min)的混合氣,反應 3 min,同時用氣袋收集尾氣,送入色譜進行分析。然后用N2吹掃10 min,通入H2O(流速為0.1 mL/min)與N2(流速為30 mL/min),反應5 min,同時用氣袋收集尾氣,送入色譜進行分析。最后通入空氣(流速為15 mL/min),反應3 min后再用N2(流速為50 mL/min)吹掃10 min,這樣就完成一次還原-氧化循環。載氧體穩定性考察采用相同的實驗步驟,進行連續多次還原-氧化循環。
1.4 數據處理



式中:n(CH4,入),n(CH4,出)分別為進、出反應器的甲烷的物質的量;FN2為N2流速;t為反應時間;φ為體積分數。
2 結果與討論
2.1 活性組分Fe2O3負載量的影響
圖2為Fe2O3負載量對Fe2O3/LaNO3載氧體晶型結構的影響。由圖2可知,該載氧體在43.4°處出現了NiO的特征峰,在23.3°,32.8°,41.3°,48.1°,54.4°,58.8°處出現了LaNiO3的特征峰,在37.1°,49.8°,65°處出現了Fe2O3的微弱特征峰,在32.5°、59.9°處出現了LaFeO3的特征峰。其中Fe2O3和NiO為活性組分,LaNiO3和LaFeO3為載體。隨著負載量的增加,LaNiO3的特征峰逐漸減弱,Fe2O3和LaFeO3的特征峰在負載量(w)為15%時最強,說明Fe2O3逐漸負載在LaNiO3表面,使其表面積逐漸減小,Fe2+部分取代了LaNiO3B位中的Ni2+形成了LaFeO3。

圖2 Fe2O3負載量對載氧體晶型結構的影響(XRD圖譜)★—LaFeO3; ●—LaNiO3; ◆—Fe2O3; ▲—NiO


圖3 Fe2O3負載量對Fe2O3/LaNiO3載氧體還原性能的影響(H2-TPR)Fe2O3負載量(w): a—10%; b—15%; c—20%; d—25%
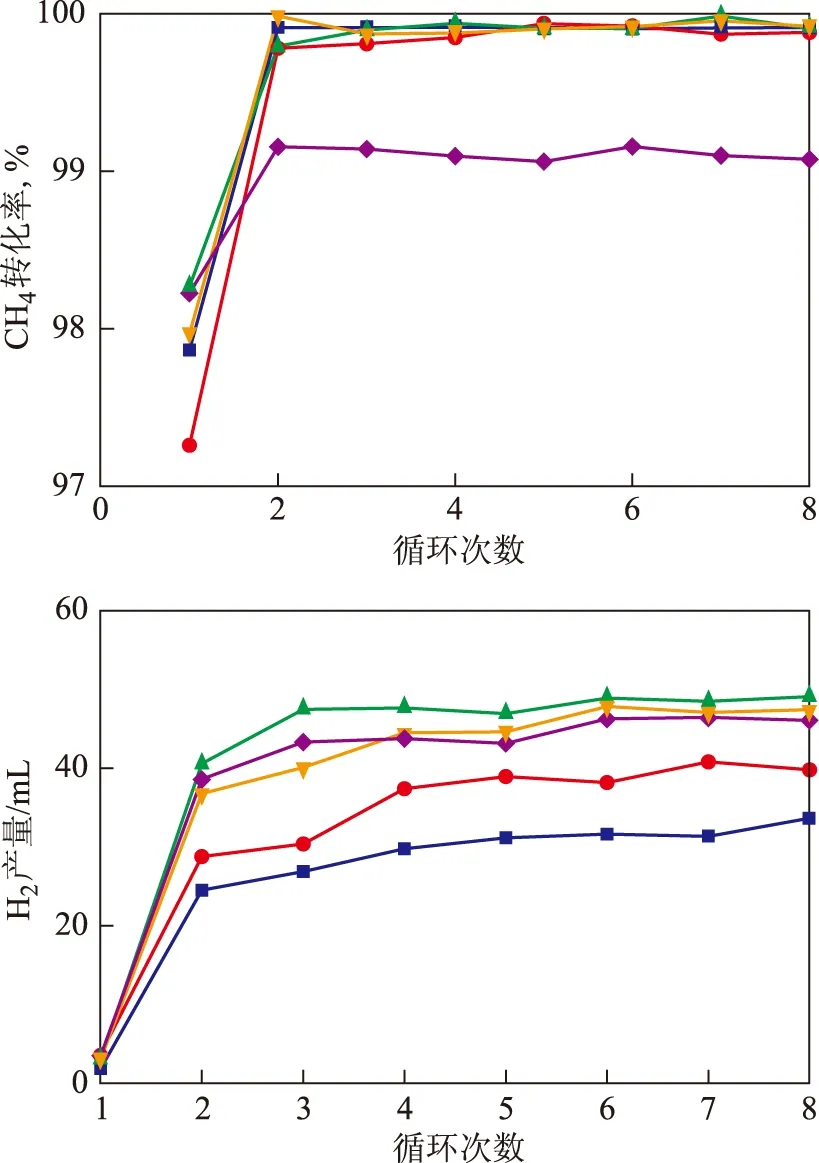
圖4 Fe2O3負載量對載氧體性能的影響■—LaNiO3; ●— 10% Fe2O3/LaNiO3; ▲—15% Fe2O3/LaNiO3;—20% Fe2O3/LaNiO3; ◆—25% Fe2O3/LaNiO3
在劑烷比為2∶1、進水量為0.1 mL、反應溫度為800 ℃的條件下,對不同Fe2O3負載量的載氧體進行性能評價,結果見圖4。由圖4可知,第一次循環甲烷轉化率、氫氣產量較低,之后隨循環次數增加甲烷轉化率、氫氣產量相應增加。這是由于在第一次循環中,載氧體的表面氧參與反應,隨著循環次數的增加,載氧體中的晶格氧釋放出來,使反應能夠徹底進行,從而提高了甲烷轉化率、氫氣產量。此外,第二次循環開始,甲烷幾乎全部轉化,這是由于NiO氧化甲烷的能力強于Fe2O3,NiO先與甲烷反應,再與Fe2O3反應。根據熱力學計算Ni不與水蒸氣反應,說明在燃料反應器中是載氧體中的NiO與甲烷反應,而不是Fe2O3與甲烷反應。隨著Fe2O3負載量的增加,氫氣產量先逐漸增加后有所下降,其中當負載量(w)為15%時,氫氣產量最高。說明Fe2O3對水分解制氫反應起到促進作用。Fe2O3存在一個最佳負載量。當負載量較低時,Fe2O3能較好地負載在LaNiO3上,因此,隨著負載量的增大,表現為反應活性提高。但是,當負載量繼續增大時,會有一部分Fe2O3在LaNiO3載體表面形成較大的團聚顆粒,降低了表面的多孔性,而且容易從LaNiO3表面脫落下來,使其在催化劑研磨和篩分過程中大量損失,從而導致Fe2O3的實際負載量降低。此結果與上述H2-TPR結果相符。
2.2 15%Fe2O3/LaNiO3反應性能的研究
圖5給出了15% Fe2O3/LaNiO3載氧體在劑烷比為2∶1、進水量為0.1 mL、反應溫度為800 ℃下還原反應和氧化反應中氣體組成變化。由圖5可知,還原反應中甲烷與載氧體反應生成CO2、H2和少量CO,而且隨循環次數的增加,各氣體濃度變化不大。氧化反應中水蒸氣與載氧體反應生成H2,此外還有少量CO和CO2生成,說明在還原反應中有積炭形成。圖6給出了15% Fe2O3/LaNiO3載氧體還原反應中的積炭量隨循環次數的變化。由圖6可見,隨循環次數的增加,積炭量降低,這是由于隨著循環次數的增加,反應進行得越來越充分,CO和CO2含量降低。

圖5 15%Fe2O3/LaNiO3載氧體反應氣體組成變化■—H2; ●—CO2; ▲—N2; —CH4; ◆—CO

圖6 15% Fe2O3/LaNiO3載氧體還原反應中的積炭量隨循環次數的變化
2.3 助劑對鐵基載氧體穩定性的影響

圖7 Fe2O3/LaNiO3載氧體穩定性評價結果
在劑烷比為2∶1、進水量為0.1 mL、反應溫度為800 ℃的條件下,對Fe2O3/LaNiO3進行穩定性評價,結果如圖7所示。由圖7可見,Fe2O3/LaNiO3能促使甲烷全部轉化,但是多次循環后氫氣產量明顯下降,這是因為多次循環后,Fe2O3/LaNiO3載氧體變成一個含有多價態鐵的混合物,并且部分鈣鈦礦結構發生分解,與新鮮載氧體相比結構和成分都發生了變化。因此,要考慮在載氧體中添加助劑。圖8給出了CeO2-Fe2O3/LaNiO3、載氧體穩定性能的評價結果。由圖8可知:該載氧體能促使甲烷全部轉化,而且經過100次循環后,H2產量仍能保持較高的水平。這是因為在100次循環過程中,CeO2-Fe2O3/LaNiO3載氧體中Ce與Fe逐漸形成CeFeO3固溶體,提高了載氧體的含氧量,使載氧體循環100次后仍保持高活性,但是隨反應的進行,還原過程可能產生積炭,隨載氧體轉移到氧化過程,形成CO2和CO,使H2產量受到影響。

圖8 助劑CeO2對CeO2-Fe2O3/LaNiO3載氧體評價結果的影響
2.4 反應溫度的影響
2.4.1 還原溫度的影響 圖9給出了5%CeO2-15%Fe2O3/LaNiO3在氧化溫度800 ℃、不同還原溫度下的評價結果。由圖9可知,在800 ℃以上,從第二個循環開始,甲烷全部轉化,升高溫度有利于甲烷轉化,并且提高了氣體的分子擴散,促進了載氧體的還原。反應溫度高對設備要求高,從而提高成本,因此該反應的最佳溫度為800~850 ℃。

圖9 還原溫度對CeO2-Fe2O3/LaNiO3載氧體評價結果的影響■—900 ℃; ●—850 ℃; ▲—800 ℃; ℃

圖10 氧化溫度對CeO2-Fe2O3/LaNiO3載氧體評價結果的影響■—800 ℃; ●—850 ℃; ▲—900 ℃
2.4.2 氧化溫度的影響 圖10給出了還原溫度900 ℃、不同氧化溫度下的評價結果。由圖10可知,甲烷轉化率和氫氣產量隨循環次數增加略有提高,這是由于隨反應的進行,載氧體還原程度不斷加深。此外,甲烷轉化率受氧化溫度影響不大,850 ℃下,氫氣產量最高,升高溫度,在動力學上有利于提高水分解制氫的反應速率。900 ℃時,氫氣產量較低,可能是因為過高的溫度導致載氧體發生燒結或分解堵塞管路使氣體含量降低。因此,該反應最佳溫度為800~850 ℃。
3 結 論
(1) 采用檸檬酸絡合法制備載體LaNiO3、浸漬法制備鐵基載氧體CeO2-Fe2O3/LaNiO3,隨著Fe2O3負載量的增加,甲烷能夠全部轉化,當Fe2O3的負載量(w)為15%時,氫氣產量最高。結合H2-TPR分析結果可知,Fe2O3存在一個最佳負載量。
(2) 助劑CeO2的添加提高了載氧體的反應性能,使其經過100次循環后,仍保持一定的穩定性。并且5%CeO2-15%Fe2O3/LaNiO3載氧體在固定床反應器、還原溫度為800 ℃、氧化溫度為800 ℃、劑烷比為2∶1、進水量為0.1 mL的條件下連續循環100次后仍可保持高活性。
[1] 蔡熾柳.氫能及其應用前景分析[J].能源與環境,2008(5):39-41
[2] 張西子.氫能源及其利用[J].科技致富向導,2012(23):62-63
[3] 劉少文,吳廣義.制氫技術現狀及展望[J].貴州化工,2003,28(5):4-6
[4] 褚洪嶺,王桂芝,龔凡,等.制氫工藝技術經濟與新技術[J].化工技術經濟,2005,23(9):36-40
[5] Otsuka K,Yamada C,Kaburagi T.Hydrogen storage and production by redox of iron oxide for polymer electrolyte fuel cell vehicles[J].Int J Hydrogen Energy,2003,28(3):335-342
[6] Li Fanxing,Zeng Liang,Velazquez-Vargas L G.Syngas chemical looping gasification process:Bench-scale studies and reactor simulations[J].AIChE Journal,2010,56(8):2186-21
[7] 段維慧,張建民,陳磊.化學鏈燃燒技術的研究現狀[J].山西能源與節能,2007,44(1):31-34
[8] 劉黎明,趙海波,鄭楚光.化學鏈燃燒方式中氧載體的研究進展[J].煤炭轉化,2006,29(3):83-92
[9] 馬曉瑜,李燕,王歡龍,等.鈣鈦礦儲氧材料的制備與表征[J].內蒙古科技大學學報,2012,31(4):333-336
[10]Fan Liangshi,Li Fanxing,Ramkumar Shwetha.Utilization of chemical looping strategy in coal gasification processes[J].Particuology,2008,6:131-142
[11]Zeng Liang,He Feng,Li Fanxing,et al.Coal-direct chemical looping gasification for hydrogen production:Reactor modeling and process simulation[J].Energy Fuels,2012,26(6):3680-3690
[12]Yang Jingbiao,Cai Ningsheng,Li Zhenshan.Hydrogen production from the steam-iron process with direct reduction of iron oxide by chemical-looping combustion of coal char[J].Energy Fuels,2008,22(4):2570-2579.
[13]史奇良,陳時熠,薛志鵬,等.鐵基載氧體化學鏈制氫特性實驗研究[J].中國電機工程學報,2011(S1):168-174
[14]Murugan A,Thursfield A,Metcalfe I S.A chemical looping process for hydrogen production using iron-containing perovskites[J].Energy & Environmental Science,2011,4(11):4369-4649
[15]梁皓,宋喜軍,尹澤群,等.化學鏈制氫中Fe2O3/LaFeO3載氧體的性能研究[J].燃料化學學報,2013,41(12):1513-1519
[16]Liang Hao,Zhang Xiwen,Fang Xiangchen,et al.Performance of Ni-based,Fe-based and Co-based oxygen carriers in chemical-looping hydrogen generation[J].China Petroleum Processing and Petrochemical Technology,2013,15(2):53-58
[17]梁皓,尹澤群,張喜文,等.化學鏈燃燒反應中LaFe1-xCoxO3載氧體的性能研究[J].石油煉制與化工,2013,44(6):12-16
[18]Ryden M,Lyngfelt A.Using steam reforming to produce hydrogen with carbon dioxide capture by chemical-looping combustion[J].International Journal of Hydrogen Energy,2006,31(10):1271-1283
STUDY ON APPLICATION OF Fe-BASED OXYGEN CARRIER IN CHEMICAL LOOPING HYDROGEN GENERATION
Zhang Xin1, Ma Bo1, Liang Hao2, Yin Zequn2
(1.DepartmentofChemicalIndustryandEnvironment,LiaoningShihuaUniversity,Fushun,Liaoning113001; 2.SINOPECFushunResearchInstituteofPetroleumandPetrochemicals)
Fe2O3/LaNiO3and CeO2-Fe2O3/LaNiO3were prepared by citric acid complexation method and immersion method, and was used as the oxygen carrier in chemical looping hydrogen generation. The experiment was conducted under the conditions:ratio of Fe2O3to CH4of 2∶1, water 0.1 mL, and atmospheric pressure to investigate the effect of reaction temperature. The results show that H2output increases first and then decreases with increasing Fe loading. The optimum loading of Fe is 15%; Addition of CeO2improves the stability of the oxygen carrier. Under the condition of atmospheric pressure, ratio of Fe2O3to CH4of 2, 0.1 mL of water, reduction and oxidation reaction temperature of 800 ℃, the 5%CeO2-15%Fe2O3/LaNiO3oxygen carrier can be repeatedly used for 100 times with high activity.
chemical looping hydrogen generation; oxygen carrier; perovskite; methane
2014-08-26; 修改稿收到日期: 2015-02-12。
張鑫,碩士研究生,從事化學鏈制氫研究。
馬波,E-mail:mb6062@sohu.com。

