實時熒光定量PCR技術在植物中的應用
崔穎++王秀娟++高山++王國澤
摘要:實時熒光定量PCR技術是在PCR反應體系中加入熒光染料或熒光探針,利用熒光信號積累來實現實時監測整個PCR反應進程,最后通過標準曲線對未知模板進行定量分析。該技術實現了PCR從定性到定量的轉變。介紹了實時熒光定量PCR技術的原理、分類及優缺點,綜述了近年來實時熒光定量PCR技術在植物中的應用概況及其研究進展,旨在為該技術的進一步開發應用提供理論參考。
關鍵詞:實時熒光定量PCR技術;原理;內參基因;植物抗逆性;轉基因產品
中圖分類號:Q503;Q943.2 文獻標識碼:A 文章編號:0439-8114(2015)13-3073-05
DOI:10.14088/j.cnki.issn0439-8114.2015.13.001
The Application of Real-time Fluorescent Quantitative PCR in Plant
CUI Ying,WANG Xiu-juan,GAO Shan,WANG Guo-ze
(School of Mathematical Physics and Biology Engineering, Inner Mongolia University of Science and Technology,
Baotou 014010, Inner Mongolia, China)
Abstract: Real-time fluorescent quantitative PCR (RQ-PCR) is a detection method by adding fluorescent dyes or fluorescent probe into the PCR reaction system,using fluorescent signal accumulation to monitor amplification reactions of PCR reaction process,and finally the unknown template can be quantitative through the standard curve.So the detection level of PCR has improved from the qualitative to the quantitative.In order to provide theoretical reference for further application,the principle, classification,advantages and disadvantages of RQ-PCR were introduced,and its application and progress in plants in recent years were reviewed.
Key words:real-time fluorescent quantitative PCR(RQ-PCR);principle;reference gene;stress resistance of plant;transgenic products
20世紀80年代凱利·穆利斯(Kary Mullis)發明了聚合酶鏈式反應(Polymerase chain reaction, PCR)[1]。該技術是體外快速擴增特定基因或DNA序列最常用的方法。但其定量方法只能通過凝膠電泳檢測擴增產物來進行分析,由于平臺效應的存在,定量的準確性受到影響,且操作過程中易污染而使得假陽性率高。準確地說常規PCR是一種定性的技術。直到1996年Applied Biosystems公司推出實時熒光定量PCR(Real-time fluorescent quantitative PCR,RQ-PCR)技術,它不僅實現了PCR從定性到定量的飛躍,而且與常規PCR相比,RQ-PCR具有簡便易行、靈敏度高、特異性強等優點,而且也有效解決了常規PCR假陽性率高等缺點[2]。
1 RQ-PCR技術的概述
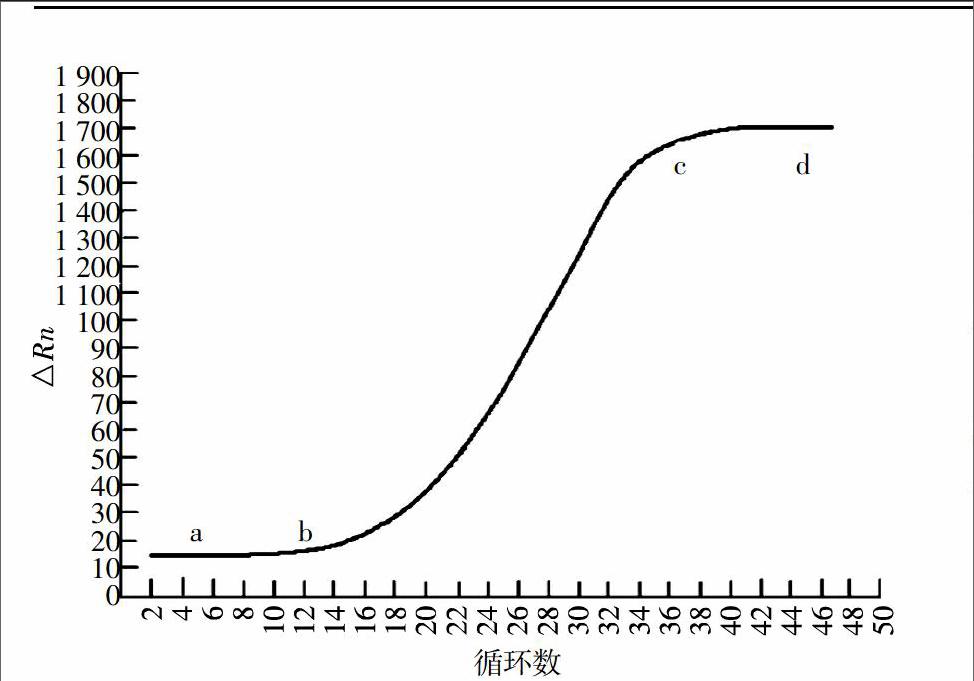
RQ-PCR技術是在PCR基礎上發展起來的,它將核酸擴增、雜交、光譜分析和實時檢測等技術融合在一起。RQ-PCR反應即是在常規PCR反應中加入熒光化學物質,隨著PCR的不斷進行,PCR產物在逐步積累,熒光信號也相應地發生有規律的變化。每經過一次循環就可以收集一個熒光信號。這樣就可以繪出一條熒光擴增曲線圖(圖1)。通常,該圖呈“S”型,分為3個時期:熒光背景信號階段、熒光信號指數期和平臺期[3]。
在熒光背景信號階段,由于擴增的熒光信號會被PCR儀系統內部存在的固有熒光信號所遮蓋,因此無法進行定量;在平臺期,PCR的終產物量與起始拷貝數之間無相應的線性關系。只有在指數期,PCR產物量的對數值與起始模板量存在線性關系,可以由此階段進行定量分析[4]。簡而言之,所謂RQ-PCR技術,是指在PCR反應體系中加入熒光基團,利用熒光積累實時監測整個PCR進程,最后通過標準曲線對未知模板進行定量分析的方法。
2 RQ-PCR的分類
RQ-PCR的類型分為探針式和非探針式。其中非探針式又成為染料法,是利用染料或特殊設計的引物來指示擴增的增加。其優點是簡便易行,缺點是無特異性。而探針式則是利用與靶序列特異性雜交的探針來指示擴增產物的增加。其優點是特異性高,缺點是探針設計難度大,成本高。
2.1 探針式熒光檢測技術
探針式熒光檢測技術就是利用熒光共振能量轉移原理來設計探針[5],在探針5′端標記一個熒光報告基團(Reporter,R),3′端標記一個淬滅基團(Quencher,Q),二者可以構成能量傳遞。當R基團與Q基團距離較近時,Q基團可以吸收或抑制R基團發出的熒光;當R基團和Q基團相距較遠時,Q基團則不能再吸收或抑制R基團所發出的熒光,這時R基團的熒光釋放出來,熒光信號增強。常用的有TaqMan探針、分子信標等。endprint
2.2 非探針式熒光檢測技術(染料法)
該方法是利用染料無法與單鏈DNA結合而可以與雙鏈DNA結合并在結合時發出熒光信號,而在游離狀態下則不發出熒光信號[6]的原理得以實現的。因此可以用熒光信號強度來代表雙鏈DNA的數量,進而來計算PCR的擴增產物量。目前主要使用的是SYBR Green I。
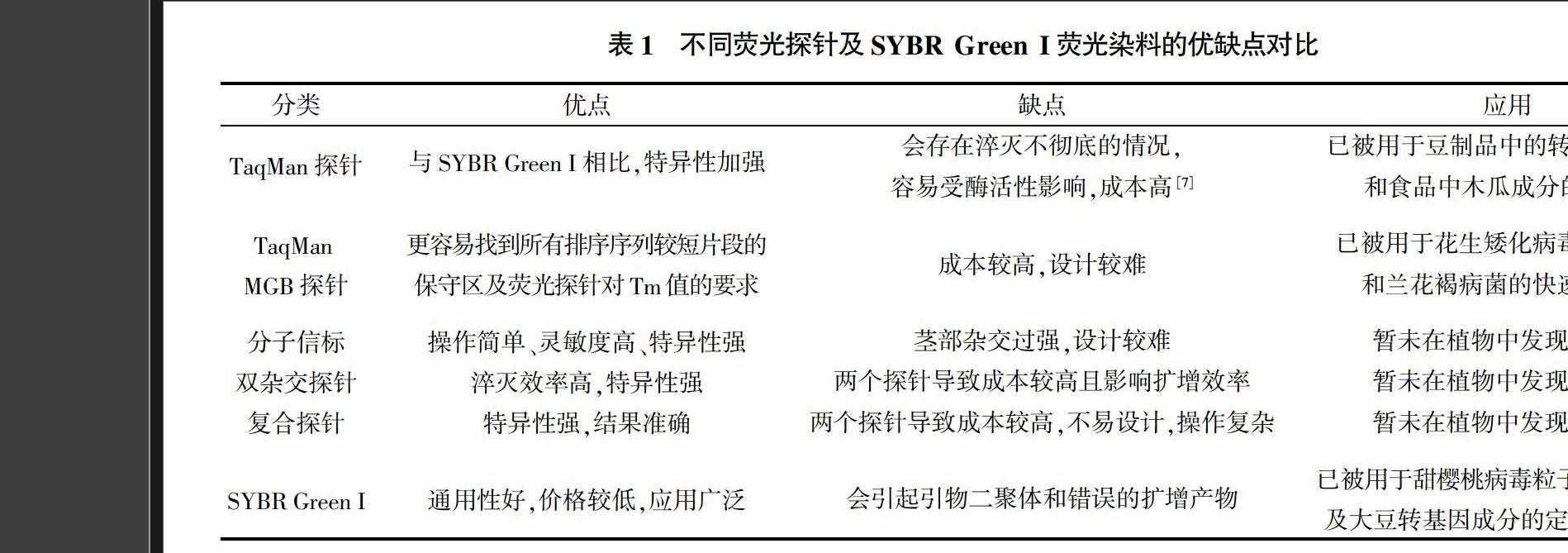
3 不同熒光探針及SYBR Green I熒光染料的優缺點
不同熒光探針及SYBR Green I熒光染料的分類情況、優缺點對比及在實踐中的應用概況如表1所示。
4 RQ-PCR的優缺點
RQ-PCR技術是在常規PCR技術下加入熒光染料或熒光探針,這樣PCR的每次循環都會檢測到熒光信號的變化。在進行RQ-PCR時,我們只需在加樣時打開一次PCR反應管,之后所有的檢測和定量都是在電腦分析軟件下進行的。所以RQ-PCR與常規PCR相比存在許多優點,但也有自身的不足。其優點在于特異性好、準確性和自動化程度高且節約時間,缺點是所需熱循環儀和試劑相對普通PCR昂貴[14,15]。
5 RQ-PCR技術在植物中的應用
RQ-PCR技術是一種很好的檢測基因表達的方法,通過RQ-PCR可以分析植物在不同處理條件下基因樣本的表達差異,也可以分析植物在不同生長發育時期基因表達的差異。
5.1 植物中內參基因的篩選
RQ-PCR是檢測低豐度mRNA的敏感方法,通過比較不同樣本的RNA產量、質量及逆轉錄上可能存在的差別,獲得目的基因特異性表達的真正差異。但是在應用RQ-PCR檢測目的基因表達量時,必須選擇合適的內參基因進行校正和標準化[16]。內參基因是指其表達水平不受研究條件的影響且可以在多種樣本間恒定表達的已知參照基因[17]。因此,內參基因在進行擴增中的變化可以反映出RNA數量、質量和cDNA合成效率的變化。
在植物學研究中,常用的穩定表達的內參基因有甘油醛-3-磷酸-脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因[18]、肌動蛋白基因(actin)[19]、微管蛋白基因(tubulin)[20]和18s RNA[21]等。然而,迄今為止尚未發現一種內參基因可適用于所有植物樣本進行校正和標準化。因此,在進行RQ-PCR分析中,必須根據樣品的不同來選擇一種或一種以上的內參基因進行校正,以盡量去除試驗中的不穩定因素[22]。geNorm軟件是一種內參基因選擇的良好工具,該軟件首先將某一內參基因與其他內參基因表達水平進行兩兩比較和對數轉換,獲得平均標準差后并將該平均標準差作為基因表達穩定度的平均值M,然后將所有候選內參基因的M值進行排序,M值越小,基因表達穩定度越高,同時判定樣本所需內參基因的最適數目[23]。
Kong等[24]用RQ-PCR檢測了甜瓜在生物脅迫、非生物脅迫及植物生長調節劑處理的根和葉中以及果實不同發育階段下14種常用內參基因的表達量,并確定了相應的最適內參基因。Borowski等[25]利用RQ-PCR分析了傳統的14種內參基因和新的3種MIR169,MIR170/171,MIR172基因,發現生菜受到鹽脅迫時傳統的14種內參基因最為合適;而在重金屬脅迫、干旱脅迫等非生物脅迫下,3種新的基因更適合做內參基因。Chan等[26]對采用RQ-PCR技術對油棕的內參基因進行了驗證,發現pOP-EA01332,PD00380和PD00569的穩定性高于其傳統的管家基因。
5.2 RQ-PCR技術對植物中抗性基因的表達分析
近年來對植物抗性基因的研究已經成為熱點和焦點問題,傳統的Northern blot和常規PCR方法很難準確和快速分析出該基因的表達量差異,而RQ-PCR技術具有快速和準確分析出植物在不同處理條件下該基因表達量差異的特點。
選取適當的內參基因,并設計出疑似抗性基因和已選取的內參基因引物,在對植物進行了不同處理后通過RQ-PCR技術檢測疑似抗性基因和內參基因的表達量。其表達量的確定是根據標準曲線所得的線性計算出來的,就是將樣品的Ct值代入公式,得到其相對濃度。同一個模板中的疑似抗性基因和內參基因的相對濃度的比值即可作為疑似抗性基因相對表達水平,從而來幫助確定抗性基因[27]。
徐德昌等[28]利用RQ-PCR技術檢測了甜菜在低溫脅迫下相關基因miRNA中表達的變化量,證明miRNA156、157、167、319、396是甜菜中響應低溫信號的調控分子。馮靜弦等[29]利用RQ-PCR技術檢測擬南芥在熱脅迫下的miRNA表達,發現mi414,415837-5p,f10546-akr這3種相關基因在表達量上發生了變化。揚帆等[30]和Srivastava等[31]采用RQ-PCR技術分別分析了鹽脅迫下構樹DREB轉錄因子基因表達量的變化及不同程度的鹽脅迫下芥菜種子應答的全部基因組,并以此來鑒定抗逆性的信號傳遞。Song等[32]用cDNA-AFLP技術分析了河北楊在干旱脅迫下轉錄因子的差異表達,并利用RQ-PCR技術檢測發現了不同失水量下的24個轉錄因子的差異表達模式。Dung等[33]通過RQ-PCR技術評測了大豆組織在各種非生物脅迫下的內參基因。
5.3 RQ-PCR技術在轉基因產品中的應用
植株在轉化過程中外源基因DNA片段是隨機插入植物基因組內的,插入的拷貝數一般是不固定的。因此,轉基因植物中外源基因拷貝數常影響目的基因的表達水平和遺傳穩定性。由此可見,轉基因研究中關鍵的一步就是檢測外源基因的拷貝數,以篩選出拷貝數少或是單拷貝的轉基因植株供給進一步的研究和育種[34]。
傳統的轉基因拷貝數檢測主要是Southern blot,但該方法工作量大,需要的DNA材料較多,費時費力,并且經常需要用到放射性同位素等具有潛在危險的藥品,而RQ-PCR具有高通量、快速、靈敏、安全等優點,近年來被廣泛用于轉基因產品的檢測中[35]。endprint
5.3.1 用來確定是否為轉基因食品 利用RQ-PCR技術,采用相對定量法,根據Ct值與起始模板數的對數值呈反比線性關系的原理制作標準曲線,獲得Ct值與起始模板數的相對線性方程,將樣品的Ct值代入該方程就可獲得目的基因的起始模板數,通過與內參基因的比較就可以知道基因組中該外源基因拷貝數,由此則可以判斷出該食品是否為轉基因食品[36]。
目前已經用于對轉基因的大豆、玉米、小麥、油菜等作物的檢測[37]。Hernandez等[38]利用RQ-PCR技術對轉基因玉米MON810中的轉基因成分進行了檢測。Taverniers等[39]利用RQ-PCR技術對轉基因油菜子中的Barnase基因進行了檢測。Mieog等[40]用RQ-PCR技術快速分析轉基因谷物中的純合體。Mohamed等[41]用RQ-PCR檢測了轉基因杏中的嵌合體并有效地監控其分離。Madhugiri等[42]利用RQ-PCR的靈敏性來檢測木瓜種子轉基因和非轉基因的混合體。
5.3.2 用于轉基因產品含量的檢測 利用RQ-PCR技術分別對轉基因標準品和待測樣品進行擴增,記錄下其各自內參基因和目的基因的Ct值,計算出標準品的內參基因和目的基因的Ct值之差,即△Ct,然后以標準品的轉基因百分含量與△Ct作出標準曲線,并用標準曲線的回歸方程計算待測樣品中的轉基因百分含量[43]。
目前TaqMan探針已經被用在轉基因農作物的定量檢測上,靈敏度達到0.1%[43]。Hird等[44]利用RQ-PCR技術對轉基因大豆、玉米進行了檢測,結果顯示,大豆與標準含量的誤差僅為0.1%,在3種不同玉米品種的誤差僅為2.0%、10.0%和7.0%。陳穎等[45,46]利用RQ-PCR技術對大豆和玉米的內源基因和外源基因進行了檢測并建立了商業化轉基因大豆以及轉基因玉米的定量方法。
5.4 RQ-PCR技術對植物同源基因的分析
利用RQ-PCR技術對植物同源基因進行檢測,可以幫助理解用來編碼蛋白質基因的功能[47]。Shimada等[48]利用RQ-PCR技術檢測了擬南芥中油菜素甾醇的生物合成、分解和信號轉導過程,為油菜素甾醇的代謝提供了一個更完整的途徑。Anterola等[49]利用RQ-PCR證實了松樹中有7個至關重要的基因對木質素前體物質的新陳代謝起到調節作用。
6 應用前景
因為RQ-PCR具有特異性好,精確性高,可以定量檢測,并且誤差小以及操作簡便,自動化程度高,擴增和檢測一步完成等優點,所以目前已廣泛用于分子生物學和醫學研究等領域,如mRNA表達和研究、SNP、人類和動物疾病的快速檢測等方面[50]。隨著分子生物技術的不斷發展,再結合其他技術,RQ-PCR技術將會在許多領域有所發展,尤其是在植物育種、植物病理檢疫等方面有望發揮更大的作用[51]。
參考文獻:
[1] MULLIS K B. The unusual origin of the polymerase chain reaction[J]. Scientific American, 1990, 262: 56-61.
[2] 趙煥英,包金鳳. 實時熒光定量PCR技術的原理及其應用研究進展[J]. 中國組織化學和細胞化學雜志,2007,16(4):492-497.
[3] 周曉麗,朱國坡,李雪華,等.實時熒光定量PCR技術原理與應用[J].中國畜牧獸醫,2010,37(2):87-89.
[4] HEID C A,STEVENS J,LIVAK K J,et al.Real time quantitative PCR [J].Genome Research, 1996, 6(10):986-994.
[5] 袁亞男,劉文忠.實時熒光定量PCR技術的類型、特點與應用[J].中國畜牧獸醫,2008,35(3):27-30.
[6] 張 蓓,沈立松.實時熒光定量PCR的研究進展及其應用[J].國外醫學臨床生物化學與檢驗學分冊,2003,24(6):327-329.
[7] 蔡 霞.定量PCR技術及其應用[J].現代診斷與治療,2005, 16(2):112-115.
[8] 焦新萍,曾金紅,鄭云峰,等.發酵豆制品中轉基因成分的熒光定量PCR研究[J].食品研究與開發,2013,34(13):79-83.
[9] 李富威,張舒亞,葉 軍,等.食品中木瓜成分實時熒光PCR檢測方法[J].食品研究與開發,2013,34(11):51-56.
[10] 聞偉剛,譚 鐘,張 穎.基于TaqMan MGB探針的花生矮化病毒檢測研究[J].植物保護,2010,36(3):121-124.
[11] 丁翠珍,趙文軍,寸東義,等.蘭花褐斑病菌實時熒光PCR檢測[J].植物病理學報,2010,40(3):235-241.
[12] 宗曉娟,王文文,王甲威,等.SYBR Green I實時定量RT-PCR技術在甜櫻桃病毒定量分析中的應用[J].植物保護學報,2012,39(6):497-501.
[13] 王小花,李建祥,王國卿,等.SYBR Green I實時熒光定量PCR檢測大豆轉基因成分[J].食品科學,2009,30(8):171-176.
[14] 馬月萍,戴思蘭,馬艷蓉.熒光定量PCR技術在植物研究中的應用[J].生物技術通報,2011(7):37-45.
[15] 張 賀,李 波,周 虛,等.實時熒光定量PCR技術研究進展及應用[J].動物醫學進展,2006,27(增):5-12.
[16] 董曉麗,王加啟,卜登攀,等.內參基因在實時熒光定量PCR中的研究進展[J].中國畜牧獸醫,2009,36(9):83-85.endprint
[17] 董恩妮,梁 青,李 利,等.實時熒光定量PCR內參基因的選擇[J].中國畜牧雜志,2013,49(11):92-96.
[18] SEKALSKA B, CIECHANOWICZ A, DOLEGOWSKA B, et al. Optimized RT-PCR method for assaying expression of monocyte chemotactic protein type 1 (MCP-1) in rabbit aorta[J]. Biochemistry Genetics, 2006, 44: 133-143.
[19] LI L, XU J, XU Z H, et al. Brassinosteroids stimulate plant tropisms through modulation of polar auxin transport in Brassica and Arabidopsis [J]. Plant Cell, 2005, 17: 2738-2753.
[20] JEONG Y M, MUN J H, LEE I, et al. Distinct roles of the first introns on the expression of Arabidopsis profilin gene family members[J]. Plant Physiology,2006,140(1):196-209.
[21] BUSTIN S A. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays [J]. Journal of Molecular Endocrinalogy, 2000, 25:169-193.
[22] 張積森,李 偉,闕友雄,等.斑茅兩個看家基因片段的克隆及其在基因芯片中的應用[J].熱帶亞熱帶植物學報,2007,15(4):277-283.
[23] VANDESOMPELE J, DE P K, PATTYN F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7): 1-12.
[24] KONG Q S, YUAN J X, NIU P H, et al. Screening suitable reference genes for normalization in reverse transcription quantitative real-time PCR analysis in melon [J]. PLOS ONE, 2014, 9(1): 1-11.
[25] BOROWSKI J M, GALLI V, MESSIAS R DA S, et al. Selection of candidate reference genes for real-time PCR studies in lettuce under abiotic stresses[J]. Planta, 2014, 239: 1187-1200.
[26] CHAN P L, ROSE J R, MURAD A M A, et al. Evaluation of reference genes for quantitative real-time PCR in oil palm elite planting materials propagated by tissue culture[J]. PLOS ONE, 2014, 9(6):1-13.
[27] 王偉偉.基于實時熒光定量PCR的植物轉基因檢測技術的改進與應用[D].杭州:浙江大學,2011.
[28] 徐德昌,紀 巍,程大友,等.TaqMan探針熒光定量PCR檢測甜菜低溫脅迫相關miRNAs[J].中國甜菜糖業,2008(4):3-6.
[29] 馮靜弦,汪啟明,胡 琪,等.擬南芥中熱脅迫microRNA的差異表達[J].湖南農業科學,2012(3):10-13.
[30] 楊 帆,丁 菲,杜天真.鹽脅迫下構樹DREB轉錄因子基因的實時熒光定量PCR分析[J].林業科學,2010,46(4):146-150.
[31] SRIVASTAVA A K, RAMASWAMY N K, SUPRASANNA P, et al. Genome-wide analysis of thiourea-modulated salinity stress-responsive transcripts in seeds of Brassica juncea: Identification of signaling and effector components of stress tolerance [J]. Annals of Botany,2010,106:663-674.
[32] SONG Y P, WANG Z L, BO W H, et al. Transcriptional profiling by cDNA-AFLP analysis showed differential transcript abundance in response to water stress in Populus hopeiensis [J]. BMC Genomics, 2012, 13: 286-304.endprint
[33] DUNG T L, ALDRICH D L, BABU V, et al. Evaluation of candidate reference genes for normalization of quantitative RT-PCR in soybean tissues under various abiotic stress conditions[J]. PLOS ONE, 2012, 7(9): 1-10.
[34] 王育花,趙 森,陳 芬.利用實時熒光定量PCR法檢測轉基因水稻外源基因拷貝數的研究[J].生命科學研究,2007,11(4):301-305.
[35] WENG H B, PAN A H, YANG L T, et al. Estimating number of transgene copies in transgenic rapeseed by real-time PCR assay with HMG I/Y as an endogenous reference gene[J]. Plant Molecular Biology Reporter, 2004, 22: 289-300.
[36] 代曉燕,蘇以榮,魏文學,等.煙草Nt-syr1基因實時熒光定量PCR檢測方法[J].中國煙草科學,2008,29(3):20-24.
[37] 敖金霞,高學軍,仇有文.實時熒光定量PCR技術在轉基因檢測中的應用[J].東北農業大學學報,2009,40(6):141-144.
[38] HERNANDEZ M, PLA M. A specific real-time quantitative PCR detection system for event MON810 in maize yield Gardw based on the 30-transgene integration sequence[J]. Transgenic Research, 2003(12): 179-189.
[39] TAVERNIERS I, WINDELS P, VAITILINGOM M, et al. Event-specific plasmid standard and real-time PCR methods for transgenic Bt11, Bt176, and GA21 maize and transgenic GT73 canola[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 3041-3052.
[40] MIEONG J C, HOWITT C A, RAL J P. Fast-tracking development of homozygous transgenic cereal lines a simple and highly flexible real-time PCR assay [J]. BMC Plant Biology, 2013, 13: 71-80.
[41] MOHAMED F, LYDIA F, LORENZO B. Using quantitative real-time PCR to detect chimeras in transgenic tobacco and apricot and to monitor their dissociation [J]. BMC Biotechnology, 2010, 10: 53-61.
[42] MADHUGIRI N R, CHARLES K, SUJATA A, et al. Sensitivity of a real-time PCR method for the detection of transgenes in a mixture of transgenic and non-transgenic seeds of papaya(Carica papaya L.) [J]. BMC Biotechnology, 2013, 13:69-80.
[43] PERMINGEAT H R, REGGIARDO M I, VALLEJOS R H. Detection and quantification of transgenes in grains by multiplex and real-time PCR [J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4431-4436.
[44] HIRD H, POWELL J, JOHNSON M L, et al. Determination of percentage of roundup ready soya in soya flour using real-time polymerase chain reaction: Interlaboratory study[J]. Journal AOAC International. 2003, 86(1): 66-71.
[45] 陳 穎,徐寶梁,蘇 寧,等.實時熒光定量PCR技術檢測轉基因大豆方法的建立[J].食品與發酵工業,2003,29(8):65-69.
[46] 陳 穎,徐寶梁,蘇 寧,等.實時熒光定量PCR技術在轉基因玉米檢測中的應用研究[J].作物學報,2004,30(6):602-607.
[47] GACHON C,MINGAM A, CHARRIER B. Real-time PCR: What relevance to plant studies? [J]. Journal of Experimental Botany, 2004, 55: 1445-1454.
[48] SHIMADA Y, GODA H, NAKAMURA A, et al. Organ-specific expression of brassinosteroids biosynthetic genes and distribution of endogenous brassinosteroids in Arabidopsis[J]. Plant Physiology, 2003, 131: 287-297.
[49] ANTEROLA A M, JEON J H, DAVIN L B, et al. Transcriptional control of monolignol biosynthesis in Pinus taeda: Factors affecting monolignol ratios and carbon allocation in phenylpropanoid metabolism[J]. The Journal of Biological Chemistry, 2002, 277(21): 18272-18280.
[50] 廉紅霞,高騰云.實時熒光定量PCR定量方法研究進展[J].江西農業大學學報,2010,22(10):128-129.
[51] 胡 昊,李進進,王彩云.反轉錄實時定量PCR在植物基因表達分析上的研究進展[J].中國農學通報,2013,29(15):127-134.
收稿日期:2014-11-15
基金項目:國家自然科學基金項目(31260406);內蒙古自然科學基金項目(2012MS0502)
作者簡介:崔 穎(1989-),女,內蒙古包頭人,在讀碩士研究生,研究方向為果蔬采后生物技術,(電話)15949482207(電子信箱)
cuiying_1989@126.com;通信作者,王國澤(1975-),女,內蒙古赤峰人,教授,博士,主要從事農產品加工與貯藏方向的研究,
(電子信箱)lycwgz@126.com。endprint

