藜麥愈傷組織誘導體系優化研究
俞涵譯 蔣玉蓉 毛澤陽等

摘要:以9個藜麥(Chenopodium quinoa Willd.)品種為材料,對藜麥莖段、子葉不同外植體的愈傷組織誘導效果進行比較,同時對莖段的愈傷組織誘導以及愈傷組織增殖體系進行優化試驗。結果表明:誘導愈傷組織最佳外植體為莖段,9個品種在培養基MS+0.5mg/L 2,4-D中用莖段誘導愈傷組織的平均誘導率達90%;在愈傷組織誘導優化試驗中,處理Ⅵ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT+0.5mg/L NAA)和處理Ⅱ(MS+0.5 mg/L 2,4-D)對藜麥愈傷組織的誘導率相近,但是愈傷形態差別較大,后者誘導形成疏松、有光澤、黃白色愈傷組織,因此MS+0.5 mg/L 2,4-D培養基為最佳愈傷組織誘導培養基;2,4-D與KT、NAA搭配使用時,愈傷組織增殖速率明顯上升。
關鍵詞:藜麥;組織培養;愈傷組織誘導;增殖率
中圖分類號: Q943.1 文獻標志碼: A
文章編號:1002-1302(2015)03-0026-04
藜麥(Chenopodium quinoa Willd.)別稱南美藜、藜谷、奎奴亞藜等,是1年生藜科草本作物,在安第斯山脈已有5 000多年的種植歷史,被印加人稱為“谷物之母” “安第斯山的真金”[1-2]。藜麥中蛋白質含量為13%~23%,含有人體必需的9種氨基酸且比例平衡,富含不飽和脂肪酸、類黃酮、維生素E等多種有益化合物,是聯合國糧農組織(FAO)推薦的唯一的單體植物就可以滿足人體全部基本物質需求的完美全營養食品,被譽為“未來的超級谷物”“營養黃金”“有機谷類之王”[3-4]。藜麥喜熱帶、亞熱帶干濕氣候,生長適溫14.0~18.0 ℃,營養生長階段可耐輕度霜凍(-1.0~0 ℃),種子結實之后可耐-6.0 ℃低溫,對鹽堿、干旱、霜凍、病蟲害等抗性能力都很強[5]。 1987年西藏自治區農牧學院、西藏自治區農牧科學院開始藜麥引種試驗[6]。目前藜麥在陜西省西安市、山西省、青海省、四川省等地區均有規模化種植。目前,關于藜麥的研究主要集中在生物學特性[6-7]、化學成分[8-9]、抗逆性等生理學特性[10-11]方面。有關藜麥組織培養研究尚未見報道。本研究對9個藜麥品種進行適宜外植體篩選,研究不同激素處理組合對藜麥莖段愈傷組織誘導、增殖的影響,旨在為藜麥再生體系構建,以及通過轉基因、體細胞雜交等手段獲得藜麥新品種奠定生物學基礎。
1 材料與方法
1.1 材料
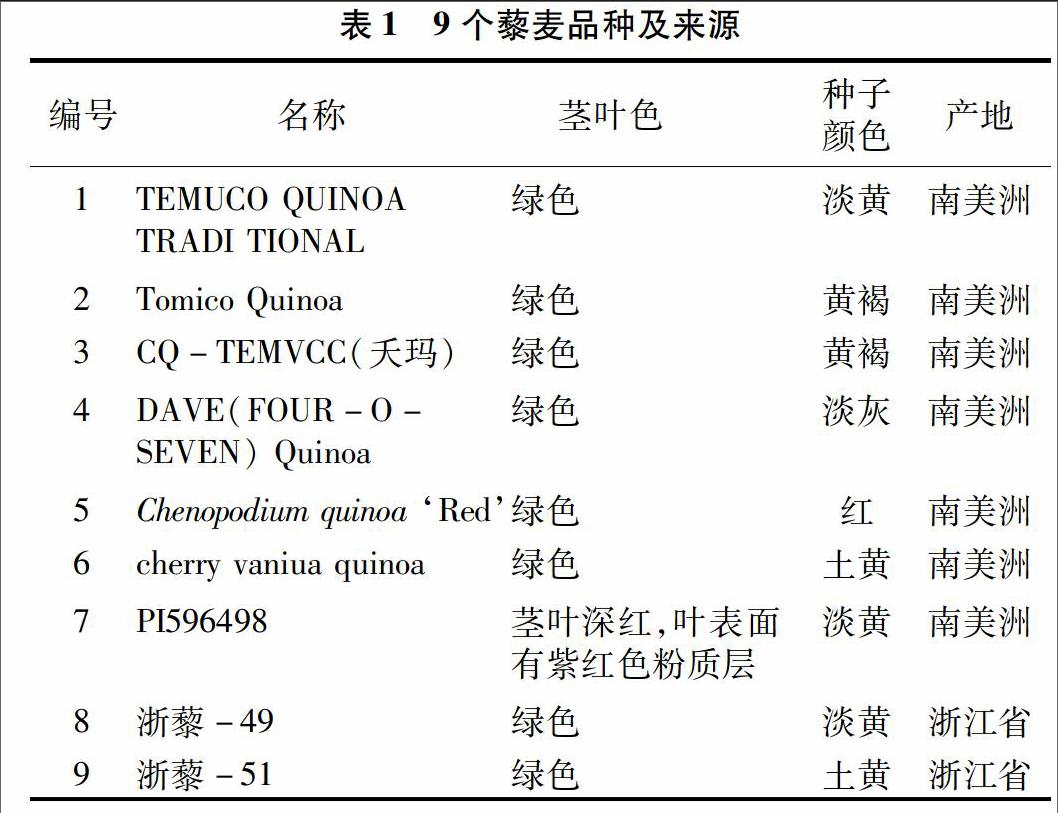
選取大田種植的9個藜麥品種進行試驗,包括TEMUCO QUINOA TRADI TIONAL、CQ-TEMVCC(夭瑪)、Chenopodium quinoa ‘Red、PI596498、Tomico Quinoa、cherry vaniua quinoa、DAVE(FOUR-O-SEVEN) Quinoa、浙藜-49、浙藜-51(表1)。所有品種種子均由浙江農林大學提供。
1.2 藜麥無菌苗的培育
挑選飽滿種子在38 ℃恒溫水浴鍋中加熱3 h,冷卻至室溫,用75%乙醇消毒1 min,用0.2% HgCl2溶液消毒5 min,再用無菌水沖洗4~5次。無菌條件下,將消毒過的種子接種到不含激素的MS培養基中,24 ℃暗培養3~4 d,16 h/8 h 光照周期下培養3 d,獲得無菌苗備用。
1.3 外植體的處理
將無菌苗的莖段剪成長1.0 cm的小段,子葉切成0.5 cm×0.5 cm大小,分別放入培養基MS+0.5 mg/L 2,4-D中進行愈傷組織誘導,重復3次。在24 ℃、16 h/8 h光照周期下培養28 d,統計每個品種不同外植體愈傷組織的誘導率及生長情況。誘導率計算公式如下:誘導率=形成愈傷組織的外植體數/接種外植體數×100%。
1.4 愈傷組織誘導優化試驗
選擇TEMUCO QUINOA TRADI TIONAL、浙藜-51、浙藜-49 等3個品種無菌苗莖段,在無菌條件下切成長約 1.0 cm 的片段,接種到MS基本培養基+不同激素處理的培養基上(表2),每個品種接種3個培養基作為重復。
1.5 愈傷組織增殖優化試驗
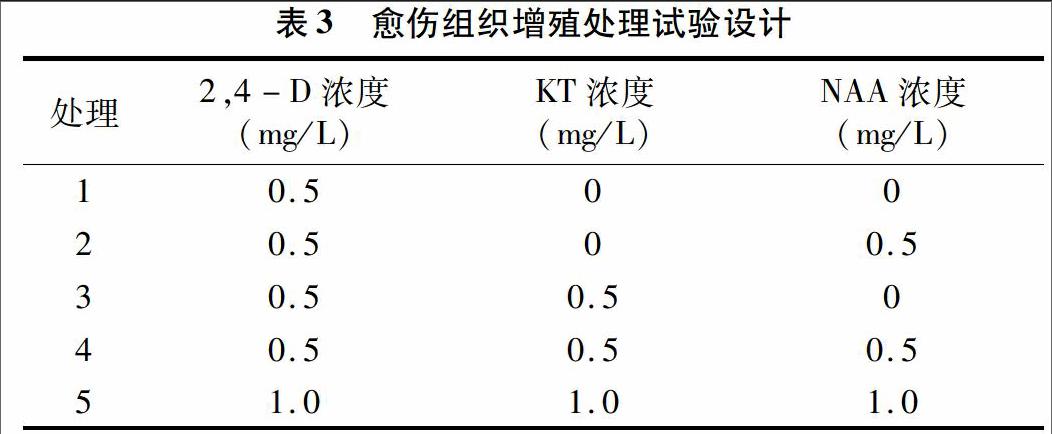
將TEMUCO QUINOA TRADI TIONAL、浙藜-51、浙藜-49這3個品種培養12 d的初代愈傷組織切成0.3 g的小塊(m1),接種到表3中的培養基中進行繼代培養。每處理接種3瓶,每瓶接種4塊愈傷組織,每處理總計12塊。20 d后,取出愈傷組織稱量鮮質量(m2),以愈傷組織增殖率為指標進行最佳培養基篩選(表3)。
1.6 數據分析
運用Excel、SPSS軟件分析數據。
2 結果與分析
2.1 愈傷組織外植體的選擇
將消毒的莖段、子葉接種到培養基上,2 d后外植體切口處變褐,4~5 d后外植體開始膨脹,7 d左右開始有肉眼可見的乳白色、黏稠狀的愈傷組織出現,外植體開裂伸長,28 d時未誘導出愈傷組織的外植體不再產生愈傷組織。不同品種之間愈傷組織的誘導率存在差異,相同品種不同外植體的愈傷組織誘導率也不同。由圖1可以看出,9個藜麥品種的莖段愈傷誘導率均在78%以上,平均誘導率為90%;子葉愈傷組織誘導率僅在58%以上,平均誘導率為80%。cherry vaniua quinoa、Tomico Quinoa、浙藜-51、chenopodium quinoa ‘Red莖段的愈傷組織出愈率明顯高于子葉。TEMUCO QUINOA TRADI TIONAL、CQ-TEMVCC(夭瑪)、chenopodium quinoa ‘Red莖段愈傷組織誘導率達100%。由此可見,藜麥愈傷組織誘導敏感性存在品種差異。雖然用莖段、子葉均能誘導出愈傷組織,但莖段更適合用作誘導愈傷組織的外植體。
2.2 愈傷組織誘導優化分析
在藜麥愈傷組織誘導過程中,激素種類、濃度對愈傷組織誘導起重要作用。由表4可以看出,不同組合處理下同一品種愈傷組織誘導率有很大不同,如TEMUCO QUINOA TRADI TIONAL在處理Ⅱ、Ⅵ中愈傷組織誘導率達100%,而在處理Ⅳ、Ⅷ中低于20%。TEMUCO QUINOA TRADI TIONAL在各種處理下的愈傷組織誘導率均明顯高于浙藜-49、浙藜-51。隨著2,4-D濃度的升高,3個試驗品種的誘導率在一定范圍內均呈下降趨勢。2.0 mg/L 2,4-D處理下浙藜-49、浙藜-51誘導率下降至0。在2,4-D激素基礎上施加不同濃度的KT、NAA,結果發現,不同處理下不同藜麥品種的愈傷組織誘導率變化趨勢同2,4-D單激素處理類似。3個品種在處理Ⅱ、Ⅵ的愈傷組織誘導率均值為89%~90%,但在前者處理下,3個品種得到的愈傷組織狀態均為濕潤、乳白色、疏松的,后者處理下3個不同品種均產生干燥、墨綠色、緊密的愈傷組織(圖2)。因此在愈傷組織誘導優化試驗中,綜合誘導率與出愈狀態,處理Ⅱ為最理想的培養基。
2.3 愈傷組織生長增殖優化結果分析
將愈傷組織接種到不同激素處理的培養基中培養20 d,稱量接種前后的愈傷組織質量,可以獲得不同激素處理對愈傷組織增殖的影響。從表5可以看出,不同品種愈傷組織增殖率存在很大差異,增殖率為52%~268%,愈傷組織的增殖率不僅與培養基激素組分有關,也與品種特性有關。TEMUCO QUINOA TRADI TIONAL的愈傷組織生長較快,不同處理下增殖率較高,均值達158%。浙藜-51的愈傷組織生長相對較慢,不同處理下增殖率均值僅為76%。浙藜-51愈傷組織誘導能力優于浙藜49,增殖能力劣于后者。3個藜麥品種在單激素處理Ⅰ(MS+0.5 mg/L 2,4-D)下平均增殖率為71%,在雙激素處理Ⅱ(MS+0.5 mg/L 2,4-D+0.5 mg/L NAA)以及Ⅲ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT)下平均增殖率均提高;3個藜麥品種在處理Ⅳ、Ⅴ下愈傷組織的增殖效果最明顯,均值分別達161%、134%。TEMUCO QUINOA TRADI TIONAL在處理Ⅳ下愈傷組織增殖率達268.3%,但在處理Ⅴ下增殖率下降到180.8%,可以看出激素濃度的增加對其增殖具有一定抑制作用。因此,相比而言,處理Ⅳ(0.5 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA)較為適宜。
3 結論與討論
開展組織培養研究對于藜麥優良種質資源保存、新品種選育以及遺傳學特征研究等具有十分重要的意義[12]。本試驗中9個藜麥品種均能誘導出愈傷組織,但不同品種對組培條件的敏感性存在一定差異。因此在構建藜麥愈傷組織培養體系時,既要考慮共性問題,又要顧及到各自的基因型特點[13]。藜麥的子葉、莖段均能誘導出愈傷組織,相比而言,后者的誘導效果優于前者,這與安桂花等對高山紅景天[14]、蘆婕等對盾葉薯蕷[15]、莫英等對盾葉薯蕷[16]、張勃等對紫花苜蓿[17]、肖荷霞等對紫花苜蓿[18]的研究結果一致。植物激素是調控植物器官產生愈傷組織及其分化最主要的影響因素[19-20]。2,4-D是組織培養中常用的植物生長調節劑,主要起誘導愈傷組織形成、促進生根等作用,在植物組織培養中廣泛使用[21]。本研究表明,3個藜麥品種在0.5 mg/L 2,4-D處理下,愈傷組織誘導率最高,隨著2,4-D濃度的增加,愈傷組織誘導率呈下降趨勢。邢小明等研究發現,2,4-D濃度在0.10~1.00 mg/L時,波葉紅果樹葉片愈傷組織誘導率隨著激素濃度升高而升高,2,4-D濃度過高對愈傷組織誘導產生明顯的抑制作用[22]。代亮等研究發現,3 mg/L 2,4-D處理下,12個草地早熟禾品種愈傷組織誘導率均值達86%[23]。許明子等在NB培養基上添加2 mg/L 2,4-D,發現水稻愈傷組織誘導率達80%以上[24]。由此可以看出,不同濃度2,4-D對愈傷組織誘導率影響很大。朱祝英等研究發現,MS+2,4-D培養基處理下,香蕉葉片誘導率高達100%,加入其他生長素或細胞分裂素如NAA、KT、6-BA等香蕉葉片誘導率均有所降低[25]。本研究結果表明,處理Ⅵ(MS+05 mg/L 2,4-D+0.5 mg/L KT+0.5mg/LNAA)和處理Ⅱ(MS+0.5 mg/L 2,4-D)對藜麥愈傷組織的誘導率相近,但是愈傷形態差別較大,后者誘導形成疏松、有光澤、黃白色愈傷組織,因此MS+0.5 mg/L 2,4-D培養基是最佳的愈傷組織誘導培養基。這與前人研究結果[26-27]不一致,可能是由于不同植物愈傷組織形成所需要的激素種類不同。組培體系中,愈傷組織增殖速度關系到組培體系效率,在轉基因研究中尤其如此[23]。孫瑞明等研究發現,在增殖階段,香竹愈傷組織對 2,4-D的依賴程度沒有誘導階段強,但仍須維持一定濃度,低濃度KT、NAA對香竹愈傷的增殖有良好的效果[28]。高麗麗等研究表明,秈稻愈傷組織的增殖不僅與愈傷組織的生長狀態以及培養基組分有關,還與品種特性有關[29]。本研究結果表明,處理Ⅳ(MS+0.5 mg/L 2,4-D+0.5 mg/L KT+0.5 mg/L NAA)下,3個藜麥品種愈傷組織增殖率達90.8%~268.3%,TEMUCO QUINOA TRADI TIONAL的愈傷組織增殖率明顯高于浙藜51、浙藜49。
參考文獻:
[1]朱劍宏. 南美藜的化學組成和營養價值[J]. 成都大學學報:自然科學版,2002,21(2):24-28.
[2]Vega-Gálvez A,Miranda M,Vergara J,et al. Nutrition facts and functional potential of quinoa (Chenopodium quinoa Willd.),an ancient Andean grain:a review[J]. Journal of the Science of Food and Agriculture,2010,90(15):2541-2547.
[3]Oshodi A A,Ogungbenle H N,Oladimeji M O. Chemical composition,nutritionally valuable minerals and functional properties of benniseed (Sesamun radiatum),pearl millet (Pennisetum typhoides) and quinoa (Chenopodium quinoa) flours[J]. International Journal of Food Sciences & Nutrition,1999,50:325-331.
[4]Comai S,Bertazzo A,Bailoni L,et al. The content of proteic and nonproteic (free and protein-bound) tryptophan in quinoa and cereal flours[J]. Food Chemistry,2007,100(4):1350-1355.
[5]Jacobsen S E,Mujica A,Jensen C R. The resistance of quinoa (Chenopodium quinoa Willd.) to adverse abiotic factors[J]. Food Reviews International,2003,19(1/2):99-109.
[6]貢布扎西,旺 姆,張崇璽,等. 南美藜在西藏的生物學特性表現[J]. 西南農業學報,1994,7(3):54-62.
[7]Meneguetti Q A,Brenzan M A,Batista M R,et al. Biological effects of hydrolyzed quinoa extract from seeds of Chenopodium quinoa Willd.[J]. Journal of Medicinal Food,2011,14(6):653-657.
[8]Abugoch J L. Quinoa (Chenopodium quinoa Willd.):composition,chemistry,nutritional,and functional properties[J]. Advances in Food and Nutrition Research,2009,58:1-31.
[9]Ogungbenle H N. Nutritional evaluation and functional properties of quinoa (Chenopodium quinoa) flour[J]. International Journal of Food Sciences and Nutrition,2003,54:153-158.
[10]Ruiz-Carrasco K,Antognoni F,Coulibaly A K,et al. Variation in salinity tolerance of four lowland genotypes of quinoa(Chenopodium quinoa Willd.)as assessed by growth,physiological traits,and sodium transporter gene expression[J]. Plant Physiology and Biochemistry,2011,49(11):1333-1341.
[11]Hariadi Y,Marandon K,Tian Y,et al. Ionic and osmotic relations in quinoa (Chenopodium quinoa Willd.) plants grown at various salinity levels[J]. Journal of Experimental Botany,2011,62(1):185-193.
[12]Jacobsen S E. The worldwide potential for quinoa (Chenopodium quinoa Willd.) potential[J]. Food Rev Int,2003,19:167-177.
[13]Laurain D,Trémouillaux-Guiller J,Chénieux J C. Embryogenesis from microspores of Ginkgo biloba L.,a medicinal woody species[J]. Plant Cell Reports,1993,12(9):501-505.[HJ1.7mm]
[14]安桂花,許明子,李美善,等. 植物激素對高山紅景天試管苗愈傷組織誘導的影響[J]. 延邊大學農學學報,2007,29(3):153-156.
[15]蘆 婕,張曉麗,劉 雯,等. 外植體和植物生長調節劑對盾葉薯蕷愈傷組織誘導的影響[J]. 湖北農業科學,2013,52(15):3693-3696.
[16]莫 英,蘭利瓊,卿人韋,等. 盾葉薯蕷種子萌發條件及誘導外植體愈傷的研究[J]. 四川大學學報:自然科學版,2004,41(4):837-841.
[17]張 勃,秦 彧,王黎明,等. 紫花苜蓿品種“德寶”不同外植體愈傷組織誘導研究[J]. 甘肅農業大學學報,2012,47(4):100-104.
[18]肖荷霞,王 瑛,高 峰,等. 外植體及激素對SANDITI紫花苜蓿愈傷組織誘導和分化的影響[J]. 河北農業大學學報,2003,26(4):47-52.
[19]王麗艷,荊瑞勇,郭永霞,等. 大豆愈傷組織繼代培養中激素濃度組合的優化[J]. 中國油料作物學報,2013,35(4):446-450.
[20]王玉英,高新一. 植物組織培養技術手冊[M]. 北京:金盾出版社,2006.
[21]陳 豫,胡 偉,何 磊. 不同濃度激素對胡蘿卜愈傷組織誘導的影響[J]. 江蘇農業科學,2013,41(2):54-56.
[22]邢小明,林夏珍,王旭艷,等. 波葉紅果樹葉片愈傷組織誘導研究[J]. 北方園藝,2013(12):108-110.
[23]代 亮,柳玉霞,劉 潔,等. 12個草地早熟禾品種愈傷組織誘導體系的研究[J]. 云南大學學報:自然科學版,2012,34(6):722-730.
[24]許明子,具紅光,劉憲虎,等. 水稻愈傷組織生長量和植株再分化率的品種間差異[J]. 吉林農業科學,2000,25(2):29-32,49.
[25]朱祝英,鄭錦玲,楊玉梅,等. 植物生長調節劑對離體香蕉葉片愈傷組織誘導的影響[J]. 廣東農業科學,2013,40(11):29-32.
[26]周金梅,宮敬利,陳 磊,等. 合作918番茄愈傷組織誘導技術研究[J]. 吉林農業科學,2013,38(2):78-80.
[27]張朝軍,范術麗,武芝霞,等. 棉花大田植株葉柄組織培養體系的建立[J]. 西北植物學報,2011,31(6):1257-1263.
[28]孫瑞明,王 娟,陳 芳,等. 香竹愈傷組織誘導研究[J]. 福建林學院學報,2013,33(1):48-51.
[29]高麗麗,陳遠玲,簡玉瑜. 提高秈稻愈傷組織誘導率和增殖率的研究[J]. 廣東農業科學,2005(4):28-30.

