蔗糖在DMF-[BMIm]Cl 溶劑中催化制備5-HMF
韓迎新,楊忠連,陳明強,張曄,劉少敏
(1 安徽理工大學化學工程學院,安徽 淮南 232001;2 安徽理工大學地球與環(huán)境學院,安徽 淮南 232001)
化石資源的日趨緊張和由此引發(fā)的環(huán)境污染問題日益加重,開發(fā)新型可再生能源已變得迫在眉睫。生物質(zhì)作為一種分布廣泛、污染量低的可再生能源在近年受到了研究者的廣泛關注[1-2]。作為生物質(zhì)的主要組成部分,單糖、二糖、低聚糖以及多糖等糖類可以通過水解制備很多高附加值的化工原料,其中以果糖、葡萄糖在酸性條件下生成的5-羥甲基糠醛(5-HMF)由于分子性質(zhì)較為活潑,被視為一種用途廣泛、市場價值高的平臺化合物[3]。
水解生成的 5-HMF 容易繼續(xù)降解為乙酰丙酸等小分子且會發(fā)生聚合反應生成難溶的腐黑物 等[4],導致六碳糖脫水生成 5-HMF 的成本較高,收率較低,影響了其工業(yè)化生產(chǎn)的實現(xiàn)。傳統(tǒng)工藝中水作溶劑會導致5-HMF 的降解反應劇烈,產(chǎn)物不能穩(wěn)定存在于水解液中[5-6]。通過改進水-有機溶劑兩相溶劑可以有效解決此問題,但是5-HMF 收率不高[7]。而近年來采用離子液體作為新型綠色溶劑生產(chǎn)5-HMF 的研究也越來越多[8-9],由于離子液體黏度一般比較大且價格昂貴,不利于工業(yè)化生產(chǎn)的需求。
本工作研究改進的N,N-二甲基甲酰胺(DMF)- 離子液體[BMIm]Cl 為混合溶劑,利用葡萄糖的反應選取最優(yōu)的催化劑。在此基礎上研究蔗糖生成5-羥甲基糠醛的最優(yōu)工藝條件。
1 實驗部分
1.1 試劑與儀器
葡萄糖,天津博邊化工股份有限公司;蔗糖,國藥集團化學試劑有限公司;六水合氯化鋁,阿拉丁公司;N,N-二甲基甲酰胺,成都市吉順化工貿(mào)易有限公司;[BMIm]Cl(氯化一丁基三甲基咪唑),上海成捷化學有限公司;六水合三氯化鉻,天津市光復精細化工研究所;三氯化鐵,江陰泰爾環(huán)保科技有限公司;六水合氯化鈷,天津博邊化工股份有限公司;氯化鋅,阿拉丁公司;五水合氯化錫,阿拉丁公司;二水合氯化銅,無錫市展望化學試劑有限公司;氯化鈣,宿州化學試劑廠。所有試劑均為分析純。
UV-2550 型紫外-可見分光光度計,日本島津制作所;KH-25 型水熱合成反應釜,東臺市中凱亞不銹鋼制品廠;HH-S4 型油浴鍋,金壇市白塔金昌實驗儀器廠。
1.2 實驗步驟
將葡萄糖或蔗糖、混合溶劑([BMIm]Cl+DMF)和催化劑依次加入反應釜聚四氟乙烯內(nèi)襯中,然后將磁力攪拌子置入反應釜后密封,放入具有磁力攪拌功能并已設定好溫度的油浴中,反應到設定時間,將反應釜置于冰水中冷卻30min 以快速結束反應,之后轉(zhuǎn)移反應液至試樣瓶中用于定量分析。
1.3 分析方法
1.3.1 5-HMF 標準曲線的繪制
配制10 組濃度在0.01~0.20mmol/L 已知濃度的5-HMF 水溶液,用去離子水作為空白對照,將已知濃度的5-HMF 溶液置于石英比色皿中在波長為200~350nm 范圍內(nèi)進行紫外光譜測定,根據(jù)得到的圖1(a)所示的紫外圖譜,確定最大吸收波長為284nm,與文獻報道一致。284nm 處吸光度作縱坐標,5-HMF 濃度作橫坐標繪制標準曲線,得到擬合方程y=15.5072x+0.0432,R2=0.9996,線性關系良好,如圖1(b)所示。
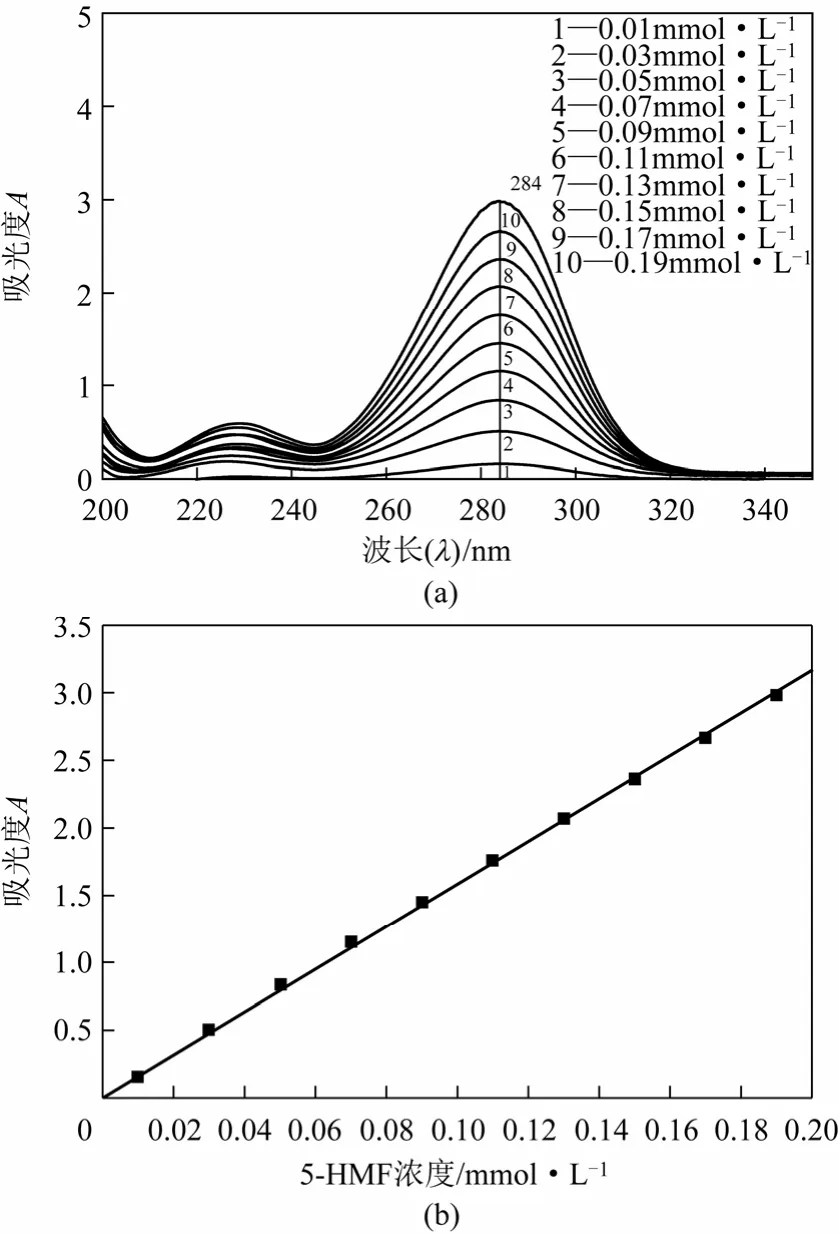
圖1 5-HMF 標準溶液紫外吸收光譜和摩爾濃度標準曲線
1.3.2 水解液中5-HMF 收率的測定
直接取適量反應液稀釋后進行紫外光譜測定。根據(jù)標準曲線計算得到5-HMF 的濃度,根據(jù)式(1)計算水解液中5-HMF 的收率。

式中,V 是反應液稀釋后的體積,L;x 是根據(jù)擬合標準曲線計算得到的稀釋后溶液的濃度, mmol/L;m 是蔗糖的質(zhì)量,g;M 是蔗糖的摩爾質(zhì)量,314g/mol。
2 結果與討論
2.1 催化劑種類對葡萄糖轉(zhuǎn)化為5-HMF 的影響
蔗糖在酸性環(huán)境中較容易發(fā)生水解,生成果糖和葡萄糖。因此在5-HMF 制備反應中,對葡萄糖的催化效果可以直接用于對蔗糖催化效果的評估。但由于在酸性條件下,葡萄糖制取5-HMF 的反應遵循環(huán)狀脫水反應歷程:首先會發(fā)生異構化反應,生成烯醇式中間體,再異構為果糖,進而發(fā)生環(huán)化和脫水反應,最終生成5-HMF。因而決定5-HMF 收率的關鍵步驟是葡萄糖異構化為果糖的步驟[10]。
所以反應首先以0.36g 葡萄糖(1mmol)為模型反應物,以5g DMF 為溶劑,研究0.1mmol 不同催化劑對5-HMF 收率的影響。在120℃下反應2.0h,結果如圖2。
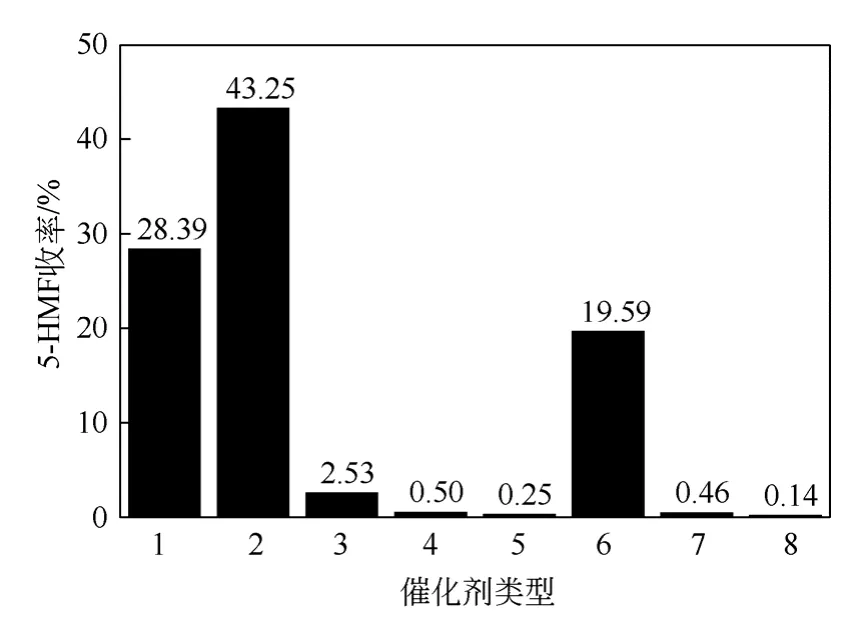
圖2 8 種金屬氯化物催化葡萄糖轉(zhuǎn)化反應
實驗研究了8 種催化劑對葡萄糖脫水生成5-HMF 收率的影響。結果表明,催化效果依次為AlCl3·6H2O>CrCl3·6H2O>SnCl4·5H2O>FeCl3,且CrCl3·6H2O、AlCl3·6H2O 、SnCl4·5H2O 對葡萄糖的 催化效果較好,其中AlCl3·6H2O 的催化效果最為明顯,5-HMF 收率高達43.2%。結果與Pagán-Torres等[11]的研究結果一致,他們同樣報道稱AlCl3在葡萄糖脫水生成5-HMF 的反應中表現(xiàn)出了很高的催化效果。主要原因是AlCl3可以有效地促進葡萄糖異構化為果糖,進而催化果糖脫水生成5-HMF。而CoCl2·6H2O、ZnCl2、CuCl2·2H2O、CaCl2對5-HMF的生成催化效果較差,均不高于1.0%。顯然當以DMF 為溶劑時,5-HMF 收率與金屬氯鹽Lewis 酸性沒有明顯關聯(lián)。使用AlCl3·6H2O 可獲得最高的5-HMF 收率,因而后續(xù)實驗都選用AlCl3·6H2O 為催化劑進行研究。
2.2 時間和溫度對蔗糖轉(zhuǎn)化為5-羥甲基糠醛的 影響
以0.4mmol AlCl3·6H2O 作催化劑,5g 質(zhì)量比為85∶15 的DMF-[BMIm]Cl 混合溶劑和 0.17g 蔗糖(0.5mmol)為反應物研究時間和溫度對5-HMF 收率的影響,如圖3 所示。
根據(jù)圖3 中數(shù)據(jù)進行方差分析得表1,F(xiàn)溫度> F0.01(2,10)=7.56,P溫度-value<0.01,因此溫度對5-HMF 收率的影響比較顯著;同理F時間>F0.01(5,10)=5.64,P時間-value<0.01,時間對5-HMF 收率的影響也比較顯著。同時,F(xiàn)溫度>F時間,相比時間溫度對5-HMF 收率影響更大。
圖3中不同溫度條件下時間對5-HMF收率的擬合曲線方程如式(2)所示。
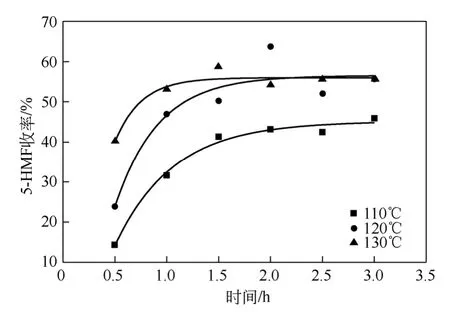
圖3 溫度和時間對蔗糖水解反應的影響
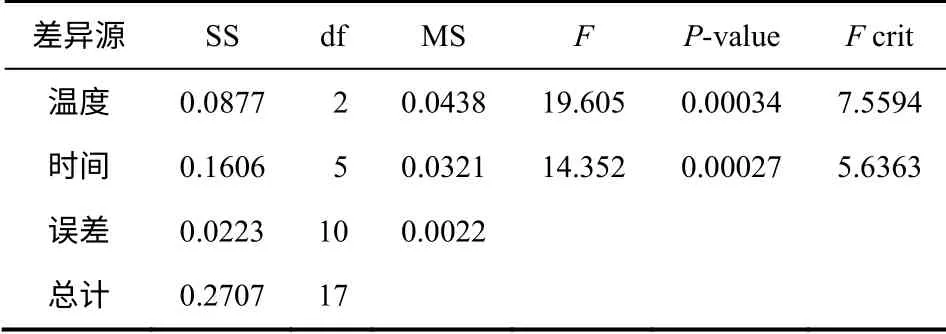
表1 雙因素無重復實驗方差分析結果
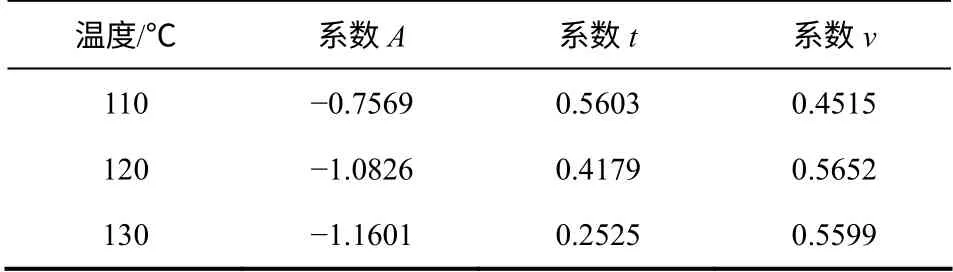
表2 擬合曲線系數(shù)值

其中,不同溫度下A、t、v 的值如表2 所示。
由圖3 和表2 可知,不同溫度下5-HMF 收率從0.5~3.0h 均隨時間呈先快速增加,到1.5h 后增速緩慢減小,最后趨于定值的現(xiàn)象。110℃時收率趨于43.0%,而在120℃、130℃時則收率最終均趨于55.3%,可判斷為該實驗條件下反應的最高收率。實驗發(fā)現(xiàn),在2h 以后延長反應時間對5-HMF 收率沒有顯著大幅度改變,所以選用2h 為最佳反應時間。
在不同時間條件下,5-HMF 收率總體上隨溫度的升高而增加,而在反應時間為2.0h 時,120℃條件下得到了最高的5-HMF 收率,高達63.4%,繼續(xù)升高到130℃時收率反而出現(xiàn)減小趨勢。2.0h 條件下,低于120℃時主反應速率大于副反應的速率,5-HMF 收率平穩(wěn)上升,而高于120℃以后,由于5-HMF 的濃度不斷增加,導致副反應速率不斷增大,副反應速率大于主反應速率,所以5-HMF 的降解或聚合等副反應大于它的水解生成速率,升高溫度會導致5-HMF 收率降低。因而選用120℃為后續(xù)實驗的反應溫度。
2.3 DMF 與[BMIm]Cl 質(zhì)量比對蔗糖轉(zhuǎn)化為5-羥甲基糠醛的影響
以0.4mmol AlCl3·6H2O 作催化劑,5g 質(zhì)量比不同的 DMF-[BMIm]Cl 混合溶劑和 0.17g 蔗糖(0.5mmol)為反應物在120℃下反應2.0h,以研究DMF 與[BMIm]Cl 質(zhì)量比對5-HMF 收率的影響,如圖4。
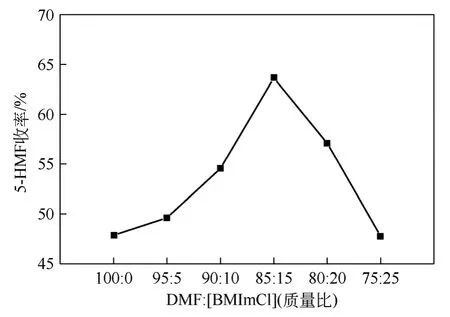
圖4 DMF 與[BMIm]Cl 質(zhì)量比對蔗糖水解反應的影響
實驗結果表明,DMF 中添加適量的[BMIm]Cl有利于反應的進行,其原因有二:一是[BMIm]Cl有很強的極性,可以促進蔗糖在此混合溶劑中的溶解來達到提高5-HMF 產(chǎn)率的目的;二是咪唑型離子液體通過氫鍵作用對反應物起到活化的作用,并且對每步反應的中間產(chǎn)物起穩(wěn)定作用[12]。隨著DMF與[BMIm]Cl 質(zhì)量比的減小,5-HMF 收率呈先增加、后減小的趨勢,收率最高時質(zhì)量比為 DMF∶[BMIm]Cl= 85∶15。目前大部分實驗研究糖類在純離子液體中的反應,但由于離子液體黏度一般比較大,且價格昂貴,不利于工業(yè)化生產(chǎn)的需求;而通過使用此混合溶液,降低了反應溶劑黏度,有利于反應的傳質(zhì)、傳熱及后續(xù)分離處理和循環(huán)利用,對實現(xiàn)工業(yè)化生產(chǎn)具有重要意義。根據(jù)Xiao 等[3]的研究表明,此反應體系可以通過減壓蒸餾、離心、萃取及真空干燥等一系列分離處理得到含有AlCl3的[BMIm]Cl,得到的混合物可以直接用于第二次反應,結果表明[BMIm]Cl 可循環(huán)使用5 次且5-HMF收率沒有大幅度減小。而當質(zhì)量比低于85∶15 時,5-HMF 收率有一定程度的下降,可能是因為離子液體[BMIm]Cl 易吸水,抑制了糖脫水反應的進行,增大了副反應的發(fā)生概率。所以選擇最佳DMF-[BMIm]Cl 質(zhì)量比為85∶15。
由于DMF 的大量存在以及反應條件的限制,[BMIm]Cl 與AlCl3在該反應中較難形成穩(wěn)定的離子液體結構,并且[BMIm]Cl-AlCl3離子液體很不穩(wěn)定,遇水極易分解變質(zhì)[13],因此實驗中反應體系可以不考慮[BMIm]Cl-AlCl3離子液體的生成帶來的影響。
2.4 催化劑用量對蔗糖轉(zhuǎn)化為5-羥甲基糠醛的 影響
以不同摩爾量的 AlCl3·6H2O 作催化劑,5g 質(zhì)量比85∶15 的DMF-[BMIm]Cl 混合溶劑,0.17g 蔗糖(0.5mmol)為反應物120℃下反應2.0h,研究催化劑用量對5-HMF 收率的影響,實驗結果如圖5。
由圖5 可知,在沒有加入AlCl3·6H2O 的空白對照實驗中,5-HMF 的收率幾乎為0,所以在此反應中[BMIm]Cl 并沒有起到明顯催化作用。加入小于0.2mmol AlCl3·6H2O 時5-HMF 收率略有提高,但由于加入量較小,提供的酸性不能達到反應的要求,5-HMF 收率不到10%。繼續(xù)增大催化劑的加入量,隨著催化劑所提供酸性的增強,蔗糖水解和進一步的單糖脫水反應獲得有效促進,所以加入0.4mmol催化劑時催化作用已相當明顯,5-HMF 收率達最高63.4%,且從0.2mmol 起5-HMF 收率呈直線升高趨勢。而隨著AlCl3·6H2O 加入量大于0.4mmol 后,5-HMF 收率出現(xiàn)下降趨勢,可能是因為Al3+所產(chǎn)生的活性已達到最大,繼續(xù)增加催化劑將有可能導致5-HMF 的降解或聚合等副反應發(fā)生,所以選擇0.4mmol 為催化劑的最佳催化劑用量。
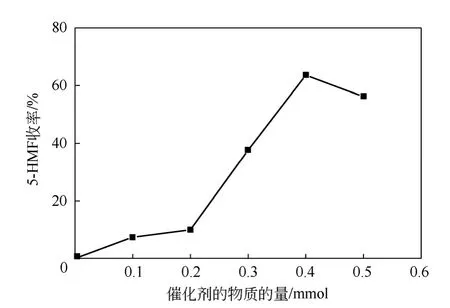
圖5 催化劑量對蔗糖水解反應的影響
2.5 蔗糖起始用量對蔗糖轉(zhuǎn)化為5-羥甲基糠醛的影響
以0.4mmol 的 AlCl3·6H2O 作催化劑,5g 質(zhì)量比85∶15 的DMF-[BMIm]Cl 混合溶劑和不同物質(zhì)的量的蔗糖為反應物在120℃下反應2.0h,以研究蔗糖起始濃度對5-HMF 收率的影響,如圖6 所示。

圖6 蔗糖初始添加量對水解反應的影響
由圖6 可知,當蔗糖用量為0.5mmol 時收率最大為63.4%,增加蔗糖濃度會使5-HMF 收率快速下降。可能是因為蔗糖濃度過高會使糖與H+的接觸機會減小,另外產(chǎn)物濃度過高也會抑制反應的進行,過高的糖濃度還會使糖分子間發(fā)生交聯(lián)聚合反應導致腐黑物的生成,對反應不利。所以增大反應物濃度不能增大5-HMF 的收率,選擇0.5mmol 的蔗糖用量最佳。
3 結 論
采用質(zhì)量比為85∶15 的DMF-[BMIm]Cl 混合溶劑研究蔗糖脫水生成5-HMF 的最優(yōu)工藝條件。用模型化合物葡萄糖探究六碳糖脫水生成5-HMF 的最優(yōu)催化劑,選用的8 種氯化物對反應均有催化效果,其中以AlCl3·6H2O 效果最好。實驗得到的最佳工藝條件為:0.5mmol 蔗糖為反應物,0.4mmol AlCl3·6H2O 為催化劑,反應時間2h,反應溫度120℃,5g 質(zhì)量比為85∶15 的DMF-[BMIm]Cl 混合溶劑,此條件下5-HMF 收率最高為63.4%。
[1] Berndes G,Hoogwijk M,van den Broek R. The contribution of biomass in the future global energy supply:A review of 17 studies[J]. Biomass and Bioenergy,2003,25(1):1-28.
[2] Rofiqul Islam M,Rabiul Islam M,Rafiqul Alam Beg M. Renewable energy resources and technologies practice in Bangladesh[J] . Renewable and Sustainable Energy Reviews ,2008 , 12(2) : 299-343.
[3] Xiao S,Liu B,Wang Y,et al. Efficient conversion of cellulose into biofuel precursor 5-hydroxymethylfurfural in dimethyl sulfoxide-ionic liquid mixtures[J]. Bioresource Technology,2014,151:361-366.
[4] Binder J B,Raines R T. Simple chemical transformation of lignocellulosic biomass into furans for fuels and chemicals[J]. Journal of the American Chemical Society,2009,131(5):1979-1985.
[5] 王軍,張春鵬,歐陽平凱. 5-羥甲基糠醛制備及應用的研究進展[J]. 化工進展,2008,27(5):702-707.
[6] Ogasawara Y, Itagaki S,Yamaguchi K,et al. Saccharification of natural lignocellulose biomass and polysaccharides by highly negatively charged heteropolyacids in concentrated aqueous solution[J]. Chem. Sus. Chem.,2011,4(4):519-525.
[7] Moreau C,Durand R,Aliès F,et al. Hydrolysis of sucrose in the presence of H-form zeolites[J]. Industrial Crops and Products,2000,11(2):237-242.
[8] Zhao H,Holladay J E,Brown H,et al. Metal chlorides in ionic liquid solvents convert sugars to 5-hydroxymethylfur-fural[J]. Science, 2007,316(5831):1597-1600.
[9] Hu S,Zhang Z,Song J,et al. Efficient conversion of glucose into 5-hydroxymethylfurfural catalyzed by a common Lewis acid SnCl4in an ionic liquid[J]. Green Chemistry,2009,11(11):1746-1749.
[10] Román-Leshkov Y,Moliner M,Labinger J A,et al. Mechanism of glucose isomerization using a solid Lewis acid catalyst in water[J]. An-gewandte Chemie International Edition,2010,49(47):8954- 8957.
[11] Pagán-Torres Y J,Wang T,Gallo J M R,et al. Production of 5-hydroxymethylfurfural from glucose using a combination of Lewis and Br?nsted acid catalysts in water in a biphasic reactor with an alkylphenol solvent[J]. ACS Catalysis,2012,2(6):930-934.
[12] Lai L,Zhang Y. The effect of imidazolium ionic liquid on the dehydration of fructose to 5-hydroxymethylfurfural,and a room tempera-ture catalytic system[J]. Chem. Sus. Chem.,2010,3(11):1257-1259.
[13] 鄧友全. 離子液體——性質(zhì),制備與應用[M]. 北京:中國石化出版社,2006.

