氨氮與2-氨基吡啶在三維電催化氧化降解中的競爭
李明,潘珍,梁雪梅,趙艷嬌,邱野,孟勇,,尹篤林
(1湖南師范大學資源循環綜合技術研究中心,湖南 長沙 410081;2石化新材料與資源精細利用國家地方聯合工程實驗室,湖南 長沙 410081)
氨氮是水體富營養化的主要原因之一,且對水生動物甚至人類都存在一定的危害。當前,氨氮廢水一般采用吹脫回收[1]、生物硝化-反硝化處理[2]、折點加氯[3]、沉淀法[4]等方法處理,但都存在一些難以克服的缺陷,且實際廢水大都成分復雜,單一底物廢水十分少見,特別是對于高濃度難降解有機/氨氮廢水,成為水處理研究的難點。
三維電催化是一種處理廢水的高級氧化技術,其原理包括主電極和粒子電極的直接氧化和先產生強氧化活性物質再氧化污染底物的間接氧化,能使有機物轉化為小分子可生化物質或完全降解為CO2和H2O,使氨氮氧化為氮氣或硝酸根,具有適用范圍廣、操作簡便、易于自動化控制和無二次污染等優點,是一種應用前景廣闊的廢水處理方法[5-6]。
近年來,電催化處理廢水逐漸引起人們的重 視[7-8]。但當前的研究一方面局限于單一底物的模擬廢水,未考慮實際廢水的復雜性;另一方面直接研究實際工業廢水,對各類底物降級過程及相互間的競爭難以有清晰的認識。針對以上問題,本文作者利用自制三維電催化反應器,研究了三維電催化下氨氮、氨氮與2-氨基吡啶模擬廢水的直接氧化和間接氧化降解,并對氨氮與2-氨基吡啶的競爭反應進行了分析,為難降解有機/氨氮廢水處理提供一定的理論基礎。
1 實驗部分
1.1 實驗儀器與試劑
SJJ-16B型高溫井式爐,洛陽神佳窯業有限公司;DDS-11A型數顯電導率儀,上海天達儀器有限公司;UV-2000型紫外可見分光光度計,北京萊伯泰科儀器有限公司;WMX-Ⅲ-A型微波閉式消解儀,韶關市廣智科技設備有限公司;自制電催化氧化裝置。
2-氨基吡啶,分析純,國藥集團化學試劑有限公司;硫酸銨,分析純,天津市大茂化學試劑廠;氯化鈉,分析純,天津市大茂化學試劑廠;陶土,取自某陶瓷加工廠。
1.2 多孔陶瓷粒子電極的制備
采用固相焙燒法制備CuO-ZnO/多孔陶瓷粒子電極,首先取350g陶土,加入35g水玻璃,然后分別加入0.25mol和0.1mol/kg陶土的氧化銅和氧化鋅,充分攪拌,制成柱狀粒子,室溫下老化12h, 100℃下干燥4h,最后在1000℃下焙燒2h,即得所制粒子電極。
1.3 實驗及分析方法
以硫酸銨和2-氨基吡啶為底物配制一定濃度的氨氮、氨氮/2-氨基吡啶模擬廢水,氯離子以氯化鈉形式加入,并采用硫酸鈉為支持電解調節模擬廢水電導率,粒子電極使用前先浸泡在模擬廢水中,吸附飽和后填充在極板間,然后加入150mL模擬廢水,調節恒定電壓15V和曝氣流速40L/h,每隔30 min取樣,分析2-氨基吡啶、COD、NH3-N和NO3--N的濃度。
2-氨基吡啶在229 nm波長有最大吸光度,故采用紫外分光光度法分析,COD采用微波閉式消解法,NH3-N、和NO3--N分別采用采用水楊酸分光光度法和麝香草酚分光光度法測定(GB/T 5750.5— 2006)。
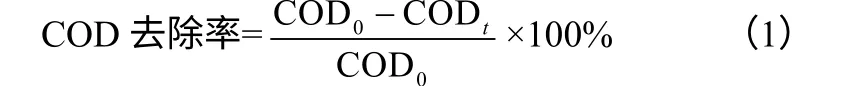

式(1)中, COD0、CODt分別表示模擬廢水初始與t時刻的COD,mg/L;式(2)中,A0、At分別表示2-氨基吡啶在229nm初始與t時刻的吸 光度。
2 結果與討論
2.1 氯離子對氨氮電催化氧化降解的影響
在氨氮初始濃度為100mg/L模擬廢水中,分別加入0、100mg/L、300mg/L、1000mg/L的氯離子進行三維電催化降解,結果如圖1和表1所示。

圖1 氯離子濃度對氨氮降解效率的影響

表1 氨氮降解過程中硝酸鹽氮的積累
由圖1可以看出,氨氮的直接降解十分緩慢,整個反應過程的去除量僅為38.83mg/L,隨著氯離子濃度增加,氨氮的去除率大幅提高,當氯離子為1000mg/L時,30min即可將氨氮幾乎完全去除,大量研究表明氯離子能在三維電催化條件下,產生具 有強氧化性的Cl2、HClO、OCl-,可以提高電催化體系間接氧化效率[9-10],說明三維電催化對氨氮的去除以間接氧化為主,這與Vanlangendonck[11]和Szpyrkowicz[12]等的研究結果相一致。此外,從表1進一步表明,氯離子的加入不僅能顯著提高氨氮的去除率,并且可以降低硝酸鹽氮的累積率[式(3)],達到完全脫氮的目的。

2.2 氨氮與2-氨基吡啶模擬廢水的競爭降解
在2-氨基吡啶為500mg/L模擬廢水中,分別加入0、50mg/L、100mg/L、200mg/L、300mg/L的氨氮進行三維電催化降解,考察氨氮和2-氨基吡啶的競爭降解,結果如圖2~圖4所示。

圖2 氨氮對2-氨基吡啶降解的影響

圖3 氨氮對COD降解的影響

圖4 氨氮含量隨時間的變化
從圖2中可以得知,氨氮對2-氨基吡啶的去除影響不大,雖然去除有所降低,但規律并不明顯,可能是因為2-氨基吡啶富電子的氮雜環結構使其更易被陽極或粒子電極直接氧化降解[13],與受間接氧化影響的氨氮競爭不明顯。從圖3顯示,COD去除率隨著模擬廢水中氨氮濃度增加而降低,由無氨氮情況下的65.93%,降至氨氮初始濃度300mg/L下的45.92%,說明氨氮與2-氨基吡啶開環產物降解競爭強烈。不同初始濃度氨氮降解效率如圖4所示,反應過程中氨氮去除效果較差,甚至出現了氨氮含量升高的現象,可能由于氨氮的直接氧化降解緩慢且氨氮與2-氨基吡啶開環產物存在競爭,另一方面根據本文作者前期研究發現2-氨基吡啶在降解過程中會有部分氮元素轉化為氨氮,在初始濃度為300mg/L的2-氨基吡啶降解過程中最高氨氮含量可達5.38mg/L[14]。
2.3 氯離子對氨氮與2-氨基吡啶模擬廢水競爭降解的影響
在2-氨基吡啶和氨氮分別為500mg/L和100mg/L的模擬廢水中,分別加入0、100mg/L、200mg/L、300mg/L、400mg/L的氯離子進行三維電催化降解,考察氯離子對氨氮和2-氨基吡啶競爭降解的影響,結果如圖5~圖7所示。
圖5、圖6和圖7為氯離子對氨氮與2-氨基吡啶模擬廢水競爭降解的影響。從圖5可知,氯離子加入量在0~400mg/L時,2-氨基吡啶的去除變化不大,說明三維電催化氧化下2-氨基吡啶的降解不受氯離子的影響,進一步證實2-氨基吡啶主要通過直接氧化過程降解。從COD和氨氮降解情況的圖6和圖7可以看出,提高氯離子濃度,COD和氨氮降解效果均有一定程度的增加,但當氯離子從0提高至400mg/L,COD的去除率僅由 50.87%增加到58.07%,而氨氮去除的增幅更為顯著,說明對比 氨氮與2-氨基吡啶開環中間產物,活性氯更傾向于攻擊氨氮,結果與Chiang等[15]的研究一致,間接氧化過程氨氮對有機物有競爭優勢,能優先于有機物降解。

圖5 氯離子對2-氨基吡啶降解的影響

圖6 氯離子對COD降解的影響
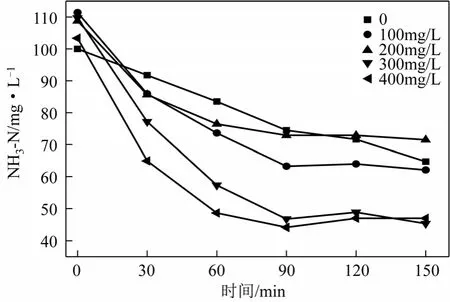
圖7 氯離子對氨氮降解的影響
2.4 氨氮與2-氨基吡啶的競爭分析
圖8為三維電催化氧化下氨氮與2-氨基吡啶競爭過程主要反應步驟。結合降解途徑及研究數據做出如下分析,2-氨基吡啶的降解效率最高且受氨氮和氯離子的影響最小,說明圖8中步驟1是最優先步驟,即三維電催化氧化能更有效去除具有生物毒性的2-氨基吡啶或含有類似大π鍵結構的化合物; 根據氨氮的氧化氧化降解實驗和直接與間接氧化條件下氨氮與2-氨基吡啶的競爭情況可知,通過添加氯離子,可以實現氯離子和活性氯的循環轉化[具體反應過程如式(4)~式(7)所示],并能提高整個三維電催化氧化體系的效率。

圖8 氨氮與2-氨基吡啶競爭反應示意圖

特別對氨氮的降解效率及最終降解產物影響巨大[如式(8)、式(9)],在氯離子存在情況下步驟2和步驟4的競爭關系變弱,氨氮主要通過步驟7被氧化降解。
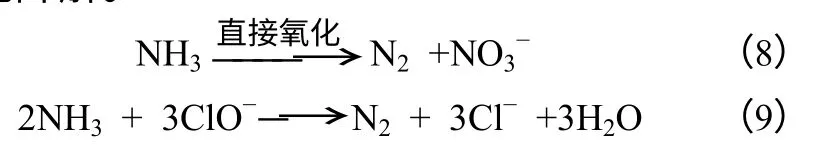
綜上所述,三維電催化氧化能優先去除具有大π鍵結構的化合物,且可以通過調整直接氧化和間接氧化過程,可改變氨氮和開環后有機物的去除率,從而得到不同的出水碳氮比,并為后續處理工藝創造水質條件。目前具有大π鍵結構的化合物及含氨氮有機廢水大量存在于醫藥、農藥、化肥、染料等工業,且大部分廢水是當前研究的難點與熱點,可以利用以上研究結果指導此類實際廢水的處理。
3 結 論
(1)三維電催體系下氨氮直接降解緩慢,加入氯離子不僅可以提高氨氮的降解效率還能降低硝酸鹽氮的累積率。
(2)2-氨基吡啶的開環轉化為直接氧化機理,不受氨氮和氯離子影響。
(3)直接氧化過程2-氨基吡啶開環產物和氨氮競爭強烈,間接氧化過程氨氮和COD的去除率均有提高,但氨氮更顯著,說明間接氧化過程氨氮優先于有機物降解。
(4)可以利用三維電催化直接氧化和間接氧化下氨氮與有機物的競爭關系指導實際有機/氨氮廢水的處理。
[1] 黃海明,肖賢明,晏波. 氨吹脫處理稀土分離廠中氨氮廢水試驗研究[J]. 環境工程學報,2008,2(8):1062-1065.
[2] 張蘭河,王璐瑤,張萬友,等. 進水負荷與硝化液回流比對低污泥濃度A2/O工藝脫氮效果的影響[J]. 化工進展,2012,31(3):693-698.
[3] Pressley T A,Bishop D F,Roan S G. Ammonia-nitrogen removal by breakpoint chlorination[J].Environmental Science & Technology,1972,6(7):622-628.
[4] 陳徉,陳英文,彭慧,等. 磷酸銨鎂沉淀法處理氨氮廢水及沉淀劑的回用[J]. 化工環保,2008,28(1):16-19.
[5] Xiong Y,He C,An T,et al. Removal of formic acid from wastewater using three-phase three-dimensional electrode reactor[J].Water,Air,and Soil Pollution,2003,144(1-4):67-79.
[6] Wei Jinzhi,Feng Yujie,Sun Xiaojun,et al. Effectiveness and pathways of electrochemical degradation of pretilachlor herbicides[J].Journal of Hazardous Materials,2011,189(1):84-91.
[7] 徐紅,蘇靜,項新亮,等. 濾壓式電解槽中氨氮間接電氧化反應動力學[J]. 高等學校化學學報,2008,29(7):1416-1419.
[8] 徐麗麗,施漢昌,陳金鑾. Ti/RuO2-TiO2-IrO2-SnO2電極電解氧化含氨氮廢水[J]. 環境科學,2007,28(9):2009-2013.
[9] Ma Hongzhu,Zhuo Qiongfang,Wang Bo. Electro-catalytic degradation of methylene blue wastewater assisted by Fe2O3- modified kaolin[J].Chemical Engineering Journal,2009,155:248-253.
[10] 胡俊生,謝添,任雪冬,等. 電生成活性氯的影響因素及其在有機廢水處理中的應用[J]. 遼寧化工,2008,37(9):598-601.
[11] Vanlangendonck Y,Corbisier D. Influence of operating conditions on the ammonia electro-oxidation rate in wastewaters from powerplants (ELONITATMtechnique)[J].Water Research,2005,39:3028-3034.
[12] Szpyrkowicz L,Naumczyk J,Ziliograndi F. Electrochemical treatment of tannery wastewater using Ti/Pt and Ti/Pt/Ir electrodes[J].Water Research,1995,29(2):517-524.
[13] 婁紅波,王建中,張萍,等. 電化學法處理苯酚模擬廢水的研究[J]. 環境科學與管理,2008,33(2):72-76.
[14] 李明,梁雪梅,潘珍,等. 多孔陶瓷粒子電極電催化氧化降解2-氨基吡啶[J]. 化工進展,2014,33(1):219-223.
[15] Chiang L C,Chang J E,Wen T C. Indirect oxidation effect in electrochemical oxidation treatment of landfill leachate[J].Water Research,1995,29(2):671-678.

