《化學式計算(第1課時)》教學設計
汪英
一、教學內容分析
1.新授教學內容的知識類型
化學式計算是基于微粒知識和化學基本用語知識的化學計算教學內容。
2.新授教學內容與原有教學內容的聯系
滬教版九年級初中化學教科書第三章《構成物質的奧秘》的教材內容分為三節,化學式計算屬于第3節的最后一部分教學內容。
在這節課前教材呈現了元素、化合物、分子、原子、元素符號、化學式、相對原子質量、相對分子質量等諸多抽象概念。化學式計算則需要對這些知識進行融會貫通、綜合運用、并規范書寫。
3.新授教學內容在后繼教學中的運用與發展
本課時的教學內容是進行化學式變式及拓展計算(元素質量或化合物質量相當計算、與微粒的聯系計算、含雜計算等)的重要基礎。
二、學生起點能力分析
化學式計算第1課時的教學前,學生必須具備以下起點能力:
(1) 知道元素符號的直觀涵義:表示一種元素及這種元素的1個原子。
(2) 知道元素符號隱含的量涵義:可根據元素周期表查得該元素的1個原子的相對原子質量(Ar),從而建立元素符號與Ar之間的聯系。
(3) 知道Ar與原子的真實質量(m)成正比,能反映出原子的真實質量的大小關系。
(4)清楚化學式的直觀涵義:
①表示物質的組成元素;
②表示物質中所含元素的原子個數比。
(5) 會根據化學式和Ar計算相對分子質量(Mr)。
(6)從宏觀到微觀的想象能力,明確宏觀物質是化學式中組成元素原子按比例的無限重復。
由于起點能力的相關知識技能分散在化學式計算教學前的第三章各內容中,為了喚醒學生清晰、準確的記憶,確保起點能力的具備,教學過程中必須首先通過回顧、練習進行梳理歸納。
三、教學目標及教學重點難點
1.教學目標
【知識與技能】
(1)能根據化學式和Ar求得化合物中元素質量比。
(2)能根據化學式和Ar求得化合物中元素質量分數(ω)。
(3)能根據化合物中元素質量分數進行元素質量和化合物質量的換算。
【過程與方法】
(1)初步體會“構建模型”的方法在化學學習中的重要作用。
(2)理解根據化學式中的原子、分子的相對質量比關系可計算宏觀的元素、化合物質量比關系,初步形成對信息進行分析歸納、抽象概括的能力和定量處理的能力。
(3)掌握化學式計算的基本思路和方法,并能用規范的化學語言正確書寫有關計算步驟。
【情感態度與價值觀】
(1)從量的角度深化對化學式的理解,增進對“純凈物有固定的組成”的認識。
(2) 發展勤于思考、嚴謹求實的科學精神。
2.教學重點難點
重點:(1)求化合物中元素質量比;(2)求化合物中元素質量分數。
難點:(1)對化學式中的Ar、Mr間的比等于對應的元素、化合物的真實質量比的理解;(2)相關計算格式的規范書寫。
四、教學過程
1.復習導入
(1)復習(確保學生起點能力水平)
①元素符號的涵義
元素符號一種元素(直接看出)這種元素的1個原子(直接看出)相對原子質量(Ar)(隱含,查得)
如H氫元素1個氫原子Ar(H)=1
O氧元素1個氧原子Ar(O)=16
因為相對原子質量可以表示原子的質量,所以1個氧原子的質量是1個氫原子的質量的16倍。
(2)化學式的涵義
化學式物質的組成元素(直接看化學式中的元素符號)
物質中所含元素的原子個數比(直接看化學式中元素符號的右下角碼)相對分子質量Mr(隱含,算得查一查,乘一乘,加一加)
如:H2O水由氫、氧兩種元素組成1個水分子由2個氫原子和1個原子構成Mr(H2O)=(1×2)+16=18
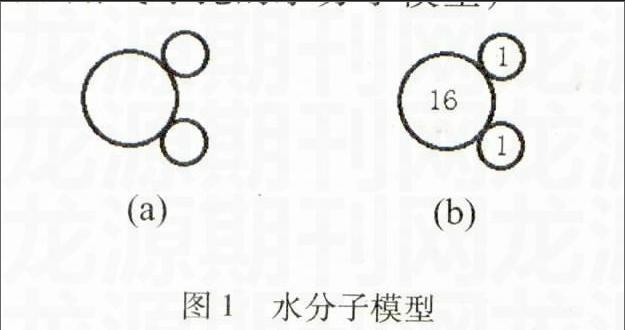
(3)水分子模型
引導學生畫出水分子的模型,如圖1(a)所示。(出示用氣球扎的水分子模型)
圖1水分子模型
2.導入(結合學生的起點能力)
(1)既然元素符號除了有直觀涵義外,還有可表示Ar的隱含的量的涵義。那么用元素符號表示物質組成的化學式,是不是也含有更深層次的量的涵義呢?
(2)根據Ar(H)=1,Ar(O)=16,在剛才所畫的水分子結構模型內填入數字,得到圖1(b)。據此容易算出1個水分子中2個氫原子與1個氧原子的質量比為(1∶8),2個氫原子占1個水分子的質量比為(2/18),1個氧原子占1個水分子的質量比為(16/18)。從而引出這節課要挖掘的內容——從量的角度理解化學式的涵義,進行化學式的基本計算。
2.新知教學
(1)探究一:化合物中元素質量比
例1求水中各元素質量比
【結合水分子模型講解】
從前面的學習中我們已經知道水是由無數個相同的水分子聚集而成,而每1個水分子由2氫原子和1個氧原子構成。
既然每1個水分子都是一樣的,那么我們想知道水(許多水分子的集合體)中氫元素(氫原子的總稱)、氧元素(氧原子的總稱)的質量比關系,完全可以“以偏概全”去研究其中的任一水分子所含的所有氫、氧原子的質量比。
所以,剛才算出的1個水分子中2個氫原子與1個氧原子的質量比1∶8,就已經是水中氫、氧元素的質量比了。當然,解題時需要規范書寫計算格式。
【示范解題】
解根據水的化學式H2O得,
m(H)∶m(O)=Ar(H)×2∶Ar(O)=1×2∶16=1∶8
【模仿練習】計算二氧化碳中各元素的質量比。
【拓展練習】計算尿素[CO(NH2)2]中各元素的質量比
【小結】從量的角度挖掘出了化學式的隱含涵義:根據化學式和相對原子質量可求得化合物中各元素質量比。具體方法為:化學式中各元素原子的相對原子質量(Ar)乘以該原子個數(元素符號的右下角碼n)之比,即Ar×n之比,可概括為:查一查,乘一乘,比一比。
同時,通過計算我們進一步理解了純凈物確實有固定的組成,而化學式則從量的角度反映了這種組成。
(2)探究二:化合物中元素質量分數
例2求水中氫元素的質量分數。
【結合水分子模型講解】
同理,任何一個水分子中所含的所有氫(氧)原子與這一個水分子的質量比可代替氫(氧)元素與水的質量比。
剛才算出的1個水分子中2個氫原子占1個水分子的質量比為2/18,就已隱含著水中氫元素質量分數的計算方法了。
【示范解題】
解w(H)=Ar(H)×2Mr(H2O)×100%=1×218/100%=11.1%
【模仿練習】計算二氧化碳中氧元素的質量分數
【拓展練習】計算CO(NH2)2中氮元素的質量分數
【小結】從量的角度再一次挖掘出化學式的隱含涵義:根據化學式和相對原子質量可求得化合物中元素R的質量分數。從中又體會到純凈物有固定的組成。
R元素的質量分數=R的相對原子質量×化學式中R的原子個數R所處的化合物的相對分子質量×100%
即w(R)=Ar(R)×nMr(R所處的化合物)×100%
(注意:w的值應為百分數或小數,不可為任意分數)
(3)探究三:元素質量和化合物質量的換算
例318 g水中含有多少克氫元素?
同學們根據水分子的模型和圖內填的Ar的數據,很快就能推測出18 g水中含有2 g氫元素。
【分析講解】
同學們從數學學習中已掌握根據部分占整體的質量分數進行整體和部分的轉換方法。這道題中已知水的質量(整體),求氫元素的質量(部分),必須知道水中氫的質量分數,而這個質量分數正是化學式已隱含提供的信息。
【示范解題】解18g×Ar(H)×2Mr(H2O)×100%=18g×218=2g
【模仿練習】多少克水中含有1g氫元素?
【拓展練習】①60 g尿素中含有多少克氮元素?
②多少克尿素中含有14 g氮元素?
【小結】元素質量(部分)和化合物質量(整體)的換算方法是:利用化合物中元素質量分數(w)進行,這種解法的關鍵是必須會從化學式中挖掘出相關的元素質量分數。
其換算關系如下:
m(化合物) ×w(元素) ÷w(元素) m(元素)
3.課堂總結
(1)化學式的涵義可概括為2看3算:
化學式
物質的組成元素 (看)
物質中所含元素的原子個數比(看)
相對分子質量Mr (算)
化合物中各元素的質量比 (算)
化合物中某元素的質量分數w(算)
(2)還可以利用化合物中元素質量分數(w)進行元素質量和化合物質量的換算。
4.鞏固練習
長期攝入過多的食鹽(NaCl)對人體健康不利,它會導致高血壓、骨質疏松等。低鈉鹽適合患有高血壓、腎病、心臟病的患者服用,蘋果酸鈉鹽(C4H5O5Na)是低鈉鹽的一種。請回答:
(1)蘋果酸鈉鹽含有 種元素;
(2)蘋果酸鈉鹽中各元素的原子個數比是 ;
(3)蘋果酸鈉鹽的相對分子質量是 ;
(4)蘋果酸鈉鹽中各元素的質量比是 ;
(5)蘋果酸鈉鹽中鈉元素的質量分數是多少?
(6)若某病人每天食用15.6 g蘋果酸鈉鹽,則該病人從蘋果酸鈉鹽中攝入了多少克鈉元素?
(7)每天食用的15.6 g蘋果酸鈉鹽,相當于食用了多少質量的食鹽?
五、教學效果與反思
教學過程中,教師注意新授知識與原有知識的聯系,從元素符號量的涵義入手,結合水分子的模型,幫助學生進行想象和理解,降低了知識跨度,引導學生初步認識化學式中量的涵義,并進一步體會到“純凈物有固定的組成”;通過示范教學和模仿練習,使學生清晰掌握初中化學式基本計算的解題思路、方法及其書寫格式,繼而從原理上理解了可以根據化學式進行定量計算的重要依據:真實質量比等于相對質量總和之比。
這種教學方法和學生由此獲得的定量處理問題的能力可以涵蓋后繼化學方程式涵義和計算的學習。從而初中化學的3種基本化學用語可以從量的角度形成層層遞進的一條知識線:元素符號(表示該元素原子的相對原子質量) 化學式(表示化合物中各元素質量比及某一元素的質量分數) 化學方程式(表示反應中各物質質量比)。
(收稿日期:2014-10-27)

