抑制ANGPTL4基因對舌癌細胞放射敏感性的影響
鄧紅彬,李龍浩,高楓,任慶蘭
(重慶醫科大學附屬第一醫院腫瘤科,重慶 400016)
舌癌是最常見的口腔癌之一,早期的病人可單純手術治療,也可單純放療。放療的優勢在于對舌功能的保留。中晚期舌癌可采用放療和手術的綜合治療。放療是舌癌的重要治療手段之一[1],但放療時可能出現一系列副反應,很多病人無法耐受,且隨著放射劑量的增加,副反應發生率及嚴重程度會加重[2]。如能找到增加舌癌放射敏感性的方法,可降低放療劑量,減少腫瘤周圍正常組織的損傷,提高患者生活質量,因此研究舌癌放射增敏具有重要現實意義。近年來基因與放療敏感性的關系受到越來越多的關注,通過改變基因調控來提高腫瘤對放療的敏感性可能是一種非常有前景的方法,但相關報道并不多見。ANGPTL4(angiopoietin-like 4)是2000年新發現的一個基因,研究表明該基因與惡性腫瘤的增殖、轉移有關[3]。而該基因與惡性腫瘤放射敏感性的關系國內外卻罕有報道。本文通過反義技術對ANGPTL4基因進行抑制,觀察它對舌癌細胞Tca8113放射敏感性的影響。
1 材料與方法
1.1 材料與試劑
舌癌細胞株Tca8113購自重慶醫科大學病理生理教研室;脂質體Lipofectamine 2000購自Invitrogen公司;RT-PCR試劑盒購自Tiangen公司;AO(丫啶橙)、EB(溴乙錠)購于 Sigma公司;胰蛋白酶購自Promega公司;胎牛血清、RPMI-1640培養液購自Gibco公司。寡核苷酸由上海生工生物工程有限公司設計合成,皆經全硫代修飾。ANGPTL4正義寡核苷酸序列為:5'—ATGGAGCACATACAGGGA—3';ANGPTL4反義寡核苷酸序列為:5'—TCCCTGTATGTGCTCCAT—3'
1.2 實驗分組
本研究分為4組:空白對照組、脂質體組、ANGPTL4正義寡核苷酸(Sense Oligodeoxynucleotide,SODN)組以及ANGPTL4反義寡核苷酸(Antisense Oligodeoxynucleotide,ASODN)組。
1.3 細胞培養及寡核苷酸轉染
將Tca8113舌癌細胞置于37℃、飽和濕度、5%CO2孵箱中,用 10%胎牛血清和青-鏈霉素各100 U/mL的RPMI-1640培養液培養。將2×105的細胞接種于6孔板上,24 h后細胞有40% ~60%融合,將脂質體與寡核苷酸以1∶1質量比分別加入1 μm ANGPTL4正義和反義寡核苷酸中,參照LipofectamineTm2000轉染策略轉染,6 h后換用含胎牛血清的RPMI-1640培養液培養48 h。
1.4 RT-PCR檢測舌癌Tca8113細胞ANGPTL4的表達
采用Trizol法按試劑盒說明書提取各組Tca8113細胞總RNA。RT-PCR用兩步法,先取5 μg RNA為模板,合成逆轉錄cDNA;再以ANGPTL4特異引物在Taq酶作用下PCR擴增,引物序列為:Primer1:5'-GGCGAGTI'CTGGCTGGGTCT-3';Primer2:5'-TGGCCGTTGAGGTTCCAATG-3'。內 參 照 β-actin(肌動蛋白)引物序列為:Primer1:5'-GCGGGAAATCGTGCGTGACATT-3';Primer2:5'-GATGGAGTTGAAGGTAGTTTCGTG-3'。擴增條件:94℃預變性5 min,后變性95℃ ×25 s,退火70℃ ×45 s,總計30個循環。最后延伸72℃ ×8 min。用PCR產物10 μL在瓊脂糖凝膠電泳,比較 ANGPTL4表達。ANGPTL4擴增片段為329 bp。計算機采集圖像并測定各條帶的峰強度(Peak Intensity),各峰強度值與內參條帶的峰強度的比值即為數據結果(即為RT-PCR量)。RT-PCR量與對照組的比值為基因的表達量。
1.5 X射線(直線加速器)照射
室溫條件下對實驗各組行直線加速器(VARIAN2300CD)6MV X射線(劑量率300cGy/min)照射0 Gy、2 Gy 或 4 Gy。
1.6 集落形成試驗
照射后立刻制成單細胞懸液,細胞濃度為1×103/mL,在6孔板上以每孔300 μL接種,每組同時設2個復孔。培養7~14 d后固定并染色。顯微鏡下計數≥50個細胞的集落,計算集落形成率。重復實驗3次。
集落形成率(%)=計數集落形成數/300×100%。
1.7 AO/EB熒光染色法檢測細胞凋亡
將各實驗組照射4 Gy后的細胞制成單細胞懸液,0.4%臺盼藍染色并計數活細胞數,細胞濃度調整為1×105/mL。在預先放有無菌小玻片的6孔板中接種2 mL,每組設3個平行孔。培養5 d后終止實驗。AO(100 μg/mL)與 EB(100 μg/mL)按 1∶1新鮮混合配制。熒光顯微鏡下計數。結果判斷:活細胞(VN):為正常結構,核染色質呈綠色;早期凋亡細胞(VA):為圓球或固縮狀,核染色質呈綠色;晚期凋亡細胞(NVA):為圓球或固縮狀,核染色質呈橘紅色;非凋亡的死細胞(NVN):正常結構,核染色質呈橘紅色。隨機選擇3個視野,計數各類細胞。重復3次。
1.8 流式細胞儀檢測Bcl-2蛋白的表達
將各組細胞照射4 Gy后收集1×106個細胞,以1∶1甲醛及丙酮行固定10~15 min,0.1%Saponin PBS漂洗 2次,加入 1%人 AB型血清,4℃ ×10 min,再加入1∶10 稀釋的Bcl-2 I抗10 μL,4 ℃ ×30 min,再次0.1%Saponin PBS漂洗并加入1∶100稀釋的 IgG-FITC Ⅱ 50 μL,4 ℃ ×30 min,然后0.1%Saponin PBS漂洗2次,重懸細胞于1%多聚甲醛中,流式細胞儀上機檢測。
1.9 統計學分析
使用統計軟件為SPSS 17.0,計量資料用均數±標準差(±s)表示,各組間差異比較采用雙因素方差分析,組間兩兩比較采用LSD-t及SNK-q法。檢驗水準a=0.05。
2 結果
2.1 RT-PCR檢測Tca8113細胞的ANGPTL4表達
RT-PCR實驗結果顯示:與空白對照組、脂質體組和 SODN組比較,轉染 ANGPTL4 ASODN后,Tca8113細胞ANGPTL4基因的表達被抑制,較空白對照組下降約44%,而其他3組之間無明顯差異(圖1,表1)。
2.2 各實驗組集落形成試驗結果
集落形成試驗結果提示(表2):ASODN組集落形成率與各組相比在照射后明顯下降(2 Gy組,各組間比較F=38.782,P<0.001),并且隨著照射劑量的增加,這種趨勢愈加明顯(4 Gy組,各組間比較F=71.331,P<0.001)。以上結果提示轉染 ANGPTL4 ASODN的受照射腫瘤細胞生長被顯著抑制,提高了舌癌細胞Tca8113的輻射敏感性。

圖1 RT-PCR在四組中檢測到ANGPTL4的表達
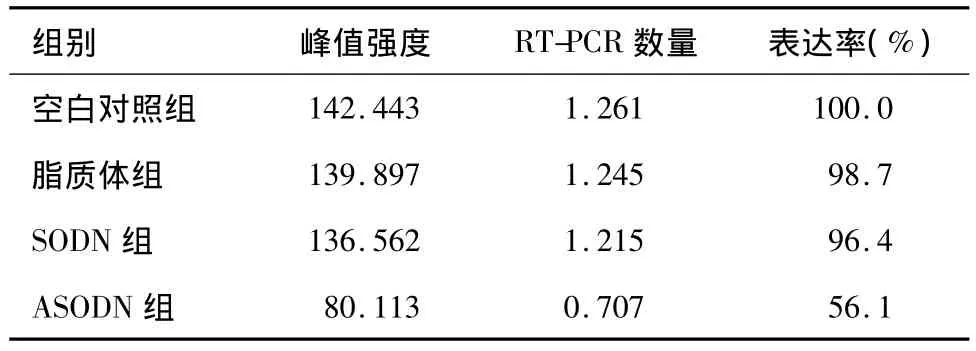
表1 實驗各組Tca8113細胞ANGPTL4 RT-PCR結果
表2 實驗各組X射線照射后的集落形成率(%,n=10,±s)
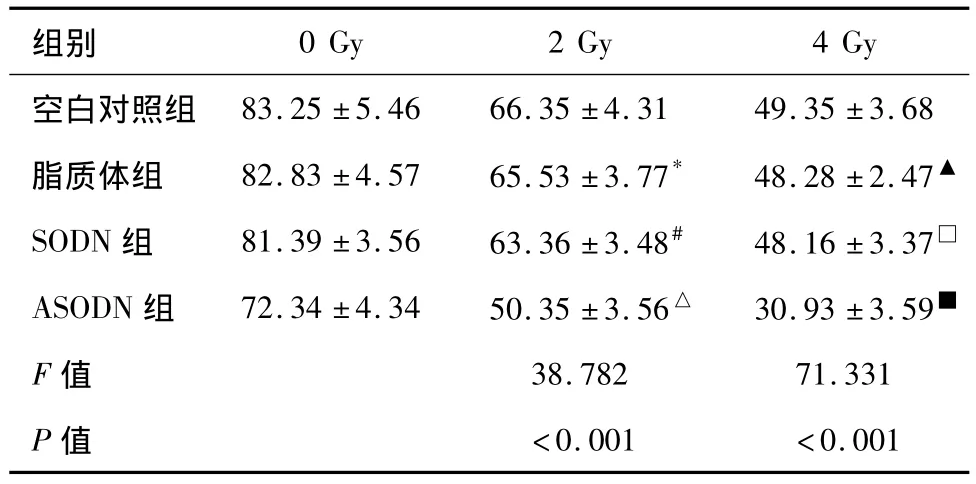
表2 實驗各組X射線照射后的集落形成率(%,n=10,±s)
*與空白對照組比較,P=0.632;#與空白對照組比較,P=0.086;△分別與空白對照組、脂質體組、SODN組兩兩比較,均為P<0.001;▲與空白對照組比較,P=0.474;□與空白對照組比較,P=0.428;■分別與空白對照組、脂質體組、SODN組兩兩比較,均為P<0.001。
空白對照組<0.001 <0.001 83.25±5.46 66.35±4.31 49.35±3.68脂質體組 82.83±4.57 65.53±3.77* 48.28±2.47▲SODN組 81.39±3.56 63.36±3.48# 48.16±3.37□ASODN組 72.34±4.34 50.35±3.56△ 30.93±3.59■F值 38.782 71.331 P值
2.3 AO/EB熒光染色法檢測各實驗腫瘤組細胞凋亡結果
熒光染色法結果可見:和各對照組比較,經ANGPTL4 ASODN轉染后的受照射舌癌細胞中出現大量凋亡細胞(圖2)。表3顯示脂質體組和SODN組的凋亡率都較空白對照組有所下降,但無統計學顯著性意義(組間兩兩比較P=0.398,P=0.294),而ASODN組照射后凋亡率明顯增加,與空白對照組、脂質體組及SODN組比較有顯著性差異(各組間比較F=156.320,P<0.001,組間兩兩比較均 P<0.001)。
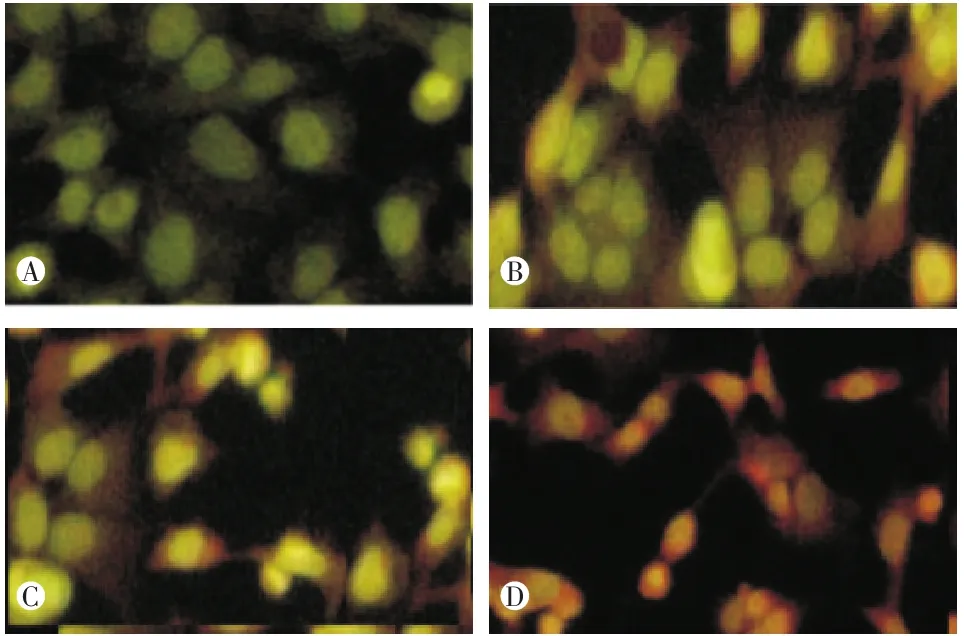
圖2 實驗各組熒光染色法檢測結果(400×)
表3 實驗各組經4 Gy X射線照射后的凋亡率(%,n=9±s)
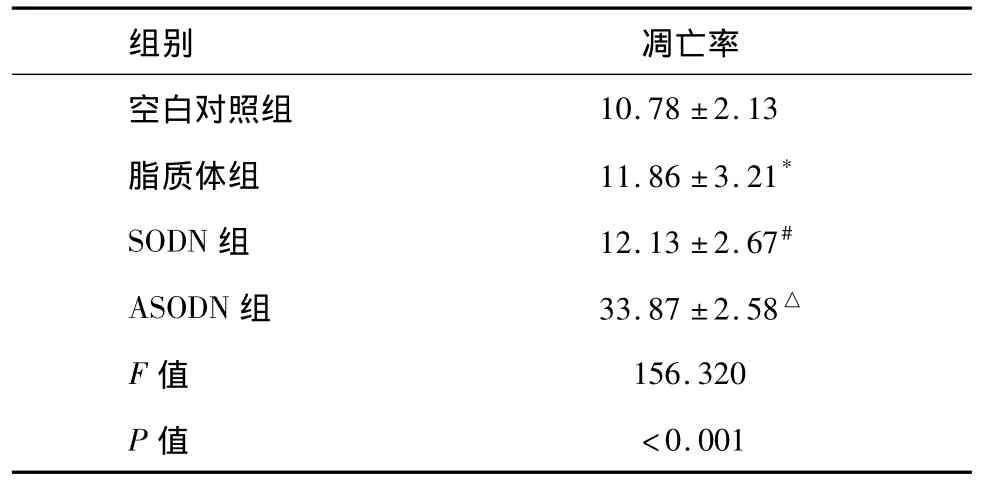
表3 實驗各組經4 Gy X射線照射后的凋亡率(%,n=9±s)
*與空白對照組比較,P=0.398;#與空白對照組比較,P=0.294;△分別與空白對照組、脂質體組、SODN組兩兩比較,均為P <0.001。
空白對照組10.78±2.13脂質體組 11.86±3.21*SODN組 12.13±2.67#ASODN組 33.87±2.58△F值 156.320 P值 <0.001
2.4 免疫熒光測定實驗各組腫瘤細胞Bcl-2蛋白的表達結果
流式細胞儀檢測后顯示:各實驗組Bcl-2表達都有所下降,但ANGPTL4 ASODN組Bcl-2表達明顯下調(各組間比較F=302.895,P<0.001,組間兩兩比較均為P<0.001,見表4)。
表4 各組經4 Gy照射后Bcl-2蛋白表達(%,n=8±s)
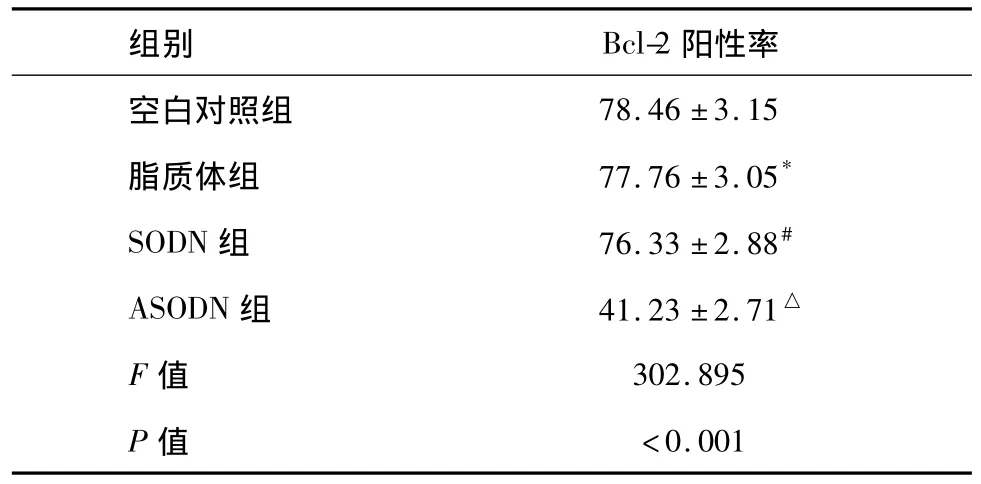
表4 各組經4 Gy照射后Bcl-2蛋白表達(%,n=8±s)
*與空白對照組比較,P=0.639;#與空白對照組比較,P=0.160;△分別與空白對照組、脂質體組、SODN組兩兩比較,均為P<0.001。
空白對照組78.46±3.15脂質體組 77.76±3.05*SODN組 76.33±2.88#ASODN組 41.23±2.71△F值 302.895 P值 <0.001
3 討論
2000年,Kim等首先采用RACE技術從人胎盤cDNA文庫中分離出了一個新基因,該基因的mRNA在肝臟中呈特異性高表達,后來該基因被命名為血管生成素樣蛋白4(ANGPTL4),人的ANGPTL4基因定位在19p13.3,有7個外顯子和6個內含子,基因cDNA全長為1943bp,開放閱讀框含1 218 bp,編碼406個氨基酸,預計分子量為45.2 kDa[3]。國內外對ANGPTL4與各種腫瘤關系的研究報道較多。Nakayama等[4]研究表明ANGPTL4在結直腸癌中的表達與腫瘤靜脈浸潤和轉移有密切關系。洪思琦等[5]用攜帶siANGPTL4基因的重組腺病毒感染骨肉瘤細胞株MG63,使其內源性表達的ANGPTL4基因沉默從而使MG63細胞體外增殖被抑制。不過在不同惡性腫瘤中及相同腫瘤的不同類型中,ANGPTL4的表達及作用并不一致,對腫瘤的影響仍有爭議,也有相關報道在某些腫瘤細胞可抑制其遷移和侵襲,在某些腫瘤細胞系中表達會下降。Zhang等[6]研究發現ANGPTL4的表達可以抑制乳腺癌細胞向肺組織的擴散。曾一元等[7]研究發現不同的肝癌細胞株轉染ANGPTL4基因后,它們的過表達穩定細胞株的細胞增殖率有明顯差異,而在裸鼠體內實驗中ANGPTL4基因對不同的肝癌細胞株可分別表現為抑制成瘤和促進成瘤兩種作用。造成這一結果的原因可能是不同的癌細胞株有著不同的基因譜表達,在基因及蛋白等水平的不同調控反饋作用結果。另一項研究發現ANGPTL4在正常乳腺上皮細胞呈高表達,而在乳腺原位癌中卻表達下降,原因可能與ANGPTL4基因的甲基化有關[8]。ANGPTL4在腫瘤中的作用是復雜的,在不同組織的腫瘤中,ANGPTL4表現出不同的作用,顯示出環境和組織特異性,需要進行更多的實驗研究。而在臨床研究中舌癌患者的ANGPTL4表達可作為患者獨立預后因子,高表達者提示預后較差[9]。ANGPTL4還與腫瘤新生血管有一定的關系,趙劍鋒等[10]認為胃癌組織中ANGPTL4 mRNA高表達可能促進新生血管形成,腫瘤細胞浸潤和轉移。Katanasaka等[11]在惡性神經膠質瘤細胞中發現ANGPTL4的表達與新生血管的形成相關。ANGPTL4不但參與惡性腫瘤的增殖及轉移、與腫瘤新生血管相關,而且其在腫瘤細胞中可被乏氧、壞死等因素誘導表達,其中過氧化物酶體增殖物激活受體和缺氧誘導因子-1被認為是ANGPTL4的關鍵調控基因[12-13],值得注意的是,它們也是影響腫瘤放射療效的重要因子,提示ANGPTL4可能與腫瘤放療存在相關性,而有關該基因與惡性腫瘤放射敏感性的關系的研究國內外罕有報道。綜上所述,ANGPTL4基因不但與腫瘤細胞的增殖和轉移有關,對放療的敏感性也可能有影響,如果抑制ANGPTL4基因表達,可以進一步明確其與細胞增殖和凋亡的關系及其對放療敏感性的影響。
本實驗通過反義技術對舌癌細胞中ANGPTL4基因進行抑制,發現其表達率下降約44%。該基因被抑制后,經過照射處理的舌癌細胞集落形成率較SODN組及空白對照組和脂質體組明顯下降,并且隨著照射劑量的增加,這種趨勢愈加明顯,提示轉染ANGPTL4 ASODN對人舌癌細胞具有輻射增敏作用。熒光染色法檢測結果提示轉染ASODN后受照射細胞凋亡率由空白對照組10.78%增加到33.87%;同時流式細胞儀測定結果可見受照射腫瘤細胞的Bcl-2蛋白表達率僅為41.23%,而空白對照組、脂質體組和SODN組分別為78.46%、77.76%和76.33%,ASODN組和后三者比較有統計學顯著性差異(P<0.001)。以上實驗結果顯示ANGPTL4 ASODN抑制ANGPTL4基因表達后能增加舌癌細胞放射敏感性,其輻射增敏機制可能與 ANGPTL4 ASODN下調舌癌細胞Bcl-2基因表達、增加X射線照射后腫瘤細胞的凋亡率有關。由于反義技術抑制基因表達存在不足之處,以及抑制ANGPTL4基因后對舌癌細胞放射增敏機制可能還涉及其他方面,比如輻射信號轉導、放射損傷修復、細胞周期、體內微環境等等,還需要進一步研究。
[1]Pulte D,Brenner H.Changes in survival in head and neck cancers in the late 20th and early 21st century:a period analysis[J].Oncologist,2010,15(9):994-1001.
[2]Rhodus NL.Management of oral complications from radiation and chemotherapy[J].Northwest Dent,2010,89(1):39-42.
[3]鄭茜文,毛熙光.血管生成素樣蛋白4在腫瘤生長與轉移中的作用研究進展[J].西南軍醫,2014,16(2):219-222.
[4]Nakayama T,Hirakawa H,Shibata K,et al.Expression of angiopoietin-like 4(ANGPTL4)in human colorectal cancer:ANGPTL4 promotes venous invasion and distant metastasis[J].Oncol Rep,2011,25(4):929-935.
[5]Zhang H,Wong CC,Wei H,et al.HIF-1-dependent expression of angiopoietin-like 4 and L1CAM mediates vascular metastasis of hypoxic breast cancer cells to the lungs[J].Oncogene,2012,31(14):1757-1770.
[6]洪思琦,畢楊,郭振華,等.攜帶siANGPTL4重組腺病毒的構建及其對MG63增殖的抑制作用[J].第三軍醫大學學報,2011,33(1):28-32.
[7]曾一元,郝向芳,李紅,等.ANGPTL4基因對不同肝癌細胞株生長的影響[J].腫瘤,2008,28(10):819-824.
[8]Hattori N,Okochi-Takada E,Kikuyama M,et al.Methylation silencing of angiopoietin-like 4 in rat and human mammarycarcinomas[J].CancerSci,2011,102(7):1337-1343.
[9]Wang Z,Han B,Zhang Z,et al.Expression of angiopoietin-like 4 and tenascin C but not cathepsin C mRNA predicts prognosis of oral tongue squamous cell carcinoma[J].Biomarkers,2010,15(1):39-46.
[10]趙劍鋒,陳金坤,林麗娟,等.ANGPTL4基因表達和血管生成與胃癌發展的關系[J].中國當代醫藥,2013,20(8):13-15.
[11]Katanasaka Y,Kodera Y,Kitamura Y,et al.Epidermal growth factor receptor variant type III markedly accelerates angiogenesis and tumor growth via inducing c-myc mediated angiopoietin-like 4 expression in malignant glioma[J].Mol Cancer,2013,12:31.
[12]He P,Borland MG,Zhu B,et al.Effect of ligand activation of peroxisome proliferator-activated receptor-beta/delta(PPARbeta/delta)in human lung cancer cell lines[J].Toxicology,2008,254(1-2):112-117.
[13]Girroir EE,Hollingshead HE,Billin AN,et al.Peroxisome proliferator-activated receptor-beta/delta(PPARbeta/delta)ligands inhibit growth of UACC903 and MCF7 human cancer cell lines[J].Toxicology,2008,243(1-2):236-243.

