Li1.1Ni1/3Co1/3Mn1/3O2正極材料的制備與性能研究
張延亮,劉振法,何蕊,張利輝,白雪
(1.河北工業大學化工學院,天津 300130;2.河北省科學院能源研究所,河北石家莊 050081;3.河北省工業節水工程技術研究中心,河北石家莊 050081)
Li1.1Ni1/3Co1/3Mn1/3O2正極材料的制備與性能研究
張延亮1,2,劉振法2,3,何蕊2,3,張利輝2,3,白雪1,2
(1.河北工業大學化工學院,天津 300130;2.河北省科學院能源研究所,河北石家莊 050081;3.河北省工業節水工程技術研究中心,河北石家莊 050081)
以Li2CO3、NiCO32Ni OH24H2O、CoCO3xH2O和MnCO3為原料,采用高溫固相法,制備了Li1.1Ni1/3Co1/3Mn1/3O2正極材料.通過X射線衍射儀(XRD)和掃描電子顯微鏡(SEM)對材料的結構和形貌進行了表征,并采用恒電流充放電測試系統對該材料的電化學性能進行測試.結果表明:第2次球磨時加鋰鹽合成的Li1.1Ni1/3Co1/3Mn1/3O2樣品結構完整,為-NaFeO2型二維層狀結構,屬于R-3m空間群,且該樣品的陽離子混排程度較低,顆粒大小比較均勻.該樣品在0.1C放電倍率和2.4~4.6 V電壓范圍的首次放電比容量為182.7 mAh/g,循環57次后,容量的仍高達保持率為95.1%,表現出良好的循環性能.
正極材料;Li1.1Ni1/3Co1/3Mn1/3O2;高溫固相法;鋰離子電池;球磨
0 引言
鋰離子電池已經在手機、相機和筆記本等數碼產品,電動工具、家用小電器、航空航天、軍事裝備以及人造衛星等領域得到廣泛的應用.商業化的主流正極材料LiCoO2雖然性能穩定,但鈷是有毒性元素,且鈷資源稀缺、價格昂貴以及過充安全性能較差,限制了它的應用范圍;LiMnO2正極材料,由于錳元素資源豐富、價格低廉而被看好,但是尖晶石LiMnO2材料在使用的過程中不可避免的會發生John-Teller畸變效應,使得錳酸鋰材料的結構穩定性較差,阻礙了它的廣泛應用;LiNiO2由于合成困難以及穩定性差會發生放熱分解無法單獨作為正極材料使用;因此尋找性價比更高的正極材料是十分重要的研究課題.層狀結構Li[Ni,Co, Mn]O2正極材料較好地兼備了LiCoO2、LiMnO2和LiNiO2的優點,還在一定程度上彌補了各自的不足,Co元素能夠減少陽離子混合占位情況,有效穩定材料的層狀結構,Ni元素可以提高材料的容量,Mn元素不僅可以提高材料的安全性能而且還可以降低材料的成本,使得Li[Ni,Co,Mn]O2正極材料具有電化學比容量高、循環性能好、成本相對較低、安全性能較好等特點[1-5],是極具應用前景的動力鋰離子電池正極材料之一.
由于固相法具有工藝和設備簡單,容易操作和易實現工業化的特點,本文采用固相法合成Li1.1Ni1/3Co1/3Mn1/3O2并對其性能進行表征.
1 實驗部分
1.1 Li1.1Ni1/3Co1/3Mn1/3O2的制備
按照n Ni∶n Co∶n Mn=1∶1∶1的物質的量比稱取原料NiCO32Ni OH24H2O、CoCO3xH2O和MnCO3,按n Li∶n M=1.1∶1(M=Ni+Co+Mn)比例稱取Li2CO3,按10∶1球料比稱量不同尺寸的瑪瑙球并以無水乙醇為分散劑,混合放入球磨罐中,使其在行星式球磨機中球磨(記為第1次球磨)3 h,轉速為300 r/min.在烘箱80℃烘干后過篩,放入箱式爐中在空氣氣氛條件下500℃預燒5 h,冷卻后再在上述同樣的球磨條件下球磨(記為第2次球磨)3 h,在烘箱80℃烘干后過篩,放入箱式爐中以3℃/min升溫到900℃高溫焙燒20 h,然后隨爐自然冷卻至室溫,研磨并過篩即得正極材料Li1.1Ni1/3Co1/3Mn1/3O2,并標記為樣品A.樣品B的制備為在第1次球磨的時候不加Li2CO3,在第2次球磨的時候再加入Li2CO3,其余條件相同.
1.2 Li1.1Ni1/3Co1/3Mn1/3O2的表征
用Rigaku公司UItimaⅣ型X射線衍射儀對合成的Li1.1Ni1/3Co1/3Mn1/3O2正極材料進行物相分析.測試條件:電壓40kV,管電流40mA,輻射源為Cu-K射線,步寬0.02°,掃描速度5(°/min,掃描范圍為10°~80°.
用FEI公司InspectS50型掃描電子顯微鏡對合成的Li1.1Ni1/3Co1/3Mn1/3O2正極材料進行表觀形貌分析.測試條件:電壓5.0 kV,工作距離10 mm左右,放大倍數為3萬倍.
1.3 電池的組裝與測試
按90∶5∶5的質量分數稱取一定量的燒結樣品、乙炔黑和聚偏氟乙烯(PVDF),再加入一定量的氮甲基吡咯烷酮(NMP),充分攪拌至混合均勻,然后將其均勻地涂在20m厚的鋁箔上,在烘箱80℃烘數小時后再用輥壓機輥壓至一定的厚度,并用沖片機將其沖壓為直徑為14mm的小圓片,轉入真空干燥箱,120℃真空干燥10 h,稱重.以此作為電池的正極以金屬鋰片為對電極,Celgard 2400微孔聚丙烯膜為隔膜,1 mol/L的LiPF6/(EC+DMC+EMC)(體積比為1∶1∶1)的溶液為電解液,在充滿氬氣的手套箱里組裝成CR2032型紐扣式電池,靜置一定的時間后在室溫以0.1 C、0.2 C、0.5 C的放電倍率和2.4~4.6 V的電壓范圍內進行充放電測試.
2 結果與討論
2.1 Li1.1Ni1/3Co1/3Mn1/3O2的結構特性
圖1為合成的正極材料Li1.1Ni1/3Co1/3Mn1/3O2的XRD譜圖,由圖1中各衍射峰可以看出合成的Li1.1Ni1/3Co1/3Mn1/3O2正極材料結構為-NaFeO2型層狀結構,屬于R-3m空間群,沒有雜質峰[6],說明得到的樣品比較理想.在上述結構中,Li占據3a位置,O占據6c位置,Ni、Co、Mn占據3b位置,由于Ni2+的半徑(0.0690nm)和Li+半徑(0.076nm)比較接近,Ni容易從3b位置遷移到3a位置取代Li造成陽離子混排.鎳鈷錳三元復合層狀材料結構中陽離子的混排程度可用譜圖中(003)和(104)衍射峰強度的比值I003/I104來表征,而且I003/I104的值與陽離子的混排程度成反比[7],當I003/I104的比值<1.2時,晶體中的陽離子混排較為劇烈,Ni遷移到Li所在位置,晶體有序層狀結構被破壞,峰(006)與峰(102)逐漸合并為六方晶系的峰(111),峰(108)和峰(102)逐漸合并為六方晶系的峰(220),因此層狀結構的二維有序程度可用(006)/(102)和(108)/(110)兩組衍射峰之間的分裂程度來標準[8-9].由圖1可以看出,樣品A和B的(006)/(102)和(108)/(110)峰在38°和64°位置分離明顯,較樣品A來說,樣品B的各個峰都比較尖銳.晶體中c/a值用來表征晶體材料的二維層狀特征,且c/a值越大層狀結構越完整、穩定性越強,c/a值大于4.899就可說明晶體材料有良好的層狀結構[10].計算樣品A的晶胞參數a=0.286 59 nm,c=1.423 94 nm,由c、a值得c/a=4.968 6,由峰強度得I003/I104=1.293 0;樣品B的晶胞參數a=0.286 16 nm,c=1.422 06 nm,由c、a值得c/a=4.9695,由峰強度得I003/I104=1.343 8,由此可以表明合成的樣品B正極材料的層狀結構完整,混排程度較輕.
2.2 Li1.1Ni1/3Co1/3Mn1/3O2的形貌特征
圖2為合成的正極材料Li1.1Ni1/3Co1/3Mn1/3O2樣品的SEM圖.由圖2可以看出,合成的樣品均由小顆粒組成.Li2CO3同NiCO32Ni OH24H2O、CoCO3xH2O和MnCO3一起經過混合球磨,在500℃預處理時熱分解釋放的氣體阻礙了Li2CO3進入顆粒內部空隙中,也使得Li2CO3在900℃高溫燒結時分解能力降低,降低熔融狀態下鋰離子的流動性,所以合成的樣品A的顆粒大小分布不均,而且分散性也不好,出現了嚴重的團聚現象,對Li+的嵌入與脫出非常不利[11].NiCO32Ni OH24H2O、CoCO3xH2O和MnCO3混合球磨,在500℃預燒處理時發生熱分解反應,分解釋放一定量的CO2和H2O,增大了合成的鎳鈷錳氧化物的孔隙率,以至于在900℃高溫燒結時Li2CO3能均勻的滲透到鎳鈷錳氧化物的內部[12],使合成的樣品B的顆粒表面光滑、輪廓清晰、結晶度高,顆粒大小比較均勻,為具有良好的電化學性能提供了基礎.

圖1 Li1.1Ni1/3Co1/3Mn1/3O2的XRD譜圖Fig.1XRD patterns of Li1.1Ni1/3Co1/3Mn1/3O2

圖2 Li1.1Ni1/3Co1/3Mn1/3O2的SEM圖Fig.2SEM patterns of Li1.1Ni1/3Co1/3Mn1/3O2
2.3 Li1.1Ni1/3Co1/3Mn1/3O2的電化學性能
圖3為合成的Li1.1Ni1/3Co1/3Mn1/3O2正極材料在0.1C放電倍率的首次充放電曲線,充放電區間為2.4~4.6V.樣品A和B在0.1 C放電倍率的首次充電比容量分別是147.9 mAh/g、186.6 mAh/g;放電比容量分別是145.7 mAh/g和182.7 mAh/g;效率分別是98.5%和97.9%.樣品A和樣品B的放電比容量相差較大,主要歸功于樣品B的晶體有序層狀結構完整,結晶度高,混排程度較輕,顆粒光滑且大小均勻,材料內阻小.
圖4顯示了合成的Li1.1Ni1/3Co1/3Mn1/3O2正極材料樣品在在2.4~4.6V電壓區間,0.2C和0.5C放電倍率下的循環性能.樣品A和B在0.2 C放電倍率下的首次放電比容量分別為133.3 mAh/g和175.9 mAh/g,循環20次后轉入0.5C放電倍率下進行充放電測試,循環20次后再轉入0.2C放電倍率下進行充放電測試,共57次后,樣品A和B的放電比容量分別為121.4mAh/g和167.3mAh/g,保持率分別為91.1%和95.1%.由此可見,二次球磨時加鋰制備的樣品的活性物質有序層狀結構穩定性較好,在與電解液的接觸過程中沒有或輕微發生反應,加上顆粒細小而且大小均勻,使得Li+在活性物質中的遷移能力較強,降低了電池在充放電過程中的極化現象,提高了其循環性能.
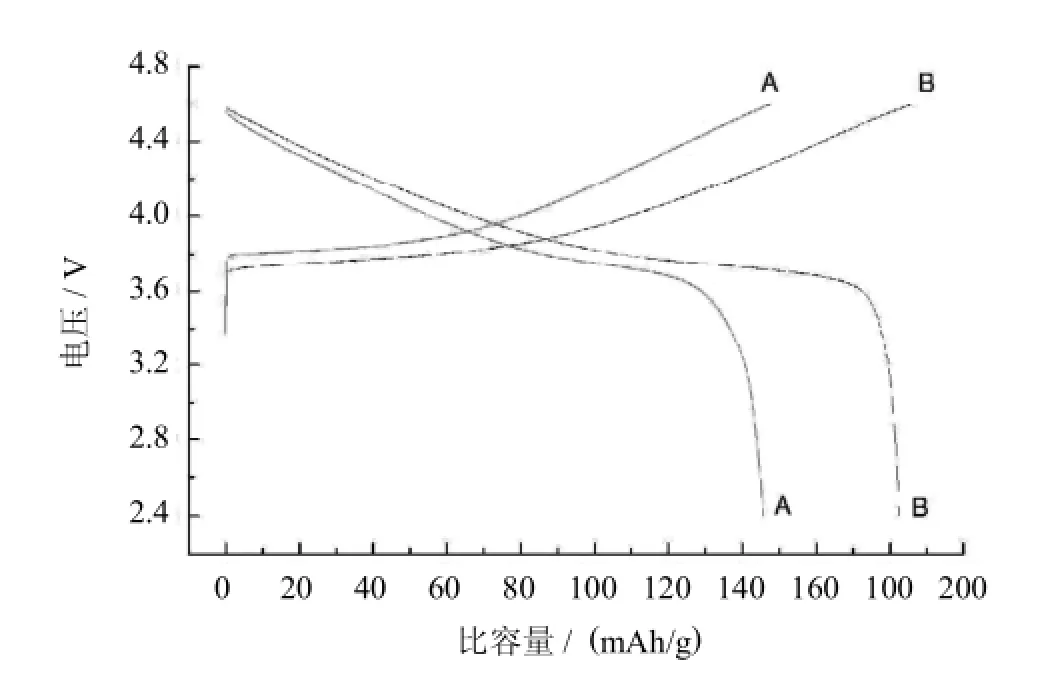
圖3 Li1.1Ni1/3Co1/3Mn1/3O2的首次充放電曲線圖Fig.3The first charge and discharge curves of Li1.1Ni1/3Co1/3Mn1/3O2

圖4 Li1.1Ni1/3Co1/3Mn1/3O2循環性能曲線Fig.4Cycling performance of Li1.1Ni1/3Co1/3Mn1/3O2
3 結論
1)合成的鋰離子電池Li1.1Ni1/3Co1/3Mn1/3O2正極材料具有典型的空間群為R-3m的六方層狀-NaFeO2結構,且結構完整,由樣品的晶胞參數、c/a值和I003/I104值可知樣品B的層狀結構較為完整,陽離子混排程度較輕.
2)第2次球磨時加鋰鹽合成的Li1.1Ni1/3Co1/3Mn1/3O2樣品顆粒輪廓清晰、結晶度高,表面光滑,而且顆粒大小比較均勻,團聚現象也比較輕.
3)第2次球磨時加鋰鹽合成的Li1.1Ni1/3Co1/3Mn1/3O2樣品在0.1C放電倍率的首次充電比容量是186.6mAh/g;放電比容量是182.7mAh/g;并在不同放電倍率循環57次后,放電比容量的保持率為95.1%,表現出良好的循環性能.
[1]劉祥哲,馮季軍,劉曉貞.LiNi1/3Co1/3Mn1/3O2的低熱固相合成與性能[J].濟南大學學報(自然科學版),2010,4(4):354-367.
[2]胡國榮,劉強,杜柯,等.高容量鋰離子電池正極材料LiNi0.9Co0.05Mn0.025Mg0.025O2的合成及電化學性能[J].無機化學學報,2012,28(6):1171-1176.
[3]劉攀,樊勇利,許國峰.球形5 V尖晶石LiNi0.5Mn1.5O4正極材料合成及性能[J].電源技術,2014,38(2):210-213.
[4]廖菊蓉,鄧丹丹,何麗瓊,等.球磨燒結對錳系混合正極材料性能的影響[J].電源技術,2014,38(1):38-39,77.
[5]杜柯,伍斌,胡國榮,等.兩步固相法制備正極材料LiNi0.8Co0.2O2[J].電池,2011,41(5):264-267.
[6]閆芳,葉乃清,田華,等.一種合成鋰離子電池正極材料LiNi1/3Co1/3Mn1/3O2的新方法[J].電源技術,2012,36(1):49-51,78.
[7]李奇峰,朱華麗,劉平禮,等.鋰離子電池正極材料LiNi1/3Co1/3Mn1/3O2的制備及其電化學性能[J].合成化學,2013,21(2):151-156.
[8]劉伶,關昶,張乃慶,等.鋰離子電池正極材料Li Ni1/3Co1/3Mn1/3O2電極過程動力學研究[J].人工晶體學報,2012,41(1):200-203,220.
[9]李偉偉,李麗,楊理.LiNi0.5Co0.2Mn0.3O2的制備及性能研究[J].有色金屬(冶煉部分),2014,07:53-55.
[10]郭瑞,史鵬飛,程新群,等.高溫固相法合成LiNi1/3Mn1/3Co1/3O2及其性能研究[J].無機化學學報,2007,23(8):1387-1392.
[11]羅永春,張鐵軍,王鐸,等.球磨改性對TiCr0.497V0.42Fe0.083/30%(w)LaRMg NiCoAl3.5合金復合電極材料儲氫和電化學性能的影響[J].物理化學學報,2010,26(9):2397-2404.
[12]田永淑,李艷娟,劉永光,等.改進固相法合成LiNixCoyMn1-x-yO2正極材料及性能研究[J].無機鹽工業,2010,42(2):24-27.
[13]唐致遠,高飛,薛建軍.球磨方式對鋰離子電池正極材料LiFePO4性能的影響[J].無機化學學報,2007,23(8):1415-1420.
[14]滑緯博,郭孝東,鄭卓,等.納米片LiNi1/3Co1/3Mn1/3O2正極材料的制備與研究[J].化學研究與應用,2014,36(3):441-444.
[15]梁興華,華曉鳴,劉于斯,等.汽車動力電池正極材料錳酸鋰球磨工藝研究[J].廣西工學院學報,2012,23(4):74-77.
[16]劉環,李永梅,姚耀春,等.鋰離子電池正極材料LiCo1/3Mn1/3Ni1/3O2的制備與性能研究[J].化學工業與工程,2012,29(1):7-11,16.
[責任編輯 田豐]
Synthesis and characterization of Li1.1Ni1/3Co1/3Mn1/3O2cathode material
ZHANG Yanliang1,2,LIU Zhenfa2,3,HE Rui2,3,ZHANG Lihui2,3,BAI Xue1,2
(1.School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China;2.Institute of Energy Sources,Hebei Academy of Sciences,Hebei Shijiazhuang 050081,China;3.Hebei Engineering Research Center for Water Saving in Industry,Hebei Shijiazhuang 050081,China)
Li1.1Ni1/3Co1/3Mn1/3O2wassynthesized fromLi2CO3,NiCO32Ni OH24H2O,CoCO3xH2Oand MnCO3byhigh temperature solid method.The physical and electrochemical properties of the material were characterized by X-ray diffraction(XRD),scanning electron microscope(SEM)and galvanostatic charge-discharge test.The results showed that the sample of Li1.1Ni1/3Co1/3Mn1/3O2had the complete structure of hexagonal-NaFeO2type which belonged to the R-3m space group.Cationic degree of order was best and the distribution of the particle size was uniform.Electrochemical test indicates that the first discharge capacity of this sample was 182.7 mAh/g in the voltage range of 2.4~4.6 V and at 0.1 C. The capacity retention ratio was 95.1%and thus proves its good cycling stability.
cathode material;Li1.1Ni1/3Co1/3Mn1/3O2;high temperature solid method;lithium ion battery;ball milling
TM912
A
1007-2373(2015)04-0068-04
10.14081/j.cnki.hgdxb.2015.04.014
2005-03-01
河北省科技支撐項目(14214404D);河北省科學院科研項目(13004004,14011016)
張延亮(1988-),男(漢族),碩士生.通訊作者:劉振法(1963-),男(漢族),研究員,博士,lzf63@sohu.com.
數字出版日期:2015-06-23
數字出版網址:http://www.cnki.net/kcms/detail/13.1208.T.20150623.1634.003.html

