中樞內神經化學物質在癌癥侵襲鏡像痛中的作用及加巴噴丁對其的影響
孫丹丹,王志國,李濤,趙小亮,焦,劉洋,李玉娟,歐陽競鋒,牛曉紅,王丹巧
(中國中醫科學院醫學實驗中心,北京市中醫藥防治重大疾病基礎研究重點實驗室,北京 100700)
?
中樞內神經化學物質在癌癥侵襲鏡像痛中的作用及加巴噴丁對其的影響
(中國中醫科學院醫學實驗中心,北京市中醫藥防治重大疾病基礎研究重點實驗室,北京 100700)
目的 研究脊髓組織神經化學物質谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)及大腦皮質內P物質(substance P,SP)和強啡肽A1-13(dynorphin A1-13,DynA1-13)在癌癥侵襲鏡像痛中的作用及加巴噴丁對其影響。方法 雄性BALB/c小鼠隨機分為正常組、操作對照組(注射0.2 mL滅活的S180肉瘤細胞液)、模型組(于右腿股骨大轉子處注射0.2 mL S180肉瘤細胞液)和加巴噴丁組(0.2 mL S180肉瘤細胞液+120 mg/kg加巴噴丁,ip),造模前及術后分別用Von Frey 纖維絲測定術側及對側后足的機械痛閾值;采用高效液相-熒光法檢測脊髓L3-L5節段內Glu、GABA濃度;放射免疫法檢測大腦皮質內SP、DynA1-13的含量。結果 伴隨術側癌癥侵襲痛的產生,模型組小鼠術側的鏡像部位出現了與術側發展趨勢相同、程度近似的機械痛閾下降。模型組小鼠脊髓內Glu 及大腦皮質內SP水平均顯著升高(P<0.05,P<0.01),而脊髓內GABA及大腦皮質內Dyn A1-13的含量均顯著降低(P<0.05);加巴噴丁給藥后小鼠雙側的機械痛閾值均顯著升高,可持續240 min(P<0.05,P<0.01),并逆轉了癌癥侵襲鏡像痛小鼠中樞神經系統內上述神經化學物質的改變(P<0.01或P<0.05)。結論 S180肉瘤細胞所致癌癥侵襲痛模型小鼠存在鏡像痛現象,脊髓內Glu、GABA及大腦皮質中SP、Dyn A1-13可能參與癌癥侵襲鏡像痛的發生和維持機制,加巴噴丁通過這一機制對癌癥侵襲鏡像痛模型小鼠發揮鎮痛作用。
鏡像痛;癌癥侵襲痛;加巴噴丁;神經化學物質
在軀體損傷部位的對側對稱部位(鏡像部位)出現疼痛和痛覺過敏的病癥稱之為鏡像痛。臨床上,一些嚴重的慢性疼痛及復雜區域疼痛綜合征患者均可出現鏡像痛,其中,癌癥疼痛出現的鏡像痛既嚴重影響患者的生存質量又干擾癌癥的治療,是臨床醫生面臨的棘手問題。由于鏡像痛發生、發展與維持的機制至今尚不十分清楚,治療效果也不理想。據研究報道,許多神經病理性疼痛、炎性疼痛等多種動物模型均可以觀察到雙側痛覺敏感的現象[1-2],大鼠脛骨轉移性癌痛模型也出現鏡像痛現象[3],但臨床上頻發的腫瘤浸潤引起的癌癥侵襲痛(cancer invasion pain,CIP)的動物模型是否出現鏡像痛?相關機制如何?目前鮮見報道。
本實驗擬采用S180肉瘤細胞構建小鼠CIP模型,采用 Von Frey 纖維絲測定小鼠腫瘤細胞接種側及對側后足的機械痛閾值,確認CIP模型小鼠是否發生鏡像痛,并觀察加巴噴丁對其的影響;進一步將采用HPLC-FLD法檢測脊髓內與疼痛發生和維持密切相關的興奮性和抑制性氨基酸谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid,GABA)水平,放射免疫法檢測大腦皮質內源性致痛和鎮痛物質P物質(substance,SP)、強啡肽A1-13(dynorphin A1-13,DynA1-13)的含量,探討中樞神經系統上述物質在CIP鏡像痛機制中的作用,為CIP鏡像痛的機制研究和治療提供參考。
1 材料與方法
1.1 材料
1.1.1 實驗動物:SPF級BALB/c雄性小鼠63只,體質量18~20 g,購于中國食品藥品檢定研究院,許可證號:SCXK(京)2014-0013。
1.1.2 瘤株、主要藥品及試劑:S180肉瘤細胞系中國中醫科學院中藥所惠贈;加巴噴丁(江蘇恒瑞醫藥股份有限公司,批號:14031491 No.121);SP和DynA1-13放免試劑盒(中國人民解放軍第二軍醫大學,批號:20150120);Glu,GABA,乙酸鈉,硼酸(均為 Sigma 公司);甲醇、四氫呋喃(均為Fisher Chemicals),鄰苯二甲醛(Aldrich 公司);β-巰基乙醇(Amresco 公司)。
1.1.3 主要儀器:51000-20C Von Frey hairs 疼痛測試包(美國Danmic公司);XH6080型放射免疫γ計數儀(中國核工業總公司國營二六二廠);臺式高速離心機(德國Eppendorf,5417R);倒置顯微鏡(奧林巴斯,CKX41);組織研磨儀(IKA,T10 basic ULTRA-TURRAX);HPLC檢測系統(德國Sykam S-2100,G1321 A 熒光檢測器,Agilent ZORBAX Eclipse AAA 色譜柱及化學工作站)。
1.2 方法
1.2.1 分組、造模:將凍存的S180肉瘤細胞注射于健康小鼠腹腔,使其產生癌性腹水,收取后分裝凍存。凍存腹水瘤細胞復蘇后,臺盼藍染色計數,調整活細胞濃度1×107個/mL,置于冰盒內備用。將上述小鼠連續3 d進行預刺激(0.16 g纖維絲刺激小鼠雙側的后足),第4天將右后足機械痛閾值≥0.4 g的53只小鼠隨機分為正常組(Native組,n=13)、操作對照組(Sham組,n=13)、手術組(Surgery組,n=27)。Surgery組小鼠于右腿股骨大轉子(相當于坐骨神經分支部位上方)注射0.2 mL瘤細胞液,Sham組于相同部位注射相同體積相同濃度滅活的瘤細胞液。瘤細胞滅活方法:沸水中煮沸15 min,然后臺盼藍染色確定無活細胞。Native組不作任何操作。
1.2.2 行為學評價及藥效觀察:采用機械觸痛法[4]測定小鼠對機械刺激反應的痛閾值。將待測小鼠放在自制的0.5 cm×0.5 cm金屬網孔的疼痛測試架上,用透明塑料盒罩住,其足部可暴露于金屬網孔中,待其探究活動基本消失后,依次用標準化的不同刺激力度(0.008、0.02、0.04、0.07、0.16、0.4、0.6、1、2 g)Von Frey纖維絲,從0.008 g開始,以1次/s的頻率,垂直刺激小鼠雙側后肢足爪底中外側皮膚表面,觀察小鼠的縮足反應,連續試驗5次,記錄出現3次或3次以上縮足反應的最小纖維絲值作為小鼠的機械痛閾值。
術后第2、3、4、5、6、7天測評小鼠術側及對側后足的機械痛閾值,將術后5~7 d連續3 d機械痛閾值≤0.07 g的成模小鼠,隨機分為加巴噴丁組(GBP)和模型組(Model),每組12只。加巴噴丁組于造模術后第8、9、10天腹腔注射加巴噴丁120 mg/kg,1次/d,Model組、Sham組、Native組腹腔注射相同體積的生理鹽水。并于第10天給藥前及給藥后30、60、90、120、180、240 min等時間點測評術側、對側后足的機械痛閾值。
1.2.4 脊髓內Glu及GABA 水平測定:末次行為學測評的次日,再次給藥45 min后,安撫小鼠并脫頸椎斷頭處死,將小鼠身體放在冰上,用剪刀剪開皮膚、剝離肌肉,從脊髓斷點處剪開椎板,暴露脊髓后取L3-L5段脊髓,稱量,加入1 mL冰生理鹽水,使用組織勻漿儀充分勻漿后,經去蛋白及微粒等前處理得到脊髓勻漿的處理液。采用HPLC-FLD法,檢測脊髓組織內的Glu、GABA含量,具體檢測方法參照文獻[5]。
1.2.5 大腦皮質內SP及DynA1-13含量測定:小鼠斷頭后迅速剝離全腦,在冰上分離大腦皮質,放入生理鹽水中煮沸5 min,取出稱量后,置于玻璃勻漿管內加入1 N HCl 1mL充分勻漿,室溫放置100 min,4 ℃ 4000 r/min離心20 min,取上清750 μL,再加入等量的1N NaOH中和酸,采用放射免疫法,按照試劑盒說明書要求測定SP及DynA1-13的含量。

2 結果
2.1 CIP模型小鼠鏡像痛觀察 術后2~7 d連續評價各組小鼠術側、對側的機械痛閾值,發現Surgery組小鼠術側機械痛閾值在術后第2天較Native組明顯下降(P<0.05),第4~7天均穩定維持在(0.030±0.004)g~(0.065±0.024)g,明顯低于Sham組和Native組(P<0.05,P<0.01)。Sham組小鼠的術側機械痛閾值在第2天亦降低,但隨后逐漸回升,第5天以后達到Native組水平,見圖1A;Surgery組小鼠對側機械痛閾值亦在術后第2天明顯下降(P<0.05),第4~7天均穩定維持在(0.062±0.017)g~(0.156±0.085)g,明顯低于Sham組和Native組(P<0.05,P<0.01),見圖 1B。表明CIP模型小鼠對側發生了與術側CIP趨勢相同、程度近似的鏡像痛。
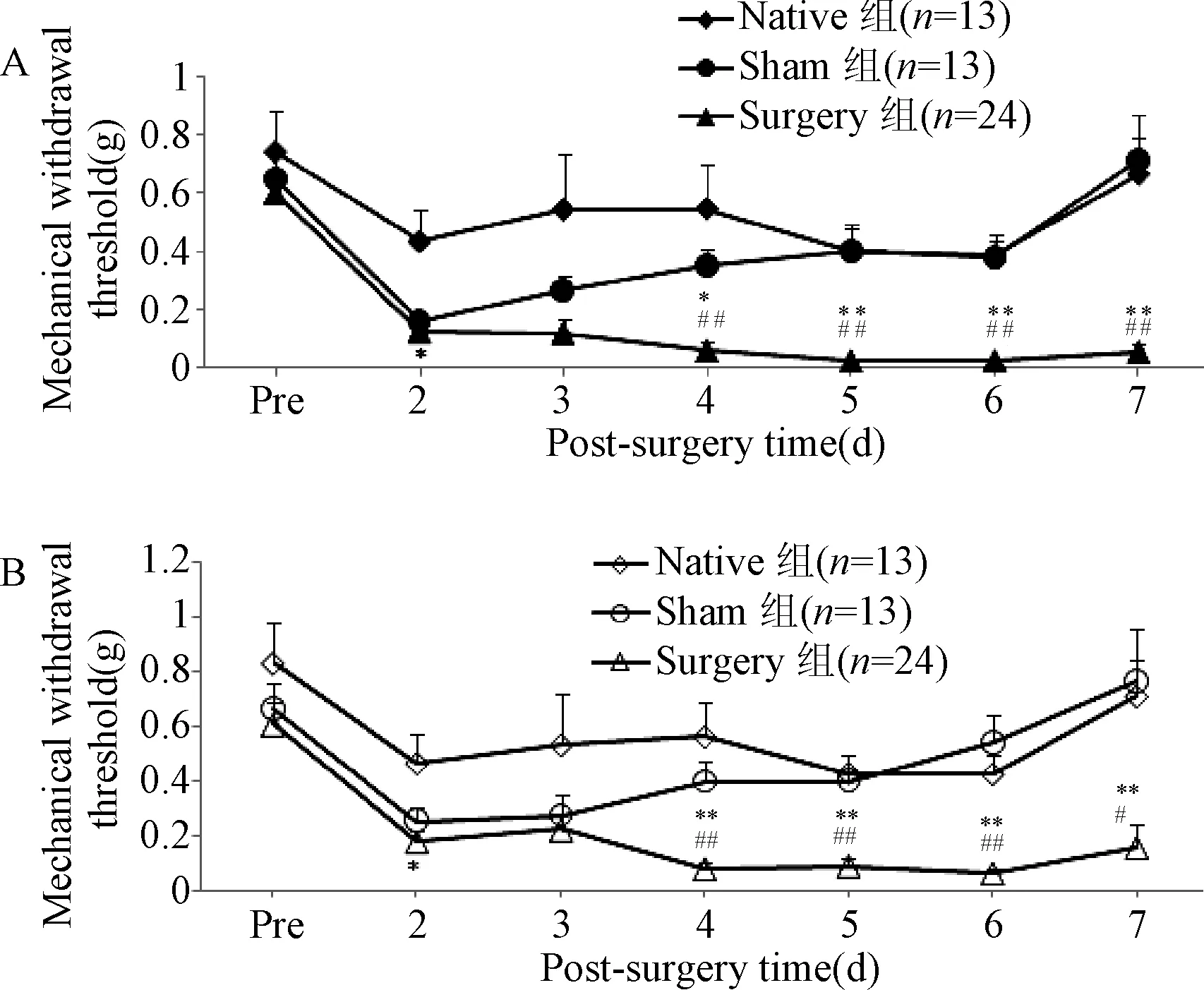
圖1 CIP模型小鼠術側(A)和對側(B)后足機械痛閾值變化±SE)*P<0.05,**P<0.01,與Native組相比;#P<0.05,##P<0.01,與Sham組相比 Fig .1 Changes of mechanical withdrawal threshold of the ipsilateral and contralateral hind paw on CIP model ±SE)*P<0.05,**P<0.01,compared with Native group;#P<0.05,##P<0.01,compared with Sham group
2.2 加巴噴丁對CIP鏡像痛小鼠術側及對側后足機械痛閾值的影響 第3天給藥前小鼠雙側機械痛閾值測評結果見圖 2。術側的機械閾值在給藥后30 min明顯升高,達到(1.77±0.16)g,在觀察的240 min內所有時間點的機械閾值較Model組均顯著升高(P<0.01,P<0.05),見圖2A;對側的機械閾值也在給藥后30 min明顯升高,達到(1.52±0.19)g,在觀察的240 min內所有時間點的機械閾值較Model組均顯著升高(P<0.01,P<0.05),見圖 2B。表明加巴噴丁對小鼠術側CIP及健側鏡像痛均有明顯鎮痛作用。
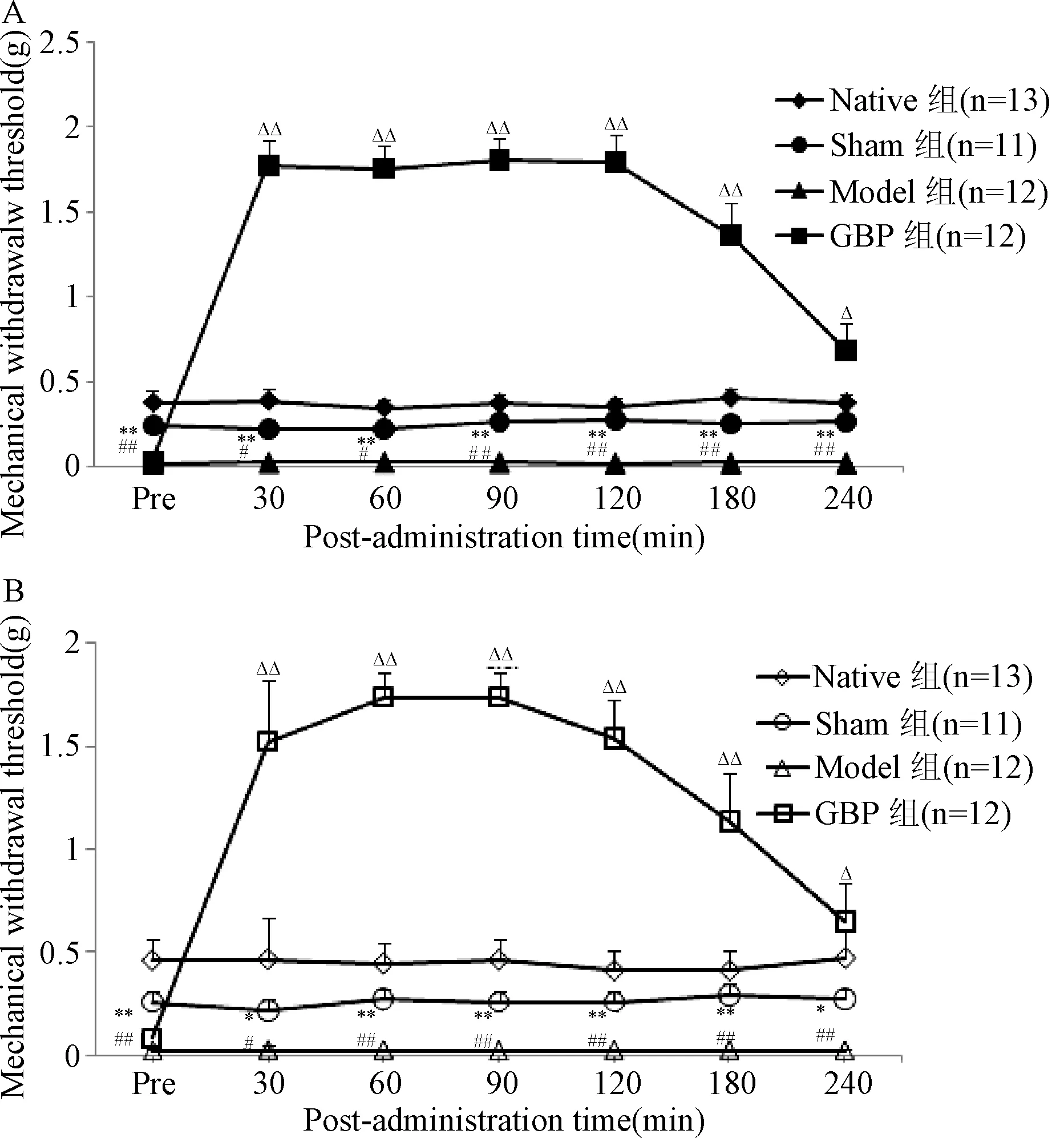
圖2 加巴噴丁對CIP模型小鼠術側(A)和對側(B)后足機械痛閾值的影響*P<0.05,**P<0.01,與Native組相比;#P<0.05,##P<0.01,與Sham組相比;△P<0.05,△△P<0.01,與Model組相比Fig.2 Effects of gabapentin on mechanical withdrawal threshold of the ipsilateral andcontralateral hind paw of CIP mirror image pain ±SE)*P<0.05,**P<0.01,compared with Native group;#P<0.05,##P<0.01,compared with Model group;△P<0.05,△△P<0.01,compared with Model group
2.3 CIP鏡像痛小鼠L3-L5脊髓組織中Glu、GABA水平及加巴噴丁對其的影響 如表1所示,與Native組相比,Model組小鼠脊髓內的Glu水平及Glu/GABA比值顯著升高(P<0.05),而GABA水平顯著降低(P<0.05)。加巴噴丁能顯著抑制CIP模型小鼠脊髓內Glu水平,升高GABA水平,致Glu/GABA比值顯著降低(P<0.01)。Sham組小鼠脊髓內Glu水平較Native組顯著升高(P<0.05),抑制性氨基酸GABA水平及Glu/GABA的比值差異無統計學意義,可能與注射滅活瘤細胞引起一次性CIP及鏡像痛有關。
表1 加巴噴丁對CIP鏡像痛小鼠L3-L5脊髓組織內Glu、 GABA 水平的影響Tab.1 Effects of gabapentin on Glu, GABA of the L3-L5 spinal cord of CIP mirror image pain model ±SE)
*P<0.05,與Native組相比,compared with Native group;△△P<0.01,與Model組相比,compared with Model group
2.4 CIP鏡像痛小鼠大腦皮質內SP及DynA1-13含量及加巴噴丁對其的影響 SP是內源性的致痛物質,與Native組相比,Model組小鼠大腦皮質內SP含量有顯著性升高(P<0.01),加巴噴丁能顯著降低CIP鏡像痛小鼠大腦皮質內SP含量(P<0.05);與Native組相比,CIP鏡像痛Model組內源性的鎮痛物質DynA1-13顯著降低(P<0.05)。加巴噴丁干預后能顯著提高了大腦皮質內DynA1-13含量(P<0.01),見表2。
表2 加巴噴丁對CIP鏡像痛小鼠大腦皮質內SP及 DynA1-13含量的影響Tab.2 Effects of gabapentin on SP and DynA1-13 of Cerebral cortex of CIP mirror image pain model ±SE)
*P<0.05,**P<0.01,與Native組相比,compared with Native group;△P<0.05,△△P<0.01,與Model組相比,compared with Model group
3 討論
關于鏡像痛機制的解釋,目前被廣泛接受的有三大主要假說,即體液學說、神經學說及膠質細胞學說。很多學者認為中樞敏化是產生鏡像痛的主要原因[6]。神經系統具有解剖學的對稱性,脊髓、下丘腦及大腦皮層等左右兩側存在中間連接[7],表明神經學說關于鏡像痛的中樞機制具有組織學基礎。起中間連接作用的中間神經元可能通過調節細胞的神經化學信號或電反應模式參與鏡像痛的發生和維持。近年來,中樞神經系統膠質細胞激活,通過縫隙連接、鈣波及促炎性因子的釋放3個途徑參與鏡像痛的發生的膠質細胞學說在鏡像痛發生機制中受到越來越多的關注[8-9]。
本實驗直接將復蘇后的S180肉瘤細胞通過肌肉注射接種至小鼠坐骨神經周圍,術后伴局部腫瘤增長,術側后足的機械痛閾值明顯降低,第4天以后穩定維持在較低水平;對側鏡像部位機械痛閾值變化類似于術側,程度較術側略低。研究結果證明小鼠在腫瘤進行性壓迫或浸潤坐骨神經引起CIP的同時也發生鏡像痛現象,并且L3-L5段脊髓內的Glu含量顯著升高,GABA含量顯著降低;大腦皮質內SP含量顯著增加、DynA1-13含量顯著降低。而上述神經化學物質含量及其比例關系的變化可能參與了CIP鏡像痛發生和維持的機制。
Glu是中樞神經系統內最主要的興奮性神經遞質,SP也是直接參與中樞敏化過程的重要神經遞質和調質。在損傷/疼痛狀態下,過量的Glu由初級傳入神經纖維末端釋放,激活脊髓背角神經元細胞膜上的NMDA受體,引起大量Ca2+內流,使神經元發生去極化,一方面增強傷害性感受器和脊髓疼痛傳遞神經元突觸聯系,產生痛覺過敏[10],另一方面囊泡膜與突觸前膜融合釋放SP,SP結合到突觸后膜的NK1受體,傳遞疼痛信息。在這一過程中產生正反饋作用,使突觸前膜釋放更多的神經化學物質,進一步增強神經元的興奮性,并由此形成鏈式反應。神經病理性疼痛及骨癌痛模型大鼠的脊髓、紋狀體細胞外液、腦脊液內等均發現Glu、SP含量顯著升高[11-13],表明這些變化參與術側的痛覺過敏機制。然而,這些神經遞質通過激活中間神經元的突觸后受體傳遞神經沖動,可跨越到脊髓對側[14],造成對側鏡像部位產生痛覺或痛敏,這是鏡像痛的重要中樞機制之一。Glu、SP等疼痛相關遞質還可以直接激活脊髓背角末端的膠質細胞(星形膠質細胞和小膠質細胞),通過使其活化釋放大量神經活性物質(興奮性氨基酸、前列腺素等)和促炎性細胞因子,以旁分泌的方式擴散并作用于對側脊髓背角,從而激活對側的膠質細胞和神經元[15]。有研究顯示,星形膠質細胞對Glu等信號反應為細胞內Ca2+升高,并通過縫隙連接將Ca2+波傳播到相鄰的細胞,最終可以到達脊髓損傷部位對側的膠質細胞[16],這可能是鈣波參與鏡像痛發生的機制和途徑。星形膠質細胞間的鈣波傳播亦能引起新突觸的形成,是長距離信號傳播的基礎[7]。除脊髓背角外,膠質細胞激活的現象也發生于高級中樞的多個層次,以丘腦和頂部皮層為最多。這種經Glu介導、以鈣波形式傳遞疼痛信息,致使對側膠質細胞和神經元活化的假說,在鏡像痛中樞機制中越來越受關注。
GABA是中樞神經系統中廣泛分布的最重要的抑制性神經遞質,GABA 能神經元在下行抑制系統起重要作用。內源性痛覺下行抑制系統中重要的核團中央導水管周圍灰質及延髓頭端腹內側區的神經末梢40%以上是 GABA 能的,投射神經元有50%的胞體和樹突接受GABA能的突觸聯系[17]。延髓頭端腹內側區向脊髓的投射神經元有50%接受GABA能的突觸后抑制[18]。癌侵襲鏡像痛脊髓中GABA減少,提示脊髓背角疼痛信號抑制性調控減少,使下行抑制和下行易化系統失衡,導致鏡像痛的發生,Glu/GABA的失衡是其標志之一。
強啡肽是內源性阿片肽的一種,是阿片κ受體激動劑,其中DynA1-13是強啡肽家族中主要活性片段之一。Dyn作為一種鎮痛介質被廣泛用于鎮痛效果的評價,但也有研究認為其參與炎癥痛及神經病理痛的痛敏過程[19]。脊髓中的強啡肽樣免疫活性物質在嗎啡內源性鎮痛系統中起下行鎮痛的作用。大腦皮質、邊緣皮質與許多疼痛密切相關的核團之間有直接或間接的往返投射,大腦皮質DynA1-13的降低,可能使內源性鎮痛系統下行抑制減弱、下行抑制和下行易化失衡;此外,DynA1-13可能還通過抑制脊髓后角C纖維末梢釋放SP而參與鏡像痛效應的機制。
加巴噴丁是電壓依賴性鈣通道α2δ亞單位配體,能有效緩解糖尿病疼痛性神經病變、帶狀皰疹后遺神經痛、脊髓損傷及幻象肢體疼痛引起的神經性疼痛[20-23]。其生物利用率高,不良反應小,極少和血漿蛋白結合,對肝藥酶無影響,臨床上聯合阿片類藥物用于治療癌痛有協同作用。在癌痛基礎研究中,單獨應用加巴噴丁亦能明顯提高脛骨轉移性癌痛模型大鼠的機械痛撤足閾值,改善疼痛[13],然而加巴噴丁對CIP鏡像痛的干預作用尚未見報道。本實驗結果表明,加巴噴丁不僅對小鼠術側CIP、而且對對側的鏡像痛均有明顯干預作用。關于加巴噴丁鎮痛機理的解釋,既往有拮抗NMDA受體、拮抗中樞神經系統鈣通道和抑制外周神經、增加 GABA 的合成及減少 GABA 的降解等。本研究發現加巴噴丁能顯著降低癌侵襲鏡像痛模型小鼠脊髓內Glu及大腦皮質內SP含量,顯著增加脊髓內GABA及大腦皮質內DynA1-13的含量,推測加巴噴丁可能通過抑制Glu、SP介導的神經元去極化、鈣波傳導,減少膠質細胞的活化,減少傷害性信息的中樞傳導;增加GABA、DynA1-13含量,促使下行抑制系統和下行易化系統平衡,加強內源性的鎮痛,從而發揮對癌侵襲鏡像痛的鎮痛作用。至于加巴噴丁抑制Glu、SP介導的膠質細胞活化的分子機制尚需進一步研究。
綜上所述,本文發現并報道了S180肉瘤細胞構建的CIP小鼠模型存在鏡像痛的現象,初步探討了脊髓內Glu、GABA,大腦皮質內SP、DynA1-13在癌癥侵襲鏡像痛中樞機制中的作用;發現了加巴噴丁對小鼠CIP鏡像痛具有鎮痛作用,并探討了其可能的機制。為CIP鏡像痛機制的深入研究提供了參考,也為加巴噴丁臨床治療CIP鏡像痛提供了一定的藥理學依據。
[1] Arguis MJ,Perez J,Martínez G,et al.Contralateral neuropathic pain following a surgical model of unilateral nerve injury in rats[J].Regional Anesthesia and Pain Medicine,2008,33(3):211-216.
[2] Bai ZT, Liu T, Jiang F,et al.Phenotypes and peripheral mechanisms underlying inflammatory pain-related behaviors induced by BmK I, a modulator of sodium channels [J].Exp Neurol,2010,226(1):159-172.
[3] Mao-Ying QL,Zhao J,Dong ZQ,et al.A rat model of bone cancer pain induced by intra-tibia inoculation of Walker 256 mammary gland carcinoma cells[J].Biochem Biophys Res Commun,2006,345(4):1292-1298.
[4] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessments of tactile allodynia in the rat paw [J].J Neurosci Methods,1994,53(1):55-63.
[5] 焦玥,王丹巧,吳兆恩,等.腦內灌流 6-羥基多巴胺對大鼠紋狀體細胞外液氨基酸類神經遞質的影響及美多芭的作用[J].中國藥理學通報,2009,25(8):1055-1059.
[6] Jaggi AS,Singh N.Role of different brain areas in peripheral nerve injury-induced neuropathic pain[J].Brain Res,2011,1381(24):187-201.
[7] Huang DY,Yu BW.The mirror image pain: an unclered phenomenon and its possible mechanism[J].Neurosci Biobehav Rev,2010,34(4):528-532.
[8] Obata H,Sakurazawa S,Kimura M,et al.Activation of astrocytes in the spinal cord contributes to the development of bilateral allodynia after peripheral nerve injury in rats[J].Brain Res,2010,1363(2):72-80.
[9] 李雪飛,許倩,劉建,等.鏡像痛的研究進展[J].醫學研究生學報,2013,26(2):198-201.
[10] Basbaum AI,Bautista DM,Scherrer G, et al.Cellular and Molecular Mechanisms of Pain[J].Cell,2009,139(2):267-284.
[11] Li CX,Yan LP,Yi JL,et al.Effects of electroacupuncture on the rats with neuropathic pain and EAAs in spinal cord[J].J Acupunct Tuina,2011,9(2):73-78.
[12] 李鵬,張美玉,王丹巧,等.青藤堿對SSNI模型大鼠鎮痛效應及腦內興奮性氨基酸遞質的影響[J].中國藥理學通報,2012,16(7):662-665.
[13] 張瑩,王志國,孫丹丹,等.加巴噴丁對骨癌痛模型大鼠的鎮痛作用及機制研究[J].中國生化藥物雜志,2014,34(3):8-15.
[14] Lundeberg T,Ekholm J.Pain-from periphery to brain[J].Disabil Rehabil,2002,24(8):402-406.
[15] Abbadie C,Bhanqoo S,De Koninck Y,et al.Chemokines and pain mechanisms[J].Brain Res Rev,2009,60(1):125-134.
[16] Hanani M,Huang YT,Cherkas PS,et al.Glial cell plasticity in sensory ganglia induced by nerve damage[J].Neuroscience,2002,114(2):279-283.
[17] Reichling DB,Bassbaum AI.Contribution of brainstem GABAergic circuitry to descending antinociceptive controls: I.GABA-immunoreactive projection neurons in the periaqueductal gray and nucleus raphe magnus[J].J Comp Neurol,1990,302(2):378-393.
[18] Cho HJ,Basbaum AI .GABAergic circuitry in the rostral ventral medulla of the rat and its relationship to descending antinociceptive controls [J].J Comp Neurol,1991,303(2):316-328.
[19] Yeomans DC,Jones T,Laurito CE,et al.Reversal of ongoing thermal hyperalgesia in mice by a recombinant herpesvirus that encodes human preproenkephalin[J].Mol Ther,2004,9(1):24-29.
[20] Finnerup NB,Otto M,McQuay HJ,et al.Algorithm for neuropathic pain treatment: an evidence based proposal[J].Pain,2005,118(3)289-305.
[21] Rice AS,Maton S.Gabapentin in postherpetic neuralgia: a randomised, double blind, placebo controlled study[J].Pain,2001,94(2):215-224.
[22] Tzellos TG,Papazisis G,Amaniti E,et al.Efficacy of pregabalin and gabapentin for neuropathic pain in spinal-cord injury: an evidence-based evaluation of the literature[J].Eur J Clin Pharmacol,2008,64(9):851-858.
[23] Serpell MG.Gabapentin in neuropathic pain syndromes: a randomised, double-blind, placebo-controlled trial [J].Pain,2002,99(3):557-566.
(編校:吳茜)
Roles of neurochemicals in central nerve system of mirror image pain in cancer invasion pain model and effects of gabapentin on them
SUN Dan-dan,WANG Zhi-guo,LI Tao,ZHAO Xiao-liang,JIAO Yue,LIU Yang,LI Yu-juan, OU YANG Jing-feng,NIU Xiao-hong,WANG Dan-qiaoΔ
(Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing Key Laboratory of TCM Basic Research on Prevention and Treatment of Major Diseases, Beijing 100700, China)
ObjectiveTo study the roles of neurochemicals as Glu, GABA in the spinal cord and SP, DynA1-13in the cerebral cortex of mirror image pain in cancer invasion pain model and the effects of gabapentin on them.MethodsMale BALB/c mices were randomly divided into native group, sham group (injected inactivated S180 sarcoma cell sap), model group (injected 0.2 mL of S180 sarcoma cell sap on the right leg near the greater trochanter of femur) and GBP group (intraperitoneally injected gabapentin 120 mg/kg on the basis of model mice).Mechanical withdraw threshold of the ipsilateral and contralateral hind paw were evaluated by Von Frey hairs before and after surgery.The levels of Glu and GABA in the L3-L5 spinal cord were measured by the high performance liquid chromatography-fluorescence detector (HPLC-FLD) and radioimmunoassay was used to detect the concentrations of SP and DynA1-13in the cerebral cortex.ResultsThe mechanical withdraw threshold of contralateral mirror sites in model mice appeared same trend and approximate degree of decline, following the generation of cancer invasion pain of ipsilateral hind paw.Compared with native group, the concentrations of Glu in the spinal cord and SP in the cerebral cortex in model group were significantly increased (P<0.05,P<0.01), and the levels of GABA in the spinal cord and Dyn A1-13in the cerebral cortex in model group were significantly decreased (P<0.05,P<0.01).Gabapentin could significantly increase the bilateral mechanical withdraw threshold of model mice and the analgesic effect could maintain to 240 min after administration (P<0.05 orP<0.01).Moreover, gabapentin could reverse the changes of above neurochemicals in the central nervous system of mirror image pain in cancer invasion pain model mice (P<0.01 orP<0.05).ConclusionThe mirror image pain phenomenon does exist in the cancer invasion pain model mice induced by S180 sarcoma.The mechanism of mirror image pain occurr and preserve in cancer invasion pain model may involve the changes of Glu, GABA in the spinal cord and SP, Dyn A1-13in the cerebral cortex, through which gabapentin can relieve mirror image pain in cancer invasion pain model.
mirror image pain; cancer invasion pain; gabapentin; neurochemicals
國家科技部國際科技合作專項(2010DFA31890);中國中醫科學院自主選題研究項目(ZZ2013003)
孫丹丹,女,碩士,研究方向:中藥藥理,E-mail:sdd900827@163.com;王丹巧,通訊作者,女,博士,研究員、博士生導師,研究方向:中藥藥理、中西醫結合老年醫學基礎研究,E-mail:dq_wang96@sohu.com。
R747
A
1005-1678(2015)03-0013-05

