不同沉淀方法對外源表達(dá)凝乳酶活性的影響
鄧培淵+郭紅玲+袁偉+李玉華


摘要:從粗提重組凝乳酶的得率、保存活性2個(gè)方面比較了乙醇沉淀法和硫酸銨沉淀法的差別。結(jié)果表明,相對于硫酸銨沉淀法,乙醇沉淀法獲得蛋白的量相差不是很大,但是乙醇沉淀法所獲得蛋白的單位效價(jià)是硫酸銨沉淀法的1.27倍,且乙醇沉淀法所得產(chǎn)物的比活性提高了16.78%。綜合考慮重組凝乳酶的得率與活性,用乙醇沉淀的效果較好。
關(guān)鍵詞:重組凝乳酶;活性;乙醇沉淀法;硫酸銨;鹽析
中圖分類號: Q814.1 文獻(xiàn)標(biāo)志碼: A
文章編號:1002-1302(2015)04-0050-03
收稿日期:2014-05-08
基金項(xiàng)目:河南省基礎(chǔ)與前沿技術(shù)研究計(jì)劃(編號:102300410146)。
作者簡介:鄧培淵(1981—),男,河南登封人,博士,講師,主要從事動物分子生物學(xué)研究。E-mail:zhzd201@hotmail.com。
凝乳酶原一般存在于反芻動物的第4胃中,在酸性條件下經(jīng)自我剪切形成有活性的凝乳酶。凝乳酶屬于酸性蛋白酶,主要功能是水解Κ-酪蛋白的Phe 105-Met 106鍵,在室溫以上并有Ca2+存在時(shí),可使蛋白質(zhì)凝聚成乳塊,因而在奶酪生產(chǎn)和改良中有重要的應(yīng)用價(jià)值[1]。目前,凝乳酶的替代品主要來源于動物凝乳酶、植物凝乳酶、微生物凝乳酶以及重組凝乳酶。常見的動物胃蛋白酶主要存在于幼豬[2]、小雞、金槍魚以及鯊魚中[3-5],但是這些動物的胃蛋白酶與小牛凝乳酶仍有所不同。在多種植物的不同部位中可以分離到使乳凝固的蛋白酶,即植物凝乳酶[6]。在合歡樹、無花果、新鮮木瓜中提取出的蛋白酶以及姜汁、檸檬汁等植物非蛋白酶均有較好的凝乳作用,因此具有廣闊的商業(yè)價(jià)值[7-10]。
微生物凝乳酶主要來源于細(xì)菌、放線菌和真菌,由于微生物凝乳酶具有耐熱性強(qiáng)、不易失活的特點(diǎn),在實(shí)際生產(chǎn)中需要進(jìn)一步調(diào)整工藝促使凝乳酶失活。研究發(fā)現(xiàn),基因工程凝乳酶同天然凝乳酶的性質(zhì)基本相同,利用基因工程生產(chǎn)的凝乳酶不僅純度高、產(chǎn)出的奶酪品質(zhì)好,而且易于工業(yè)化生產(chǎn),因此重組凝乳酶具有重要的實(shí)際應(yīng)用價(jià)值[11]。
要對外源表達(dá)的凝乳酶進(jìn)行分離純化,獲取有活性的目的產(chǎn)物,純化的第1步就是對發(fā)酵液進(jìn)行濃縮,在去除雜質(zhì)的同時(shí),可以獲取高活性的凝乳酶。目前粗提外源表達(dá)凝乳酶常用硫酸銨沉淀法或乙醇沉淀法,不同的粗提方法直接影響凝乳酶的活性和純化效果。本研究對外源表達(dá)重組凝乳酶的初步濃縮方法進(jìn)行比較分析,以期為工業(yè)化生產(chǎn)提供一定的理論基礎(chǔ)。
1 材料與方法
1.1 試驗(yàn)材料
試驗(yàn)材料為重組菌株km2,由筆者所在實(shí)驗(yàn)室構(gòu)建并保存。
1.2 培養(yǎng)基
100 mL YEPD培養(yǎng)基配方:1 g 酵母提取物,2 g 葡萄糖,2 g 蛋白胨,加去離子水至100 mL,于120 ℃滅菌30 min(固體培養(yǎng)基在此基礎(chǔ)上添加1.5%~2.0% 瓊脂)。
1.3 試驗(yàn)方法
1.3.1 粗酶液制備 挑取單菌落轉(zhuǎn)接于YEPD固體培養(yǎng)基上,于28 ℃培養(yǎng)28 h后,挑取單菌落接種于50mL種子培養(yǎng)基中,于28 ℃、250 r/min條件下培養(yǎng)20 h,以5%的接種量接種于95 mL發(fā)酵培養(yǎng)基中,再于28 ℃、180 r/min條件下培養(yǎng)約96 h,冷凍離心(4 ℃、8 000 r/min、15 min)后取上清,4 ℃冰箱保存?zhèn)溆谩?/p>
1.3.2 硫酸銨沉淀法 取6組500 mL粗酶液,分別加入硫酸銨至飽和度分別為10%、20%、40%、60%、80%、100%,混勻后于4 ℃過夜,4 ℃、8 000 r/min離心15 min,棄上清,將沉淀溶于0.05 mol/L、pH值為6.2的磷酸鹽緩沖液中,即得粗酶液。測定重組凝乳酶活力及蛋白含量,計(jì)算回收率。
1.3.3 乙醇沉淀法 取500 mL粗酶液,按不同體積比分別緩慢加入預(yù)冷乙醇中,4 ℃沉淀過夜,8 000 r/min離心 15 min,棄上清,將沉淀溶于0.05 mol/L、pH值為6.2的磷酸鹽緩沖液中,得到粗酶液;4 ℃沉淀2 h,8 000 r/min離心 15 min,棄上清,將沉淀溶于0.05 mol/L、pH值為6.2的磷酸鹽緩沖液中,得到粗酶液。測定重組凝乳酶活力及蛋白含量,計(jì)算回收率。
1.3.4 重組凝乳酶原十二烷基磺酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分析表達(dá)產(chǎn)物 以發(fā)酵培養(yǎng)基作為參照物,將硫酸銨沉淀、乙醇沉淀所得的粗酶液通過SDS-PAGE(12%)電泳檢測表達(dá)產(chǎn)物[12]。
1.3.5 凝乳酶活性測定方法 用1 mol/L H2SO4將粗酶液的pH值調(diào)整至2.0,室溫條件下放置2 h,然后用2 mol/L三羥甲基氨基甲烷(Tris)調(diào)上清液的pH值至6.0。采用Arima等的方法[12]進(jìn)行凝乳酶活力的測定,用0.01 mol/L CaCl2液配制10%脫脂乳,該溶液配制后在室溫放置40 min后使用,取2 mL 10%脫脂奶粉液于35 ℃保溫10 min。加1 mL稀釋的酶液(酶液于35 ℃保溫),搖勻并計(jì)時(shí),觀察到管壁上開始出現(xiàn)凝乳顆粒為終點(diǎn),記錄凝乳時(shí)間。在上述條件下,40 min凝結(jié)1 mL 10%脫脂奶粉的酶量定義為1個(gè)Soxhlet單位(SU)。
酶活力=供試乳數(shù)量÷凝乳酶量×D×2 400÷T。
式中:D為酶液稀釋倍數(shù);T為反應(yīng)時(shí)間,s。
凝乳酶回收率=沉淀液凝乳酶活性/粗酶液凝乳酶活性×100%。
1.3.6 凝乳酶蛋白含量測定方法 運(yùn)用BCA蛋白濃度測定試劑盒測定目的蛋白質(zhì)濃度。在堿性條件下,蛋白質(zhì)將Cu2+還原為Cu+,Cu+與BCA試劑形成紫色的絡(luò)合物,測定其在562 nm處的吸光度值D562 nm,并與標(biāo)準(zhǔn)曲線對比,即可計(jì)算待測蛋白的濃度。具體操作按照TaKaRa BCA Protein Assay Kit說明書進(jìn)行。
2 結(jié)果與分析
確定合適的沉淀方法是提高外源表達(dá)凝乳酶得率的關(guān)鍵步驟,為此本研究比較了乙醇和硫酸銨沉淀法對重組菌株外源表達(dá)凝乳酶的粗提效果。
2.1 硫酸銨沉淀和乙醇沉淀所得粗產(chǎn)物的比較
由表1可以看出,乙醇沉淀法與硫酸銨沉淀法相比,獲得的蛋白總量相差不是很大,乙醇沉淀法的得率為40.31%,高于硫酸銨沉淀法的得率36.93%,是1種更加有效的沉淀方法。
表1 2種沉淀法所得重組凝乳酶中的蛋白含量
方法 樣品 蛋白濃度
(mg/mL) 總體積
(mL) 蛋白總量
(mg)
硫酸銨沉淀 上清液(處理前) 0.87 450 391.5
沉淀物 4.82 30 144.6
乙醇沉淀 上清液 0.87 450 391.5
沉淀物(處理前) 5.26 30 157.8
注:蛋白得率=沉淀物中蛋白總量/上清液蛋白總量×100%。
2.2 硫酸銨沉淀法和乙醇沉淀法粗產(chǎn)物活性的比較
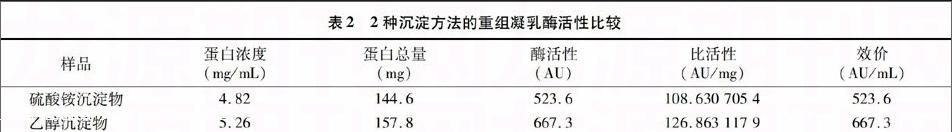
活性評價(jià)是純化方法的1個(gè)重要評價(jià)指標(biāo)。采用Arima等的方法進(jìn)行凝乳酶活的測定,重復(fù)3次并取3次重復(fù)的平均值,結(jié)果如表2所示。
表2 2種沉淀方法的重組凝乳酶活性比較
樣品 蛋白濃度
(mg/mL) 蛋白總量
(mg) 酶活性
(AU) 比活性
(AU/mg) 效價(jià)
(AU/mL)
硫酸銨沉淀物 4.82 144.6 523.6 108.630 705 4 523.6
乙醇沉淀物 5.26 157.8 667.3 126.863 117 9 667.3
表2結(jié)果表明,乙醇沉淀法所得粗產(chǎn)物的單位效價(jià)是硫酸銨沉淀法的1.27倍,且乙醇沉淀法所得產(chǎn)物的比活性提高了16.78%。可以看出,利用乙醇沉淀法可以避免硫酸銨沉淀法所帶來的鹽離子濃度高的影響,減少后續(xù)的純化工藝,是1種針對外源表達(dá)凝乳酶較理想的沉淀方法。
2.3 不同飽和度硫酸銨及乙醇對重組凝乳酶分離效果的影響
重組凝乳酶在胞外分泌表達(dá)中有許多蛋白分泌到胞外。去除雜蛋白是確定酶活性穩(wěn)定的要素。選用不同飽和度硫酸銨鹽析或乙醇沉淀發(fā)酵液,考察它們對重組凝乳酶回收率的影響,結(jié)果如圖1 所示。
圖1表明,不同飽和度硫酸銨對重組凝乳酶回收率影響較大。硫酸銨飽和度在20%~30%范圍內(nèi)時(shí),回收率變化不大;隨著硫酸銨飽和度增加,酶活回收率呈增大趨勢, 在80%
時(shí)重組凝乳酶活性回收率最高,達(dá)到86%;飽和度大于80%時(shí),酶活回收率迅速降低。
由圖2可知,在發(fā)酵液中乙醇含量在20%以內(nèi)時(shí),回收率變化不大;在20%~50%范圍內(nèi),隨著乙醇含量增加,回收率逐漸提高;在50%時(shí),回收率約為84%;超過50%時(shí),酶活回收率下降。
2.4 SDS-PAGE電泳分析比較硫酸銨和乙醇沉淀法
將重組菌株km2在發(fā)酵培養(yǎng)基中培養(yǎng)96 h后所得上清液用硫酸銨和乙醇沉淀并稀釋后,得到蛋白質(zhì)溶液,用pH值為2.0的HCl進(jìn)行酸化處理,通過SDS-PAGE電泳檢測,結(jié)果如圖3所示。
圖3表明,經(jīng)過酸化處理后,重組凝乳酶的蛋白分子量約36 ku。與發(fā)酵上清液相比,乙醇法沉淀物和硫酸銨法沉淀物均得到一定的濃縮,乙醇法沉淀后所得的蛋白含量略高于硫酸銨法沉淀。
3 結(jié)論
硫酸銨沉淀法是利用在高離子強(qiáng)度的溶液中,通過增加蛋白質(zhì)的疏水作用,使得蛋白質(zhì)趨于聚集,達(dá)到溶解極限使蛋白沉淀析出的目的。硫酸銨的性質(zhì)比較溫和,不容易引起蛋白的失活,能夠較大程度地保持蛋白的活性,是運(yùn)用最廣泛的沉淀方法[13]。利用基因重組法獲得總蛋白沉淀后需要經(jīng)純化才能得到目的蛋白,硫酸銨法沉淀過程中引入鹽離子,鹽析次數(shù)多[14],導(dǎo)致后續(xù)蛋白純化時(shí)增加了去鹽步驟,從而加大了目的蛋白的損失率,因此,乙醇沉淀法更適合基因工程產(chǎn)物的沉淀。
本研究利用乙醇沉淀法提取重組凝乳酶胞外表達(dá)產(chǎn)物,相對于硫酸銨沉淀法能夠更加有效地從發(fā)酵液中沉淀蛋白。以500 mL發(fā)酵液為例,利用乙醇沉淀法比硫酸銨沉淀法的得率提高了3.38百分點(diǎn),得到的重組凝乳酶粗產(chǎn)物的比活性提高了16.78%。可見乙醇沉淀法簡便高效,是1種針對重組凝乳酶粗提的合適、有效的沉淀方法。
參考文獻(xiàn):
[1]Visser S. Proteolytic enzymes and their relation to cheese ripening and flavor: an overview[J]. Journal of Dairy Science,1993,76(1):329-350.
[2]劉文宗,蔣 敏,何曉霞,等. 干酪凝乳酶代用品研究[J]. 四川畜牧獸醫(yī)學(xué)院學(xué)報(bào),2001,15(2):23-27.
[3]Tavares J F,Baptista J A,Marcone M F. Milk-coagulating enzymes of tuna fish waste as a rennet substitute[J]. International Journal of Food Sciences and Nutrition,1997,48(3):169-176.
[4]苑艷輝. 水產(chǎn)品下腳料綜合利用研究之進(jìn)展[J]. 水產(chǎn)科技情報(bào),2004,31(1):44-48.
[5]Haard N F. A review of proteotlytic enzymes from marine organisms and their application in the food industry[J]. Journal of Aquatic Food Product Technology,1992,1(1):17-35.
[6]顧瑞霞,申 戈. 凝乳酶及其代用品[J]. 中國乳品工業(yè),1991(1):20-23.
[7]薛彥斌. 樹木凝乳酶的研究與應(yīng)用[J]. 中國乳品工業(yè),1990(3):130-132.
[8]張富新,楊寶進(jìn). 植物凝乳酶凝乳特性的研究[J]. 黃牛雜志,1997(1):27-29.
[9]宋 云,李立釗,崔雅潔,等. 不同因素對凝乳酸活力的影響[J]. 中國乳品工業(yè),1995,23(3):124-128.
[10]張富新,田呈瑞. 木瓜蛋白酶凝乳特性的研究[J]. 西北農(nóng)業(yè)大學(xué)學(xué)報(bào),1997,25(2):111-114.
[11]高維東,甘伯中,丁福軍,等. 微生物凝乳酶的研究進(jìn)展[J]. 中國乳品工業(yè),2009,37(5):34-36,47.
[12]Arima K,Yu J,Iwasaki S. Methods in enzymology[M]. New York and London:Academic Press,1970:446-459.
[13]Saavedra L,Castellano P, Sesma F. Purification of bacteriocins produced by lactic acid bacteria[J]. Methods Mol Biol, 2004,268:331-336.
[14]Siegelman H W, Kycia J H. Algal biliproteins: handbook of phycological method[M]. Cambridge: Cambridge University Press,1978:71-79.

