葫蘆小孢子發育時期與花器形態相關性
胡雪丹, 張 曼, 侯 茜, 徐錦華, 劉 廣, 姚協豐, 李蘋芳, 陳學好,羊杏平
(1.江蘇省農業科學院蔬菜研究所,江蘇 南京 210014;2.揚州大學園藝與植物保護學院,江蘇 揚州 225000)
葫蘆小孢子發育時期與花器形態相關性
胡雪丹1,2, 張 曼1, 侯 茜1, 徐錦華1, 劉 廣1, 姚協豐1, 李蘋芳1, 陳學好2,羊杏平1
(1.江蘇省農業科學院蔬菜研究所,江蘇 南京 210014;2.揚州大學園藝與植物保護學院,江蘇 揚州 225000)
為了能夠快速準確判斷葫蘆小孢子發育時期,通過對葫蘆花器外觀形態與花藥顯微結構的觀察,并將其與小孢子發育時期進行聯系。結果顯示:葫蘆小孢子經過四分體時期、單核期和二核期后發育成成熟花粉粒;在頂芽生長點肉眼可辨別花芽和葉芽的1 d和2 d時,在6.3~6.7 mm的花蕾中,小孢子多處于單核期,此時葫蘆花雄蕊的花粉管干癟較適合花藥、小孢子培養;發育到第3 d、4 d時,花粉管較飽滿,此時基本為發育成熟的花粉粒。表明可以根據葫蘆花蕾的形態、大小及小孢子的發育時期,確定花藥、小孢子培養最佳時期所對應的選蕾標準。
葫蘆;小孢子;發育時期;花器形態
葫蘆為葫蘆科(Cucurbitaceae)葫蘆屬,一年生攀援草本植物。學名[Lagenaria siceraria(Molina)Standl.],又名瓠瓜、瓠子、扁蒲、蒲瓜、夜開花等[1]。葫蘆是適宜嫁接的優良砧木,葫蘆科植物的常規遺傳育種方法育種周期長、難度大和遺傳性狀不穩定。單倍體育種技術為縮短育種年限、提高育種效率提供了可能,但在葫蘆科蔬菜作物中,自發產生單倍體的頻率極低[2]。為了獲得單倍體,研究者嘗試通過離體雄核發育途徑(花藥或小孢子培養)、雌核發育途徑(未授粉子房或胚珠離體培養、外源化學藥劑、正常花粉或輻射過的花粉授粉誘導的孤雌生殖)等手段誘導單倍體[3]。近年來,花藥培養和游離小孢子培養技術的不斷成熟,為單倍體離體培養的應用帶來了曙光。在花藥培養或小孢子培養時,花粉發育時期的選擇是影響離體誘導單倍體成功的重要因素之一。不同植物種類誘導愈傷組織形成和胚狀體發生的適宜小孢子發育時期是不同的,多數物種誘導胚胎發生的最佳小孢子發育時期是單核靠邊期[2-7]。許多研究結果表明小孢子發育時期與花器外部形態密切相關,可以依據花器形態特征,特別是花蕾的大小,即可判斷植物小孢子發育時期[8-11]。為此,通過對葫蘆小孢子配子體發育時期的細胞學觀察,找出小孢子各發育時期對應的花器與花藥外觀形態,研究其相關性,為葫蘆小孢子發育時期的鑒定奠定基礎。
1 材料與方法
1.1材料
供試葫蘆品種為相生FMT,由江蘇省農業科學院蔬菜研究所瓜類研究室提供,于2014年10月播種,11月定植于溫室,常規管理。
1.2 方法
1.2.1 花蕾形態觀察與測量 從葫蘆植株頂端花芽與葉芽肉眼可辨認第1 d開始為觀察期,每天13∶00點選擇15朵大小相等的花蕾做標記,并每天用毫米尺測量記錄長度。取樣時間是15∶00—17∶00,用鑷子按生長天數取葫蘆花蕾放入自封口塑料袋內,用冰盒帶回實驗室。用游標卡尺測量花蕾縱徑,然后用鑷子剝去萼片、花瓣,取出花藥,進行觀察拍照。
取生長了1~16 d的花蕾兩組,將樣品去萼片、花瓣,置于0.1 mol/L磷酸緩沖液配制的2.5%的戊二醛溶液中抽真空固定后4℃過夜,處理好的樣品在EVO-LS10掃描電子顯微鏡下觀察并拍照。
1.2.2 小孢子發育過程觀察 本研究參考錢春桃等[12]方法進行染色體制片,并進行改良,較適于對不同發育時期的小孢子進行觀察。采集1 d到6 d的花蕾樣品,用改良卡諾液(1體積無水酒精 ∶3體積冰醋酸)固定24 h,用75%的酒精保存在4℃冰箱中備用。
用鑷子輕輕夾取少許花藥置于載玻片,并擠壓出花粉母細胞,去除雜質,用醋酸洋紅染色和卡寶染色液染色,采用火焰微烤和45% 醋酸分色制片,使用Olympus(BX-51)顯微鏡觀察并拍照。
2 結果與分析
2.1 葫蘆花蕾形態觀察
從第一批葫蘆花蕾肉眼可辨直至第一批花蕾開花后,統計花蕾每天的生長值(表1),選取相對應大小的花蕾及剝去花萼、花瓣后的花藥取樣拍照(圖1)。花蕾生長值記錄從第1 d標記到開花,歷時16 d;取樣從第1 d標記到花敗,歷時18 d。

表1 葫蘆花蕾各時期生長值Table 1 The grow th values of the groud buds
表1可知,花蕾在前期(第1~13 d)生長勢較緩慢,待到14 d與15 d時生長迅速,開花前一天生長值是開花前兩天生長值的3倍。由圖1可見,在觀察期第1 d,花蕾緊貼葉腋處皺縮,著生濃密白色絨毛的萼片將花冠緊緊包裹,去花瓣與萼片后,花藥相對小且干癟,整體呈深綠色。發育第2 d、3 d后,花蕾與花藥均漸大并相對飽滿,深綠色變淺,萼片開始展開。隨著發育進程的推進,花蕾似鐘形均勻緩慢生長,花萼逐漸開展,花冠長勢超過花萼,花蕾與花藥顏色由深綠色經過淺綠色、黃色,最終變成白色,并準備開放。
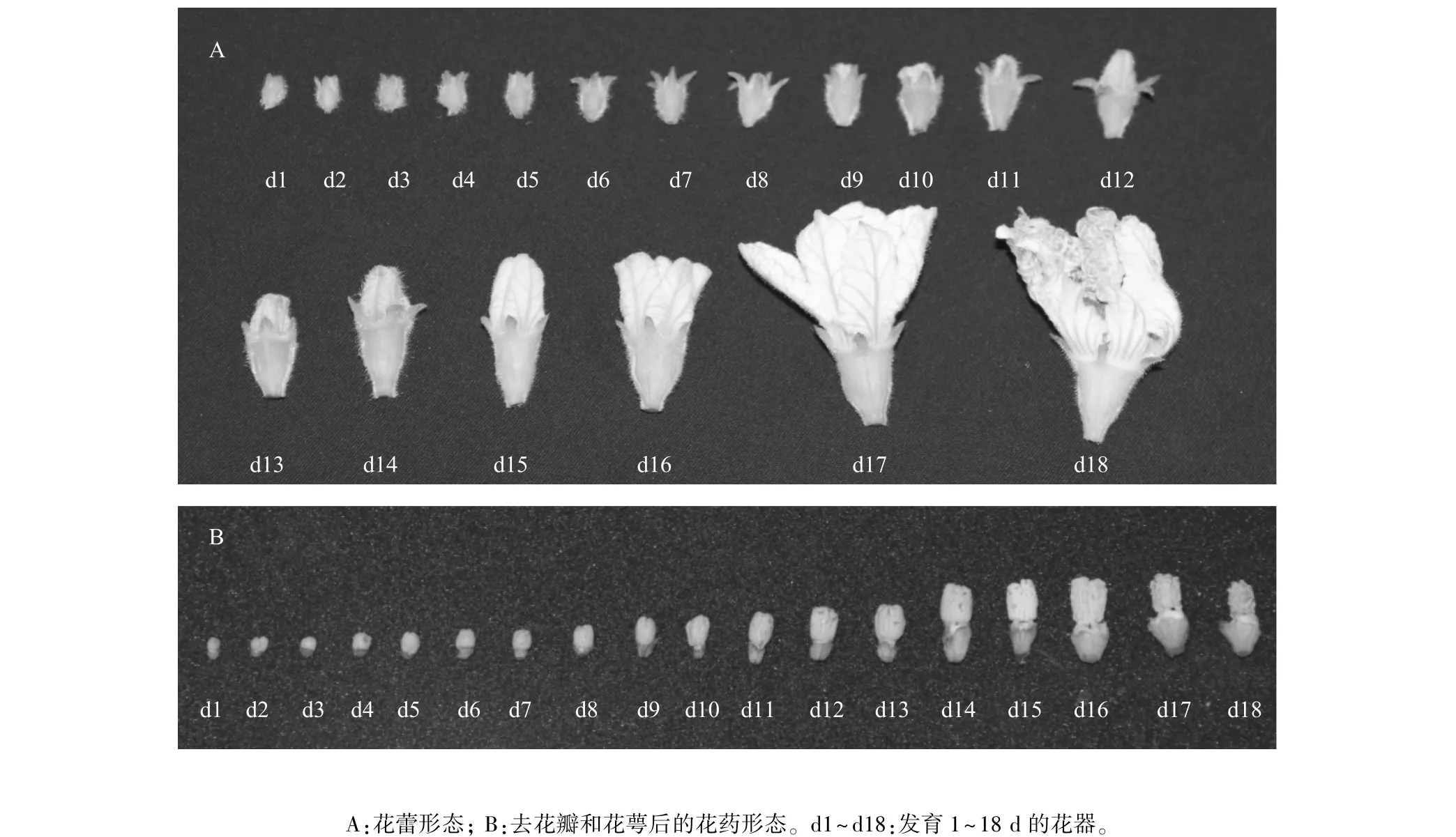
圖1 葫蘆各時期花器形態Fig.1 Gourd bud morphology at each developmental phase
2.2 葫蘆花藥發育過程
葫蘆花是單性花,通過掃描電鏡的觀察,葫蘆花為雄蕊之間花絲部分合生在一起,雄蕊群通過花絲合生成3個單體,花藥相互分離,形成一個球體狀的聚藥雄蕊(圖2A、圖2B)。葫蘆科部分植物為雄蕊5個,這3個單體是5個雄蕊通過兩兩合生、另一個離生而形成的三體雄蕊[13]。通過顯微掃描可以觀察到葫蘆花雄蕊確實是由3個單體組成,其中合生的兩個單體(圖2C)體積明顯比離生的單體(圖2D)大一倍。3個單體緊密簇生形成不規則的球體,花藥呈管狀環繞,位于合生花絲形成的肉質聯合體頂端(圖2A、圖2B)。
在花芽與葉芽可以肉眼分辨后1 d或2 d,葫蘆花雄蕊的花粉管干癟,發育3 d或4 d后花粉管逐漸飽滿,花藥表皮有一條明顯的淺溝(圖2E),隨著發育,淺溝加深,其他方面沒有明顯差異。發育至第14 d時,花瓣從青色轉為白色,花藥的淺溝開始開裂。花藥成熟后,花蕾開放時,花藥在淺溝處縱裂,花粉粒沿裂縫散出,布滿花粉管外圍(圖 2F、圖2G)。發育到第18 d時,花蕾開敗,花粉粒從著生處散落,僅留下開裂的花粉管(圖2H)。
2.3 葫蘆小孢子配子體的發育途徑
成熟小孢子的發育途徑為:四分體時期-單核小孢子早期-單核小孢子中期-單核靠邊期-二細胞花粉早期-二細胞花粉中期-二細胞花粉晚期-成熟花粉時期(圖3)。
經細胞學染色結果顯示:在葫蘆品種相生FMT發育1 d的樣品中(圖1),花蕾大小小于5.9 mm時小孢子還處于母細胞或者更前期;花蕾大小在5.9~6.2mm時,小孢子基本處于四分體時期(圖3A);在發育2 d的樣品中(圖1),花蕾大小在6.3~6.7 mm時,小孢子基本處于單核期,此時胼胝質破裂,小孢子從四分體中釋放出來(圖3B),隨著大液泡的形成,細胞內細胞核從細胞中央被擠向細胞壁較厚的一側,即從小孢子單核早期經過單核中期進入單核靠邊期(圖3C~圖3E);在發育2~3 d的樣品中(圖1),花蕾大小在6.8~7.2 mm時小孢子基本處于二細胞期(圖3F~圖3H),可以看到第1次有絲分裂前后的多種狀態:其中一部分觀察不到染色的細胞核此時期為小孢子進入了第1次有絲分裂的間期,大部分為已經完成第1次有絲分裂具有1個營養細胞和1個生殖細胞的二核期小孢子。營養細胞的體積大,靠近大液泡,生殖細胞體積小,貼近花粉壁。隨著小孢子繼續發育,生殖核會向細胞的中央遷移,從二細胞早期進入二細胞晚期。在大于7.2 mm的大花蕾中,大部分小孢子體積顯著變大變圓,可以看到擁有3個萌發孔和三股溝的成熟花粉粒(圖3I)。
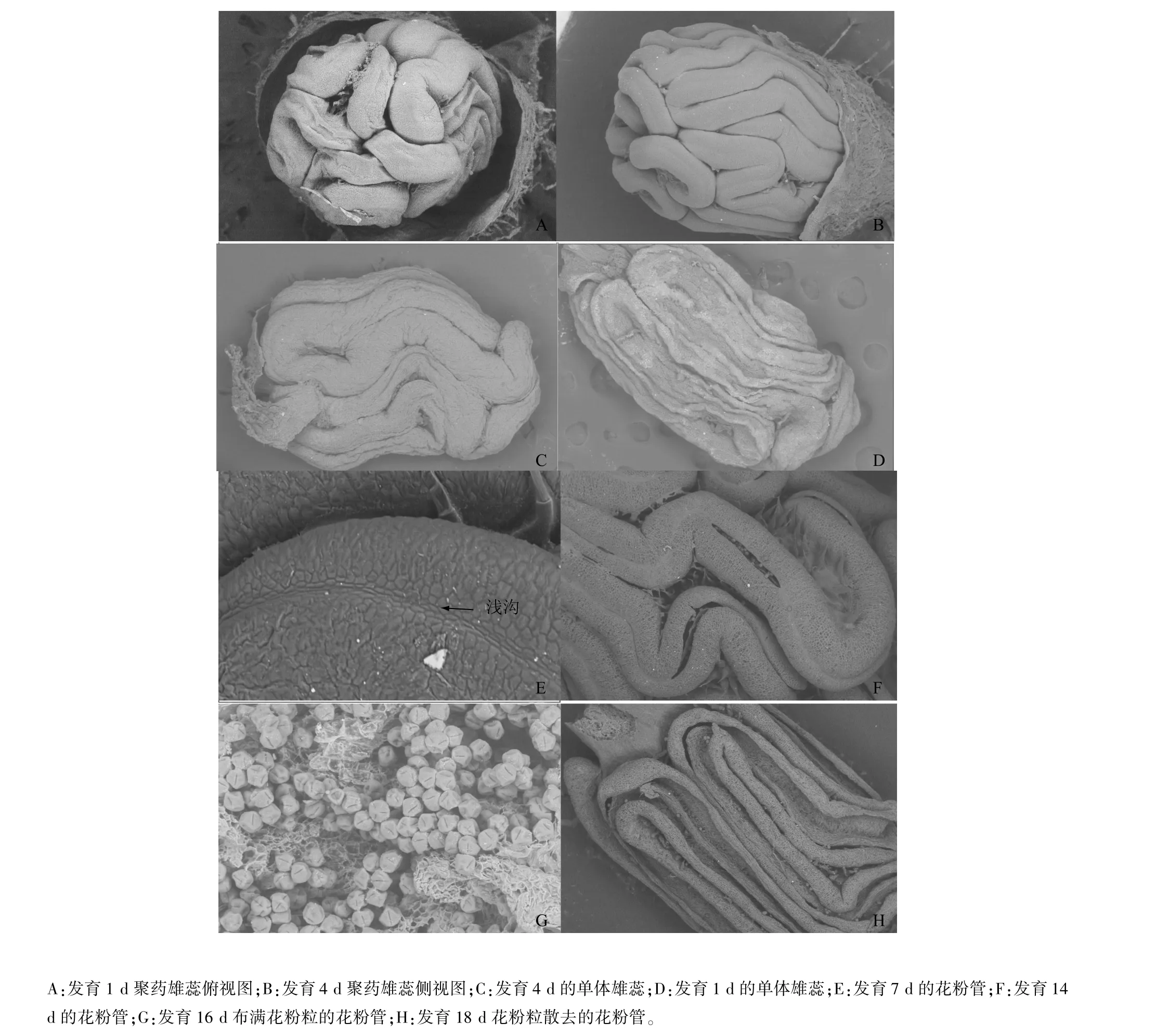
圖2 花藥發育結構圖Fig.2 Anther developmental structure
2.4 相關性分析
2.4.1 小孢子發育時期與花器形態相關性分析花蕾大小在6.3~6.7 mm時,小孢子基本處于單核期,而在葫蘆植株頂芽生長點處肉眼可辨花芽與葉芽后1 d的花蕾,其大小為5.5~6.5mm;發育到第2 d時,花蕾長度為6.0~7.0 mm。經觀察統計,花蕾大小在5.9~6.2 mm時,小孢子基本處于四分體時期;花蕾大小在6.3~6.7 mm時,小孢子基本處于單核期;花蕾大小在6.8~7.2 mm時,小孢子基本處于二細胞期。此時花蕾緊貼葉腋處皺縮著,著生濃密白色絨毛的萼片將花冠包裹,花瓣未露出花萼;去花瓣與萼片后,花藥相對小且干癟,整體呈深綠色。所以后期花藥與小孢子培養所需的小孢子單核靠邊期取樣時,應在可辨花芽與葉芽后發育1~2 d的花蕾中挑選大小為6.3~6.7 mm的花蕾用于培養。
2.4.2 小孢子發育時期與花藥結構相關性分析
在觀察1 d、2 d時,掃描電鏡下葫蘆花蕾的合生花絲皺縮,外圍環繞的花粉管干癟有皺褶(圖2A和圖2C),對應了葫蘆花器觀察期1 d、2 d時外觀形態不飽滿,此時葫蘆小孢子多處于四分體到二核期。發育3 d、4 d后,小孢子逐漸發育成飽滿的成熟花粉粒,花粉管也趨于飽滿,花藥表皮有一條不明顯淺溝,隨著發育,淺溝加深(圖2E、圖2F)直至后期開裂散出成熟花粉。
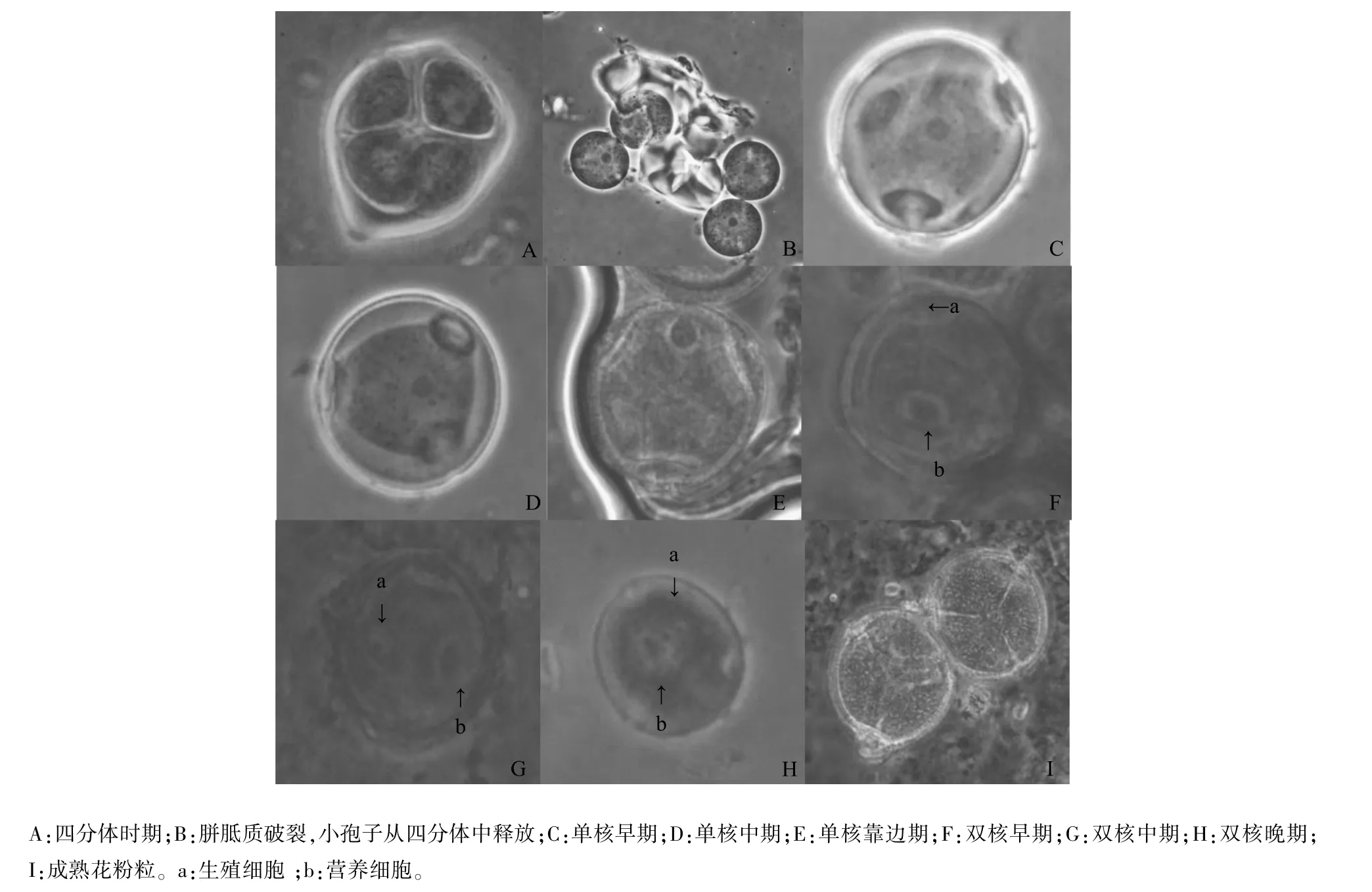
圖3 葫蘆小孢子各發育階段的細胞學特征(×400)Fig.3 M orphological characteristics at each developmental stage of gourd m icrospore(×400)
3 討論
隨著單倍體育種技術的不斷成熟,花藥培養和小孢子培養的優勢日漸體現,在葫蘆花藥和小孢子培養誘導單倍體的過程中,確定小孢子發育時期與花蕾外部形態特征的對應關系對于花藥培養成功與否起著決定性的作用。通過對花粉染色制片觀察小孢子雄配子發育途徑細胞學特征,與其對應的花器外觀和花藥形態的相關性,得出結論:葫蘆小孢子雄配子體發育經歷四分體時期、單核期和二核期后發育成為成熟花粉粒;在葫蘆植株頂芽生長點肉眼可辨別花芽和葉芽的1 d、2 d時,大小為6.3~6.7 mm的不飽滿花蕾適宜做培養材料,此時花粉管干癟,花器整體呈深綠色。在植物花藥或小孢子培養過程中,取材時期對于培養成功與否起著決定性的作用。本試驗為鑒定小孢子發育時期,快速找到小孢子單核期提供了簡易的方法。
[1] 朱德蔚,王德檳,李錫香.中國作物及其野生近緣植物-蔬菜作物卷[M].北京:中國農業出版社,2008.
[2] SAVIN F,DECOMBLEV,LECOUVIOURM,etal.The X-ray detection of haploid embryos arisen in muskmelonCucumismelonL.seeds and resulting from a parthenogenetic development induced by irradiated pollen[J].Cucurbit Genet Coop,1988,11:39-42.
[3] 雷 春,陳勁楓.葫蘆科蔬菜作物單倍體材料創制的研究進展[J].中國蔬菜,2006(1):33-36.
[4] 詹 艷,陳勁楓,AHMED A M.黃瓜游離小孢子培養誘導成胚和植株再生[J].園藝學報,2009,6(2):221-226.
[5] 王薇薇,羊杏平,范淑英,等.甜瓜小孢子發育時期與花器形態關系研究[J].西北農林科技大學學報:自然科學版,2015,43(4):108-111.
[6] 緱艷霞,張明方.西瓜花藥離體培養影響因子研究[J].北方園藝,2010(10):117-120.
[7] 李 娟.西瓜花藥和小孢子培養研究[D].成都:四川農業大學,2008.
[8] 謝 淼,秦麗穎,潘俊松,等.黃瓜花器形態發生、小孢子發育與花藥培養[J].西北植物學報,2005,25(6):1096-1100.
[9] 張菊平,鞏振輝,劉珂珂,等.辣椒小孢子發育時期與花器形態的相關性[J].西北農林大學學報:自然科學版,2007,35(3):153-158.
[10]林宗鏗,張天翔,楊俊杰,等.白蘆筍小孢子發育時期與花器形態相關性研究[J].中國農學通報,2011,27(28):200-204.
[11]楊宏光,孫曉梅,王孝鵬,等.三色堇小孢子發育時期與花器形態相關性分析[J].沈陽農業大學學報,2008,39(5):621-624.
[12]錢春桃,陳勁楓,婁群峰,等.黃瓜花粉母細胞減數分裂行為的研究[J].武漢植物學研究,2003,21(3):193-197.
[13]任明迅.植物雄蕊合生的多樣性、適應意義及分類學意義初探[J].植物分類學報,2008,46(4):452-466.
(責任編輯:袁 偉)
Relationship between m icrospore development period and flower organ morphology of bottle gourd(Lagenaria siceraria)
HU Xue-dan1,2, ZHANG Man1, HOU Qian1, XU Jin-hua1, LIU Guang1, YAO Xie-feng1, LIPing-fang1,CHEN Xue-hao2, YANG Xing-ping1
(1.Institute of Vegetable,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,China;2.College ofHorticulture and Plant Protection,Yangzhou University,Yangzhou 225009,China)
Researches on the relationship between the gourdmicrospore developmentand flower organmorphologywere carried out to find a way to identify the microspore developmental period quickly and acccurately through observing bottle gourd flower appearance and anthermicrostructure.The results showed thatbottle gourdmicrosporewent through tetrad stage,uninucleate stage,binucleate stage,and finally developed to themature pollen grain.In the growth of plant bud,the flower bud and leaf bud could be differentiated in the first one or two days.The bud size in 6.3-6.7mm weremostly at the uninucleate stage ofmicrospore.At thismoment,the staminal tubeswere shrivelled and suitable for anther andmicrospore culture.In the 3rd or 4th day,the tubes were full,and themicrospore had basically grown intomature pollen grain.The develpoment period of gourd microspore could be determined by themorphology and size of the buds,which helps to define the standard of bud selection corresponding to the optimal stage of anther and microspore culture.
gourd;microspore;developmental stage;flower organ morphology
S642.9
A
1000-4440(2015)06-1407-06
胡雪丹,張 曼,侯 茜,等.葫蘆小孢子發育時期與花器形態相關性[J].江蘇農業學報,2015,31(6):1407-1412.
10.3969/j.issn.1000-4440.2015.06.033
2015-05-25
國家西甜瓜產業技術體系項目(CARS-NO.8);江蘇省農業科技支撐計劃項目(BE2012323)
胡雪丹(1990-),女,江蘇泰州人,碩士研究生,研究方向為葫蘆游離小孢子培養。(E-mail)276518157@qq.com
羊杏平,(E-mail)xingping@jaas.ac.cn

