不同標態下標準電極電勢間關系的熱力學解釋*
基金資助:國家基礎科學人才培養基金(No.J1103306);南開大學2012年教育教學改革項目
章應輝
(南開大學化學系 天津 300071)
不同標態下標準電極電勢間關系的熱力學解釋*
*基金資助:國家基礎科學人才培養基金(No.J1103306);南開大學2012年教育教學改革項目
章應輝
(南開大學化學系天津 300071)
摘要利用標準吉布斯自由能變化與標準電極電勢和標準反應平衡常數間的聯系,分析不同標態下電極標準電極電勢間的關系。根據這一思想,以水解離平衡為例,討論了設計原電池求化學反應平衡常數的一般方法。
關鍵詞標準吉布斯自由能變化標準電極電勢化學平衡常數
The Thermodynamic Explanation of the Relationship between the
Standard Electrode Potentials in Different Standard States*
Zhang Yinghui
(ChemistryDepartment,NankaiUniversity,Tianjin300071,China)
AbstractBased on the relationship between the standard Gibbs free energy change, the standard electrode potential and the standard reaction equilibrium constant, the relationship between standard electrode potentials in different standard states has been analyzed. Accordingly, the general method to calculate the reaction equilibrium constant by designing a Galvanic battery is discussed, taking the dissociation equilibrium of water as an example.
Key WordsStandard Gibbs free energy change; Standard electrode potential; Reaction equilibrium constant
1介紹
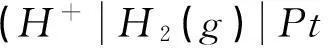
(1)
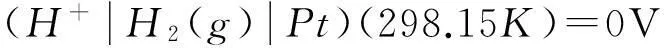
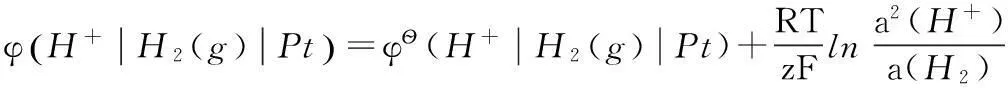
堿性條件下氫電極反應方程式為:
(2)
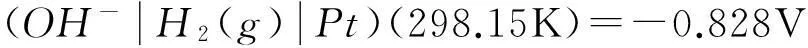
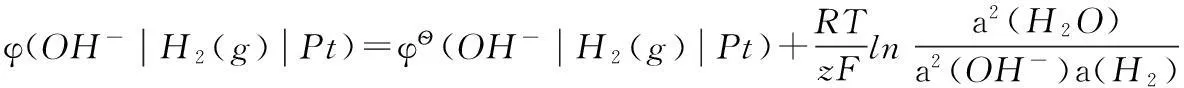
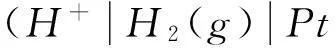
堿性條件氫離子還原為氫分子的電極電勢可以寫為:
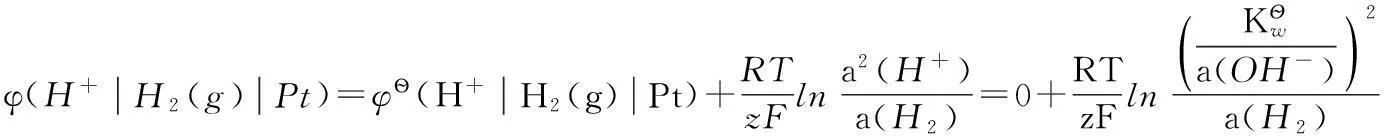
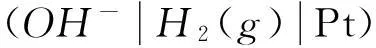
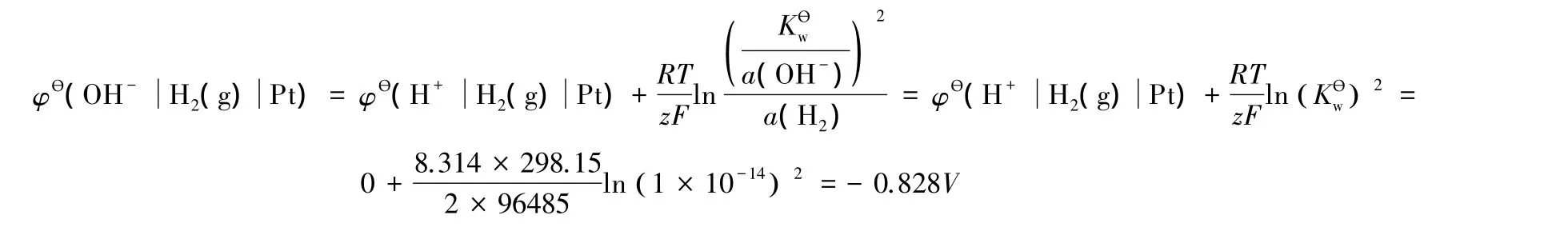
這種方法對標準電極電勢的定義比較明確,但在實際教學過程中,發現學生對該方法的理解不夠深入,不能夠加以靈活運用。比如在選擇電極構筑原電池求某反應的平衡常數時(如水的解離常數、難溶鹽的活度積和絡合物的解離常數等),不知如何入手。我們在實際教學中,考慮到熱力學函數與電極電勢間的緊密聯系[3-5],從熱力學角度對不同標準態下電極電勢的關系予以說明,推出了不同標準狀態下電極電勢間關系的數學表達式。這些表達式中含有標準態定義物質(分子或離子)參與的化學反應的平衡常數,明確了電極電勢與化學平衡常數的關系。熱力學方法的應用有效地提高了學生對于電極電勢與化學平衡常數間關系的理解。下面我們以3對典型的電極反應為例來加以說明。
2熱力學方法解釋不同標準態下電極電勢間的關系
2.1 φ?)與φ?的關系
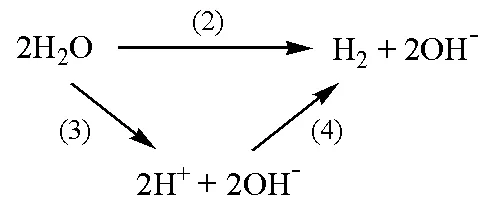
其中反應(3)有:
借助相同的參比電極,反應(4)有:
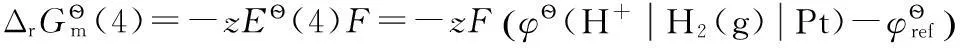
根據熱力學原理:
即:
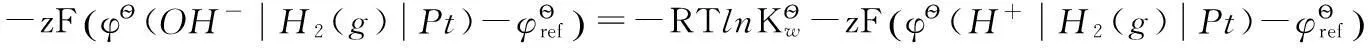
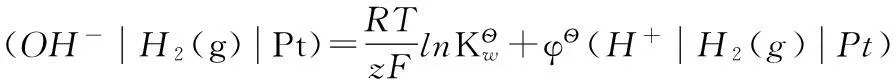
這樣推理,學生就很容易理解。
2.2 φ?與φ?電極電勢間的關系
這兩個電極電勢分別以Ag+和Cl-為標態定義物質,其電極反應分別為:
(5)
(6)
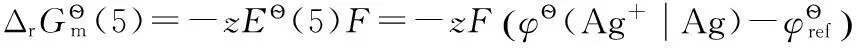
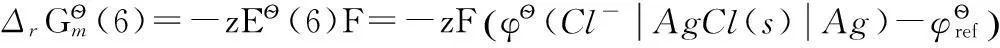
電極反應(6)可以看做是下列兩步反應(7)和(8)的組合:
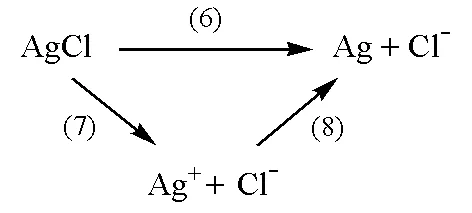
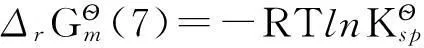
即:
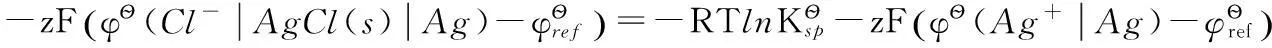
由此可推出:

2.3 φ?與φ?的關系
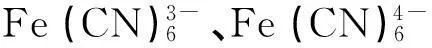
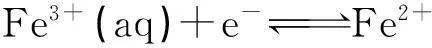
(9)
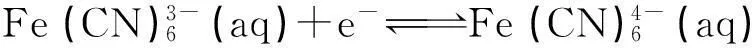
(10)
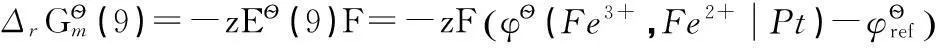
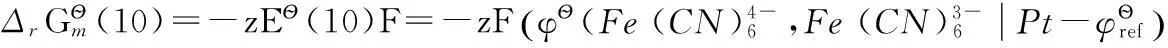
對于電極反應(10),可以將其拆分為以下3步反應:
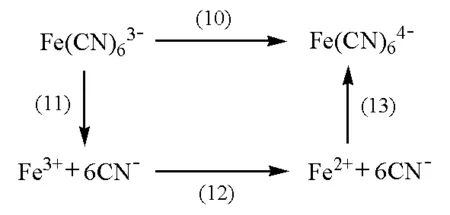
其中反應(12)即為反應(9)。
同樣有:
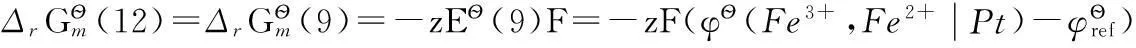
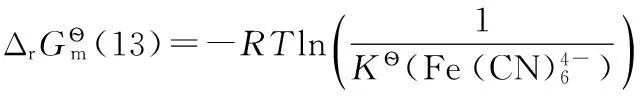
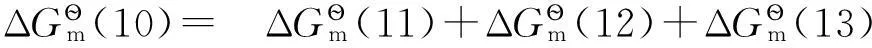
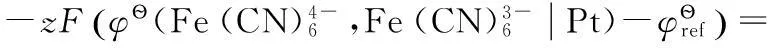
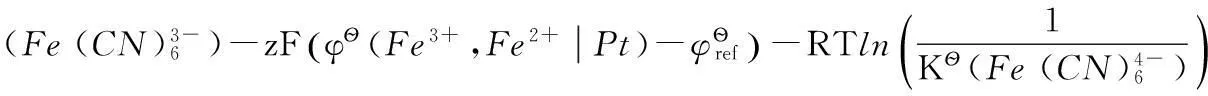
所以有:
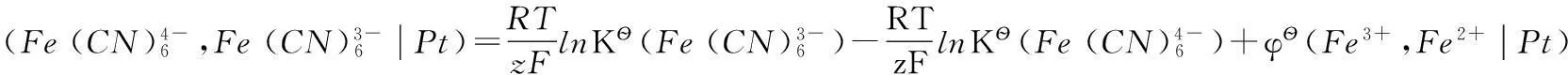
3熱力學方法的優點及其應用
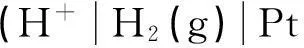
這樣看來,求水的解離平衡常數的原電池電極選擇不是唯一的,只要某電極反應既可以在酸性條件下進行(即以H+為標準態定義物質),又可以在堿性條件下進行(即以OH-為標準態定義物質),就可以用來構建原電池,求水的解離平衡常數。下面給出了3種電極選擇方法(實際方法應該更多)。
方法一在水解離平衡方程兩邊添加H2:
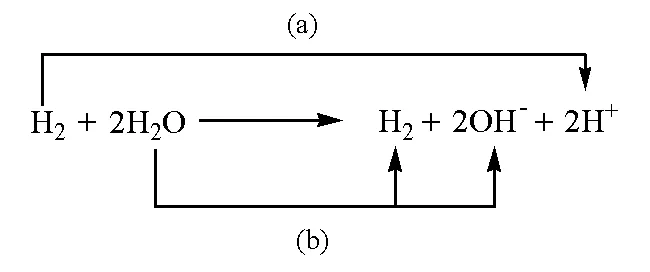

方法二在水解離平衡方程兩邊添加O2:
除了氫的價態變化外,也可以考慮通過酸性和堿性條件下氧的價態變化來求水的解離平衡常數。例如在水解離反應兩邊添加氧分子,得到:
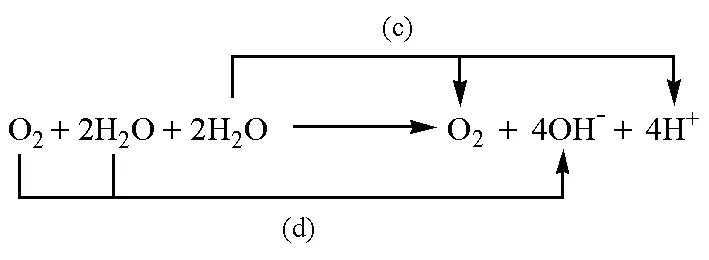
按照箭頭,可以將該反應分解為以下兩個電極反應:
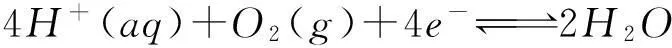
(c)
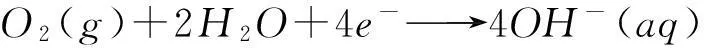
(d)
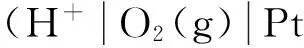
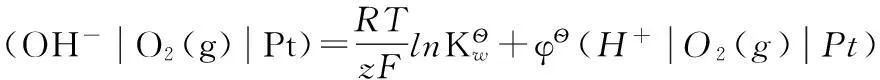
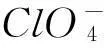
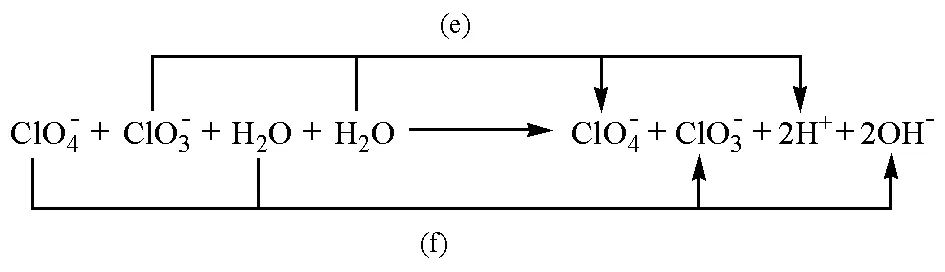
按照箭頭,可以將該反應分解為以下兩個電極反應:
(e)
(f)
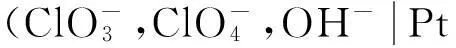
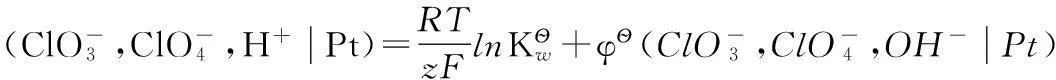
參考文獻
[1]胡英.物理化學(下).第4版.北京:高等教育出版社,1999
[2]劉國杰,黑恩成.物理化學導讀.北京:科學出版社,2008
[3]朱伯仲,高霞,宋連卿.河南教育學院學報(自然科學版),2005(14):41
[4]張引莉,范廣,孫家娟.廣州化工,2011,39:180
[5]覃松,王碧,阮尚全.內江師范學院學報,2000(4):35
[6]朱志昂,阮文娟.物理化學.第5版.北京:科學出版社,2014
中圖分類號O6;G64
doi:10.3866/pku.DXHX20150366

