鉤枝藤生物堿對斜紋夜蛾幼蟲的毒殺活性
王軍等
摘 要 探討鉤枝藤總生物堿及3個單體化合物[(1)Ancistrocline,(2)5′-O-demethylhamatintine,(3)N-methylphylline]對斜紋夜蛾幼蟲的毒殺活性,旨在開發新型植物源農藥。采用浸蟲法測定鉤枝藤總堿對斜紋夜蛾3齡幼蟲的毒殺活性和采用飼料混毒法測定鉤枝藤單體化合物對斜紋夜蛾初孵幼蟲毒殺活性。結果表明:鉤枝藤總堿對斜紋夜蛾3齡幼蟲具有較強的毒殺作用,其第3天和第5天的LC50值分別為2.61 mg/mL和0.91 mg/mL。單體化合物對斜紋夜蛾初孵幼蟲具有明顯的抑制生長發育作用,其中以化合物(2)抑制作用最強,主要表現為化蛹率(23.33%)、羽化率(13.33%)顯著低于對照(化蛹率90.00%、羽化率86.67%)。
關鍵詞 鉤枝藤;生物堿;斜紋夜蛾;毒殺活性;抑制生長發育
中圖分類號 S481.1 文獻標識碼 A
Insecticidal Activity of the Alkaloids from Ancistrocladus
tectorius Against the Larvae of Spodoptera litura
WANG Jun1, YAN Chao2, CAI Caihong1, FENG Gang2, ZHANG Jing2 *, DAI Haofu1 *
1 Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory
of Biology and Genetic Resources of Tropical Crops, Ministry of Agriculture / Hainan Key Laboratory for Research
and Development of Natural Products from Li Folk Medicine, Haikou, Hainan 571101, China
2 Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract The insecticidal activity of the total alkaloids and its 3 compounds[(1): Ancistrocline,(2): 5′-O-demethylhamatintine,(3): N-methylphylline]of Ancistrocladus tectorius against the larvae of Spodoptera litura were discussed for the development of new type of botanical pesticides. The toxicity of the total alkaloids to the 3rd instar larvae of S. litura was determined by insect-dip method. The toxicity of 3 compounds to the larvae of S. litura was tested by diet-incorporation. The results indicated that the total alkaloids of A. tectorius had strong toxic effect on the 3rd instar larvae and the LC50 values of 3 d and 5 d was 2.61 mg/mL and 0.91 mg/mL respectively. The growth of newly hatched instar larvae of S. litura was also inhibited by the three compounds. The compound(2)had the strongest inhibition effects with pupation rate 23.33% and eclosion rate 13.33%, which was significantly lower than those of control(pupation rate 90.00%, eclosion rate 86.67%).
Key words Ancistrocladus tectorius; Alkaloids; Spodoptera litura; Insecticidal activity; Growth and development inhibition
doi 10.3969/j.issn.1000-2561.2015.09.017
斜紋夜蛾(Spodoptera litura Fabricius)屬鱗翅目(Lepidoptera)、夜蛾科(Noctuidae),是世界重要的農業害蟲之一。以幼蟲取食寄主植物的果實、花、葉等,寄主植物多達99科290多種[1]。在我國淮河以北間歇性發生為害,淮河以南常年發生為害。在大田栽培作物中主要為害棉花、大豆、煙草、甘薯、花生等[2];而在蔬菜中則以十字花科蔬菜和水生蔬菜受害最為嚴重。近年來,斜紋夜蛾在各地大發生的頻率明顯提高,且呈上升趨勢[3-5]。由于化學藥劑的施用造成環境污染和害蟲耐藥性的問題,新型天然、高效、安全的物質被用來開發殺蟲劑已成為一種必然趨勢。
運用植物生物堿對斜紋夜蛾的研究較少,如煙堿能抑制斜紋夜蛾3齡幼蟲CarE的活性,并誘導谷胱甘肽-S-轉移酶的活性[6];雷公藤堿對斜紋夜蛾有強烈的忌避、拒食作用[7];白前生物堿對斜紋夜蛾3齡和5齡幼蟲具有較好的拒食活性[8],因而,植物生物堿具有廣闊的開發利用前景,值得深入研究。
鉤枝藤[Ancistrocladus tectorius(Lour.)Merr.]為鉤枝藤科(Ancistrocladaceae)鉤枝藤屬(Ancistrocladus Wall.)植物,該科全世界僅1屬,約20種。我國有1種,生于山坡、山谷密林中或山地熱帶雨林中,海拔500~700 m,見于海南各地[9-10]和廣西大青山[11-13],分布于柬埔寨、印度、印度尼西亞、老撾、馬來西亞、緬甸、新加坡、泰國、越南等國家[2]。鉤枝藤作為一種民間常用藥物[14-16],具有抗寄生蟲感染、消炎止瀉、行氣散結之功效,可用于治療瘧疾、痢疾、胃痛、跌打損傷、蛇毒等[15,17]。鉤枝藤的化學成分主要為生物堿類[18-28],其生物活性主要有抗瘧原蟲[29]、抗寄生蟲[30]、抗菌[14,30-32]、抗病毒[30]、抗腫瘤[29-30]、抗HIV[27]等方面,但對于在斜紋夜蛾上的應用研究未見報道。本研究在室內測定了鉤枝藤總生物堿及其單體化合物對斜紋夜蛾幼蟲的毒殺活性和抑制生長發育作用,將為充分利用鉤枝藤植物資源開發新型植物源殺蟲劑提供理論依據。
1 材料與方法
1.1 材料
鉤枝藤枝條于2011年5月采自海南省昌江縣,經中國熱帶農業科學院熱帶生物技術研究所代正福副研究員鑒定,憑證標本(No. TX20110512)存放于中國熱帶農業科學院熱帶生物技術研究所。斜紋夜蛾卵用采自海南省海口市美蘭區桂林洋福云村未施藥的蓮藕葉,在室內飼養繁殖多代,試驗時挑選大小一致、健康活潑的初孵幼蟲和3齡中期幼蟲供試。
1.2 方法
1.2.1 鉤枝藤總堿提取及單體化合物分離方法
鉤枝藤枝條(68.00 kg)曬干后加工成粉末,用體積分數95%的乙醇浸提3次,每次7 d。所得濾液經真空減壓濃縮至無乙醇味,得到乙醇提取物。將乙醇提取物用2%的鹽酸溶液反復溶解,過濾得酸水液,酸水液用氯仿萃取3次,減壓濃縮回收溶劑后得到酸水氯仿萃取物總堿A(179.00 g)。萃取后所剩的酸水相加入25%氨水至pH值為10.0,之后再用氯仿萃取3次,減壓濃縮回收溶劑后得到堿水氯仿萃取物總堿B(17.20 g)。
總堿A的分離純化:將酸水氯仿萃取物總堿A經減壓硅膠柱色譜,以氯仿-甲醇(1 ∶ 0~0 ∶ 1)梯度洗脫得到9個部分(Fr.1~Fr.9)。其中Fr.1(77.00 g)再經減壓硅膠柱色譜,以石油醚-乙酸乙酯(1 ∶ 0~0 ∶ 1)梯度洗脫得到7個部分(Fr.1.1~Fr.1.7),Fr.1.6(6.60 g)經硅膠柱色譜,以石油醚-丙酮(12 ∶ 1~1 ∶ 1)梯度洗脫得到6個亞組分(Fr.1.6.1~Fr.l.6.6),其中Fr.l.6.6(2.90 g)經反相柱色譜甲醇-水(1 ∶ 9~1 ∶ 0)、硅膠柱色譜以石油醚-乙酸乙酯(10 ∶ 1~1 ∶ 1)洗脫,并且經甲醇重結晶得到化合物(1)(120.20 mg)。Fr.6(2.50 g)經Sephadex LH-20柱色譜(純甲醇)得到5個部分(Fr.6.1~Fr.6.5),其中Fr.6.1(1.10 g)經反相柱色譜、硅膠柱色譜,以氯仿-甲醇(10 ∶ 1)洗脫得到化合物(2)(6.30 mg)。
總堿B(17.00 g)經減壓硅膠柱色譜,以氯仿-甲醇(1 ∶ 0~0 ∶ 1)梯度洗脫得到8個組分(Fr.1~Fr.8)。Fr.5(2.50 g)經反相柱色譜和重結晶得到化合物(3)(70.00 mg)。
1.2.2 化合物鑒定 Ancistrocline(1)無色結晶(氯仿),mp 229~233 ℃,[α]2D2+61.7(c2.1,氯仿),遇10%的硫酸顯墨綠色,改良碘化鉍鉀噴霧顯橘紅色,初步推測該化合物可能為生物堿。EI-MS m/z: 421[M]+,結合1H NMR和13C NMR譜數據推定其分子式為C26H31NO4。1H NMR(CDCl3, 500 MHz)δ 0.94(3H, d, J=6.3 Hz, CH3-3), 1.42(3H, d, J=6.2 Hz, CH3-1), 1.86(1H, m, H-4a), 2.09(1H, m, H-4b), 2.12(3H, s, CH3-2'), 2.29(1H, m, H-3), 2.43(3H, s, CH3-N), 3.72(1H, m, H-1), 3.85(3H, s, OCH3-8), 3.93(3H, s, OCH3-4'), 3.98(3H, s, OCHs-5'), 6.50 (1H, s, H-7), 6.75(1H, d, J=7.9 Hz, H-6'), 6.80 (1H, s, H-3'), 6.83(1H, d, J=7.9 Hz, H-8'), 7.18(1H, t, J=7.9 Hz, H-7')。13C NMR(CDCl3, 125 MHz)。上述波譜數據與文獻[33]報道基本一致,故鑒定為ancistrocline。
5'-O-Demethylhamatintine(2)黃色油狀,遇10%的硫酸顯藍黑色,改良碘化鉍鉀噴霧顯橘紅色,初步推測該化合物可能為生物堿。EI-MS m/z: 391 [M]+,結合1H NMR和13C NMR譜數據推定其分子式為C24H25NO4。1H NMR(DMSO-d6, 500 MHz): δ 1.16(3H, d, J=6.5 Hz, CH3-3), 1.99(3H, s, CH3-2'), 2.39(1H, dd, J=17.0, 10.2 Hz, H-4a), 2.58(1H, dd, J=17.0, 5.2 Hz, H-4b), 3.07(3H, s, CH3-1), 3.50 (1H, m, H-3), 3.72(3H, s, OCH3-8), 3.74(3H, s, OCH3-4'), 6.65(1H, d, J=7.5 Hz, H-8'), 6.70(1H, s, H-7), 6.89(1H, d, J=7.5 Hz, H-6'), 6.91(1H, s, H-3'), 7.05(1H, t, J=7.5 Hz, H-7'), 8.20(2H, s, OH-6,4')。13C NMR(DMSO-d6, 125 MHz)。上述波譜數據與文獻[34]報道基本一致,故鑒定為5 '-O-Demethylhamatintine。
N-methylphylline(3)無色結晶(氯仿),mp 265~267℃,[α]2D2(c 0.01,甲醇),遇10%的硫酸顯淺綠色,改良碘化鉍鉀噴霧顯橘紅色,初步推測該化合物可能為生物堿。EI-MS m/z: 191[M]+,結合1H NMR和13C NMR譜數據推定其分子式為C12H7NO。1H NMR(DMSO-d6, 500 MHz): δ 1.03(3H, d, J=6.3 Hz, CH3-3), 1.19(3H, d, J=6.3 Hz, CH3-1), 2.23(1H, m, H-3), 2.24(3H, s, CH3-N), 2.42(2H, d, J=8.0 Hz, H-4), 3.49(1H, m, H-1), 6.42(1H, d, J=7.4 Hz, H-5), 6.52(1H, d, J=7.4 Hz, H-7), 6.81(1H, t, J=7.4 Hz, H-6), 9.26(1H, s, OH)。13C NMR(DMSO-d6, 125 MHz)。上述波譜數據與文獻報道基本一致[35],故鑒定為N-methylphylline。
1.2.3 對斜紋夜蛾3齡幼蟲的毒殺作用 采用浸蟲法[36],每處理重復3次,每重復10頭試蟲。分別統計處理后第3天和5天的死亡情況,計算死亡率。用毛筆輕觸蟲體,不動或不能正常爬動者計為死亡。
1.2.4 對斜紋夜蛾初孵幼蟲的殺蟲活性 采用飼料混毒法[37]測定鉤枝藤單體生物堿類化合物(1)~(3)的殺蟲活性。先將純品化合物用丙酮配制成1 mg/mL,個別不溶的樣品加少量DMSO(含量在1%以下),配制斜紋夜蛾半人工飼料,趁熱在12孔培養板的每孔加入1 mL半人工飼料。待飼料凝固后,每孔加待測樣品20 μL,每個樣品加入10孔,重復3次。待溶劑揮發后,每孔接入1頭孵化后2 h的斜紋夜蛾初孵幼蟲,放入溫度為(25±1)℃、濕度80%的養蟲室內飼養。7 d后換喂正常飼料,直至成蟲羽化,以丙酮(丙酮+助溶劑)為溶劑對照,印楝素作為藥劑對照,分別于接蟲后7、10、14和20 d檢查試蟲死亡情況,統計試蟲幼蟲期、蛹期及化蛹情況,稱量蛹重,統計羽化蟲數量,并計算死亡率、化蛹率和羽化率。
1.3 數據處理
實驗結果用SPSS 13.0進行統計分析,將死亡率轉化為幾率值,濃度轉換成對數后進行線性回歸,回歸方程使用機值分析法計算。采用單因素方差分析DMRT法多重比較,p<0.05為具有差異顯著性。
2 結果與分析
2.1 對斜紋夜蛾3齡幼蟲的毒殺作用
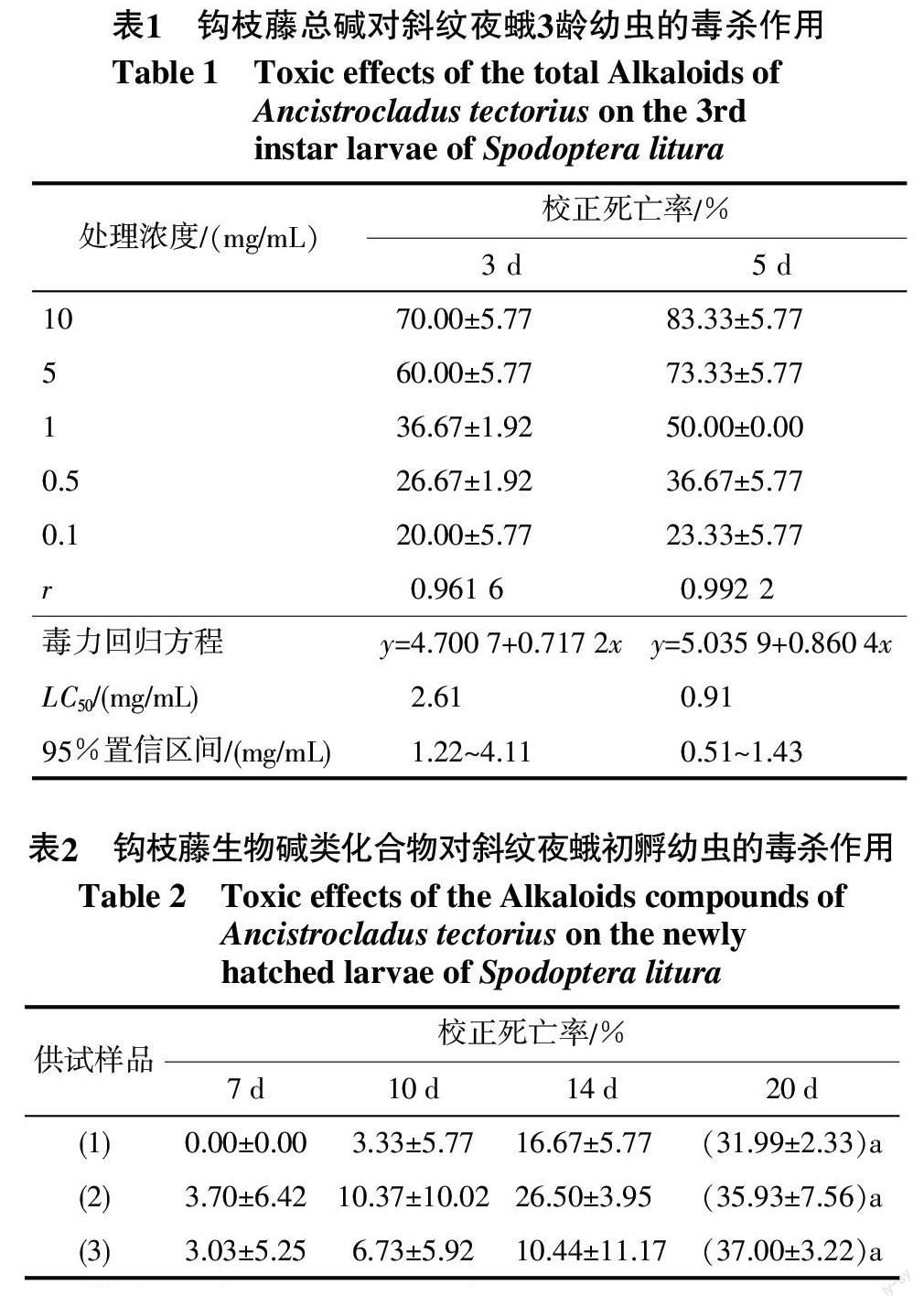
結果顯示,鉤枝藤總堿在處理濃度分別為10、5、1、0.5和0.1 mg/mL時,對斜紋夜蛾3齡幼蟲具有不同程度的毒殺作用(見表1)。其中以10 mg/mL處理組的殺蟲活性最高,其3 d和5 d的校正死亡率分別為70.00%和83.33%;10、5、1 mg/mL 處理組隨著時間的延長,5 d較3 d的校正死亡率增長幅度相同,均為13.33%;0.5 mg/mL處理組雖然在處理后第3天的毒殺活性較差(26.67%),但隨著處理時間的延長殺蟲活性明顯增強,其5 d的校正死亡率為36.67%,優于對照;而低濃度(0.1 mg/mL)處理組隨著時間的推移,校正死亡率增幅不大,其5 d 較3 d的校正死亡率僅為3.33%。以機率值分析法分別對上述結果進行擬合,得其處理后3 d和5 d的LC50值分別為2.61 mg/mL和0.91 mg/mL,卡方檢驗證實其卡方值均小于7.81,說明試驗結果真實可靠。
2.2 對斜紋夜蛾初孵幼蟲的殺蟲活性
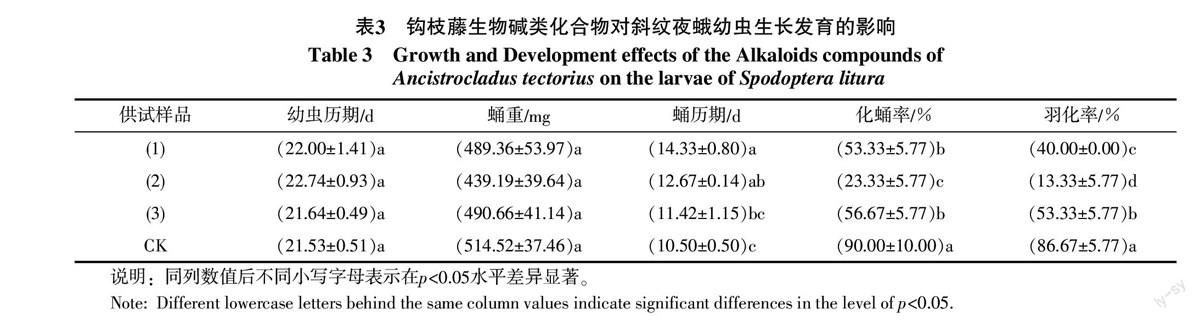
由表2可知,鉤枝藤生物堿單體化合物(1)~(3)對斜紋夜蛾初孵幼蟲均具有一定的毒殺活性,其中化合物(2)和化合物(3)的毒殺作用較高,第20天的校正死亡率分別為35.93%和37.00%,雖然高于化合物(1),但其活性強度間無顯著性差異,說明上述化合物(1)~(3)對斜紋夜蛾幼蟲的毒殺活性強度效果相當。
在試蟲發育期,對照組約21 d即可正常化蛹,而經鉤枝藤單體化合物(1)~(3)處理后的試蟲,對幼蟲期的影響不大。對斜紋夜蛾幼蟲的蛹期有較大影響,其中化合物(1)的蛹期最長,約為14 d,而對照組蛹期只需約10 d。處理組存活幼蟲均能正常化蛹和羽化,其化蛹率和羽化率均明顯低于對照組,其中化合物(2)的幼蟲期所需的時間最長為22.74 d,而對照所需時間為21.53 d;化蛹率(23.33%)、羽化率(13.33%)最低,顯著低于對照,對照對應的化蛹率、羽化率分別為:90.00%和86.67%(見表3)。
3 討論與結論
植物生物堿是植物在與昆蟲協同進化過程中形成的一大類具有防御功能的次生代謝物質,種類繁多,并且對昆蟲具有毒殺、拒食、忌避、抑制生長發育、不育、抗蟲、引誘等多種生物活性[38]。具有殺蟲活性的生物堿在環境中容易降解,作用方式獨特,對天敵和有益生物安全,不易產生抗藥性,符合人們對理想殺蟲劑的要求[39]。自第一個煙堿類殺蟲劑吡蟲啉問世以來,已有苦參堿、百部堿、藜蘆堿、雷公藤堿、小檗堿等幾十種被開發利用[40-42],且多數現已進入工業化生產。因而,對生物堿類化合物的市場開發前景廣闊,結合本研究,有望從鉤枝藤生物堿中開發出新型植物源殺蟲劑。
本研究發現鉤枝藤總生物堿以及3個單體生物堿類化合物(1)~(3)對斜紋夜蛾幼蟲具有一定的殺蟲活性,化合物(1)~(3)均為異喹啉類生物堿,其中(1)為萘基四氫異喹啉類生物堿,其為鉤枝藤的主要成分;(2)為萘基二氫異喹啉類生物堿;(3)為無萘基取代的異喹啉類生物堿。從已報道的異喹啉類生物堿來看,其主要的生物活性表現在抗菌、抗氧化、抗瘧、抗腫瘤、抗HIV方面。異喹啉類生物堿的生物活性與其結構有著密切的關系,如N原子的烷基化會使抗菌活性增加;具有萘基異喹啉骨架結構的化合物具有較好的抗瘧效果;芳香環上的羥基數目增加以及N的季銨化可明顯增加抗腫瘤活性等[43]。然而,對于異喹啉類生物堿的殺蟲或抗蟲活性則鮮有報道,Bringmann等[44]將從與鉤枝藤同屬的植物A. congolensis葉中提取到的生物堿Dioncophylline A添加到草地夜蛾(Spodoptera littoralis)幼蟲的人工飼料中,結果發現,20 d后幼蟲的死亡率明顯增高。其結構中OH官能團的變形可能是導致活性明顯增強的原因。結合本研究,鉤枝藤總堿對斜紋夜蛾幼蟲有較強的毒殺活性,隨著濃度的升高和時間的延長,幼蟲的死亡率也隨之增加,其中第3天和第5天的LC50值分別為2.61 mg/mL和0.91 mg/mL。但3個單體化合物對害蟲主要表現為抑制生長發育作用,雖然在處理前期對害蟲影響不大,但在處理后20 d也表現出較高的活性,明顯影響害蟲化蛹,大部分幼蟲在蛹期死亡,處理組化蛹率和羽化率顯著低于對照,這與Breuer等[45]報道植物生長調節劑[(E)-5-(2-bromovinyl)-2'-deoxyuridine]對草地貪夜蛾(Spodoptera frugiperda)的殺蟲活性主要表現為抑制生長發育作用,顯著影響幼蟲化蛹等現象一致。此外,因植物中的活性成分往往存在協同或微量元素未分離獲得等原因,本研究也發現所分離獲得的3個活性化合物活性較低,可能是化合物間存在協同作用,也可能是含量較少的微量元素未分離獲得,故接下來的工作將進一步對其殺蟲成分進行進一步的分離,并進一步討論其構效關系。
《“十二五”生物技術發展規劃》中明確指出:“十二五”期間,開展生物農藥、生物肥料、綠色植物生長調節劑等綠色農用產品應用的示范試點、普及以及研究和開發。盡管植物源生物堿在農藥中所占份額還較小,但生物堿已經成為未來生物農藥發展中的一種趨勢和方向[46]。此外,鉤枝藤在國內以海南分布最為廣泛,在廣西僅有零星分布,因此充分利用海南豐富的植物資源開發新型植物源農藥,將為海南農產品的質量安全提供有力的技術支撐。
參考文獻
[1] 華南農學院. 農業昆蟲學(下冊)[M]. 北京: 農業出版社, 1981: 691-692.
[2] 秦厚國, 葉正襄, 黃水金, 等. 不同寄主植物與斜紋夜蛾喜食程度、 生長發育及存活率的關系研究[J]. 中國生態農業學報, 2004, 12(2): 40-42.
[3] 蒙顯標, 陳 強, 陸壽成. 斜紋夜蛾在南寧市郊區暴發[J]. 植物保護, 1988, 14(6): 51.
[4] 方貴平. 蘇南地區斜紋夜蛾發生特點及防治對策[J]. 長江蔬菜, 1996(1): 13-14.
[5] 韓新才, 肖國蓉, 龔 進, 等. 幾種藥劑對甘藍上斜紋夜蛾的田間防效試驗[J]. 植物保護, 2003, 29(4): 53-54.
[6] 周 鄭. 煙堿和蕓香苷對斜紋夜蛾藥劑敏感性及相關酶活性的影響[J]. 農藥學學報, 2007, 9(3): 305-308.
[7] 童紅云. 雷公藤、 黃杜鵑對菜青蟲的毒理效應及防治研究[D]. 廣州: 華南農業大學, 1986.
[8] 陳 旭, 王迎兒, 王燕燕, 等. 白前提取物對斜紋夜蛾拒食活性的研究[J]. 中國生物防治, 2009, 25(增1): 36-39.
[9] 陳煥鏞. 海南植物志(第一卷)[M]. 北京: 科學出版社, 1964: 515.
[10] Wang Y Z, Gereau R. Ancistrocladaceae[M]// Wu Z Y, Raven P H. Flora of China Vol.13. Beijing: Science Press, 2007: 208.
[11] 鐘 堅. 鉤枝藤科新分布[J]. 廣西林業科技資料, 1980(3): 44.
[12] 莫新禮, 鐘業聰. 廣西的新植物[J]. 廣西植物, 1987, 7(4): 287-291.
[13] 陳偉球. 廣東植物志(第三卷)[M]. 廣東: 科技出版社, 1998: 157.
[14] Wiart C, Mogana S, Khalifah S, et al. Antimicrobial screening of plants used for traditional medicine in the state of Perak, Pennisular Malaysia[J]. Fitoterapia, 2004, 75: 68-73.
[15] 戴好富等. 黎族藥志(第二冊)[M]. 北京: 中國科學技術出版社, 2008: 124.
[16] Zheng X L, Wei J H, Sun W, et al. Ethnobotanical study on medicinal plants around Limu Mountains of Hainan Island, China[J]. J Ethnopharmacol, 2013, 148: 964-974.
[17] Ruangrungsi N, Wongpanich V, Tantivatana P, et al. Traditional Medicinal Plants of Thailand, V. Ancistrotectorine, a New Naphthalene Isoquinoline Alkaloid from Ancistrocladus tectorius[J]. J Nat Prod, 1985, 48: 529-535.
[18] 陳政雄, 王保德, 秦國偉, 等. 鉤枝藤中生物堿的分離和鑒定[J]. 藥學學報, 1981, 16(7): 519-523.
[19] Bringmann G, Kinzinger L. (+)-Ancistrocline, A naphthylisoquinoline alkaloid from Ancistrocladus tectorius[J]. Phytochemistry, 1992, 31(9): 3 297-3 299.
[20] Montagnac A, Hamid A, Hadi A, et al. Isoquinoline Alkaloids from Ancistrocladus tectorius[J]. Phytochemistry, 1995, 39: 701-704.
[21] Manfredi K P, Britton M, Vissieche V, et al. Three new Naphthyldihydroisoquinoline Akaloids from Ancistrocladus tectorius[J]. J Nat Prod, 1996, 59: 854-859.
[22] Tang C P, Yang Y P, Zhong Y, et al. Four new Naphthylisoquinoline Alkaloids from Ancistrocladus tectorius[J]. J Nat Prod, 2000, 63: 1 384-1 387.
[23] Tang C P, Xin Z Q, Li X Q, et al. Two New Naphthylisoquinoline Alkaloids from stems and leaves of Ancistrocladus tectorius[J]. Nat Prod Res, 2010, 24(11): 989-994.
[24] 蘇志恒. 鉤枝藤化學成分的研究[D]. 沈陽: 沈陽藥科大學, 2007: 1-61.
[25] 劉明生, 蘇志恒, 張俊清, 等. 鉤枝藤莖枝生物堿類成分的研究[J]. 中國藥學雜志, 2008, 43(14): 1 060-1 063.
[26] Xu M J, Bruhn T, Hertlein B, et al. Shuangancistrotectorines A-E, Dimeric Naphthylisoquinoline Alkaloids with Three Chiral Biaryl Axes from the Chinese Plant Ancistrocladus tectorius[J]. Chemistry, a European Journal, 2010, 16: 4 206-4 216.
[27] Jiang C, Li Z L, Gong P, et al. Five novel naphthylisoquinoline alkaloids with growth inhibitory activities against human leukemia cells HL-60, K562 and U937 from stems and leaves of Ancistrocladus tectorius[J]. Fitoterapia, 2013, 91: 305-312.
[28] 蔡彩虹. 鉤枝藤枝條的生物活性成分研究[D]. 海南: 海南大學, 2013: 1-65.
[29] Bringmann G, Zhang G L, Olschlager T, et al. Highly selective antiplasmodial naphthylisoquinoline alkaloids from Ancistrocladus tectorius[J]. Phytochemistry, 2013, 91: 220-228.
[30] Said I M, Ahmad I B, Yahya M D, et al. Biological Activity Studies of Ancistrocladus tectorius[J]. Pharm Biol, 2001, 39(5): 357-363.
[31] 姜雯婷, 戴好富, 劉守柏, 等. 52種熱帶藥用植物抗煙草青枯菌的體外活性篩選[J]. 微生物學雜志, 2011, 31(6): 15-18.
[32] 蔡彩虹, 梅文莉, 左文健, 等. 鉤枝藤枝條中抗菌活性成分研究[J]. 熱帶亞熱帶植物學報, 2013, 21(2): 184-188.
[33] 陳政雄, 王保德, 秦偉國, 等. 鉤枝藤中生物堿的分離和鑒定[J]. 藥學學報, 1981, 16(7): 519-523.
[34] Bringmann G, Spuziak J, Faber J H, et al. Six naphthylisoquinoline alkaloids and a related benzopyranone from a Congolese Ancistrocladus species related to Ancistrocladus cogolensis[J]. Phytochemistry, 2008, 69(4): 1 065-1 075.
[35] Bringmann G. Schneider C. Pfeifer R M. et al. Two atropisomeric N-methyldioncophyllines A and N-methylphylline their naphthalene-free heterocyclic moiety, from Ancistrocladus barteri[J]. Z Naturforsch, 2003, 58b: 577-584.
[36] 于偉麗, 張升國, 劉永強, 等. 5種藥劑不同生測方法對甜菜夜蛾幼蟲毒力比較[J]. 長江蔬菜, 2010(18): 116-118.
[37] 王洪鳳, 孫明清, 劉 順, 等. 萹蓄干粉及其提取物對棉鈴蟲生長發育的影響[J]. 草業學報, 2007, 16(8): 94-98.
[38] Kinghom A D. Alkaloids: Chemical and Biological Perspective[M]. Burlington: Burlington House, 1984.
[39] 朱 見, 沈以紅. 植物生物堿的殺蟲作用及應用[J]. 蠶學通訊, 2007, 27(4): 35-40.
[40] 劉成梅, 游 海. 天然產物有效成分的分離與應用[M]. 北京: 化學工業出版社, 2003.
[41] 羅萬春, 慕立義, 李云壽. 植物源生物堿的殺蟲作用[J]. 農藥, 1997, 36(7): 11-13.
[42] 郝乃斌, 戈巧英. 中國植物源殺蟲劑的研制與應用[J]. 植物學通報, 1999, 6(5): 495-503.
[43] 程軒軒, 王冬梅, 楊得坡. 異喹啉類生物堿的生物活性和構效關系研究進展[J]. 中草藥, 200, 37(12): 1 900-1 904.
[44] Bringman G, Holenz J, Wiesen B, et al. Dioncophylline A as a growth-regarding agent against the herbivorous insect Spodoptera littoralis: structure-activity relationships[J]. J Nat Prod, 1997, 60(4): 342-347.
[45] 薛廣厚, 范海延, 李 航, 等. 生物堿在植物源農藥中的應用研究[J]. 北方園藝, 2009(6): 131-134.
[46] Breuer M, Loof A D, Balzarini J, et al. Insecticidal activity of the pyrimidine nucleoside analogue(E)-5-(2-bromovinyl)-2'-deoxyuridine(BVDU)[J]. Pest Manag Sci, 2005, 61: 737-741.

