激活PPARα緩解PPARγ誘導的小鼠脂肪肝
白亮,王蓉,羅肖,趙四海,劉恩岐
(西安交通大學醫學部1.心血管研究中心動脈粥樣硬化與脂代謝研究室;2.醫學實驗動物中心;3.基礎醫學院生理學與病理生理學系,西安 710061)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一種無過量飲酒史,以肝細胞脂肪變性和脂肪貯積為特征的臨床病理綜合征。肝臟脂肪代謝長期紊亂,會逐漸發展為非酒精性肝炎、肝硬化,最終導致肝癌,嚴重威脅人類健康。因而,探索調控肝臟脂肪代謝和系統能量平衡的分子機制對脂肪肝疾病的防治意義深遠。
研究表明,肝臟脂肪代謝主要受過氧化物酶體增殖子激活受體(peroxisome proliferator-activated receptor,PPARs)調控[1,2]。PPARs 核受體超家族有三個成員:PPARα、PPARβ/δ 和 PPARγ[3]。PPARα在脂肪酸氧化代謝活躍的組織如肝、腎、心臟、小腸和骨骼肌中高表達,主要參與能量消耗[4]。文獻已報道,PPARα是脂肪酸的敏感器,通過調控線粒體、過氧化物酶體和微粒體氧化代謝系統影響肝臟脂質代謝[5,6]。PPARα 失活,能量消耗減少,最終導致脂肪肝和肝炎[7,8]。
與PPARα作用相反,PPARγ主要參與能量儲存,是脂肪細胞分化、脂肪生成以及能量代謝的關鍵調控子[3,9]。PPARγ在脂肪組織高表達,在肝臟組織表達較低,但其在肝臟脂肪生成中也發揮重要調控作用[10,11]。PPARγ的表達升高是脂肪肝的一個重要指標。研究發現,在一些小鼠動物模型中,如ob/ob和 PPARα-/-小鼠脂肪肝中,PPARγ 的表達顯著升高[12-14]。外源表達PPARγ導致小鼠生成脂肪肝,并誘導脂肪特異性基因和成脂相關基因的大量表達[11]。那么,激活PPARα是否會影響PPARγ對肝臟脂肪代謝的調控,目前尚不清楚。
本研究發現,野生型小鼠先給予PPARα激動劑Wy-14,643,再給予 Ad/PPARγ 刺激,小鼠肝臟脂肪變性明顯減輕,表明激活 PPARα能夠有效緩解PPARγ誘導的小鼠肝臟脂肪變。本實驗為研究肝臟脂肪代謝平衡提供了新的線索,為非酒精性脂肪肝的預防與治療提供了新的研究思路。
1 材料和方法
1.1 材料
1.1.1 實驗動物
SPF級野生型小鼠(C57BL/6J,wild type,WT),4~5周齡,體重18~20 g,購于西安交通大學醫學部醫學實驗動物中心【SCXK(陜)2012-003】,實驗在西安交通大學醫學部醫學實驗動物中心屏障動物房進行【SYXK(陜)2012-005】。12 h/12 h光照/黑暗交替,自由飲水。
實驗分為4組,每組3~4只小鼠。第1組,即正常飲食(Teklad#7904;Harlan-Teklad,Indianapolis,IN)組;第2 組小鼠給予 0.125%Wy-14,643 的飲食8 d;第3組小鼠通過尾靜脈注射給予Ad/PPARγ(病毒濃度為1 ×1011vp,體積為300 μL)5 d;第4組小鼠預先給予0.125%Wy-14,643的飲食3 d,再尾靜脈注射給予Ad/PPARγ 5 d。所有動物處理程序均符合美國NIH實驗動物管理法。
1.1.2 主要試劑、實驗材料
Wy-14,643 購自美國 Sigma 公司;Ad/PPARγ病毒原液來自美國西北大學Feinberg醫學院Janardan K.Reddy教授實驗室。
1.2 實驗方法
1.2.1 蘇木素-伊紅(H&E)染色法
取一小塊肝臟組織,經4%甲醛固定24~48 h,常規石蠟包埋,4 μm切片。按以下步驟脫蠟染色:二甲苯(I)5 min,二甲苯(II)5 min,二甲苯(III)5 min;100%乙醇3 min,95%乙醇3 min,80%乙醇3 min,蒸餾水沖洗3 min;蘇木素染色3 min,流水沖洗3 min;鹽酸乙醇分化10 s,自來水沖洗3 min;0.2%氨水返藍10 s,自來水沖洗3 min;伊紅染色30 s,然后進行脫水和透明,即80%乙醇3 min,95%乙醇 3 min,100%乙醇(I)3 min,100% 乙醇(II)3 min;二甲苯10 min,中性樹脂封片、照相。
1.2.2 油紅O染色法
從-80℃冰箱取出肝臟冰凍切片(5 μm)置于室溫5 min,4%的冰甲醛固定5 min,蒸餾水輕輕沖洗3次,放入100%丙二醇5 min(避免水進入油紅O染液),0.5%的油紅O染液60℃ 8 min。之后,用85%丙二醇洗滌5 min,蒸餾水輕輕沖洗3次。最后,用蘇木精復染5 s,自來水沖洗3 min,蒸餾水洗滌2次,甘油明膠封片、照相。
1.2.3 統計學分析
實驗數據利用GraphPad Prism軟件(GraphPad Software Inc.,San Diego,CA,USA)中的 One-way ANOVA進行分析,用Tukey檢驗法比較不同處理之間的差異。
2 結果
2.1 大體形態學及肝臟/體重比變化
正常對照組小鼠肝臟形態正常,肝臟與體重比平均為5.5%(圖1A和E);當給予PPARα激動劑Wy-14,643處理8 d,小鼠肝臟出現肥大,肝臟與體重比平均為10.8%,表現明顯的過氧化物酶體增殖反應(圖1B和E);野生型小鼠尾靜脈注射1×1011Ad/PPARγ 5 d,小鼠肝臟體積顯著增大,肝臟與體重比平均為14.6%,呈現典型脂肪肝(圖1C和E);預先給予小鼠PPARα激動劑Wy-14,643處理 3 d,再給予Ad/PPARγ刺激5 d,小鼠肝臟增大更加顯著,肝臟與體重比高達17.3%,但脂肪肝表型減弱(圖1D和E)。
2.2 病理組織形態學分析
為了進一步分析PPARα激活后對PPARγ刺激的小鼠脂肪肝的作用,我們進行了H&E和油紅O染色分析。H&E染色和油紅O染色揭示,正常對照組小鼠肝臟組織形態正常,肝細胞中幾乎無脂肪積聚(圖2A和3A),而Wy-14,643處理組小鼠肝細胞增殖明顯,肝細胞中也幾乎無脂肪積聚(圖2B和3B)。相反,Ad/PPARγ處理組小鼠肝細胞中聚集大量的脂肪(圖2C和3C)。與Ad/PPARγ處理組相比,用 PPARα 激動劑 Wy-14,643預處理,再用Ad/PPARγ刺激,小鼠肝細胞中脂滴聚集明顯減少(圖2D和3D)。
3 討論
機體內三大脂肪酸氧化系統:線粒體β氧化、過氧化物酶體β氧化和微粒體ω氧化系統均受PPARα 調控[6,8]。研究表明,PPARα 通過上調脂肪酸氧化能力來控制脂肪酸攝入,進而調控肝臟能量消耗[1,6,8]。而另一核受體成員 PPARγ 是脂肪生成的關鍵調控子,外源表達PPARγ能夠促進脂肪細胞分化,促進肝臟脂肪變性[10,11]。本研究發現,給予PPARα激動劑 Wy-14,643 預處理,再給予 Ad/PPARγ刺激,小鼠肝臟脂肪變性明顯減輕,提示激活PPARα能夠緩解PPARγ誘導的脂肪肝,為進一步研究PPARα與PPARγ之間的網絡調控奠定了實驗基礎,同時為臨床預防與治理脂肪肝疾病提供了實驗基礎。
PPARα通過上調脂肪酸氧化代謝,進而促進能量消耗[1]。研究表明,給小鼠PPARα激動劑—Wy-14,643能夠逆轉日糧誘導的肝臟纖維化和脂肪性肝炎[15]。同樣,給大鼠注射PPARα激動劑—氯貝特類藥物,可抵抗蛋氨酸膽堿缺失日糧誘導的脂肪性肝炎,且使肝臟纖維化發生逆轉[16]。相反,PPARα-/-小鼠在長期禁食狀態下呈現出嚴重的脂肪肝,主要是由于脂肪酸氧化代謝能力下降,不能有效氧化代謝進入肝臟的脂肪酸[7]。而且,飼喂蛋氨酸膽堿缺失日糧的PPARα-/-小鼠表現出嚴重的脂肪性肝炎[17]。與上述結果相一致,我們給野生型小鼠飼喂含有Wy-14,643的日糧,從肝臟大體形態以及組織學觀察發現,Wy-14,643有效地激活了PPARα,推測其有效啟動了脂肪酸氧化系統。
PPARγ通過刺激成脂關鍵基因的表達,促進成熟脂肪細胞脂質的生成和儲存。研究發現,在ob/ob和PPARα-/-小鼠脂肪肝中,PPARγ的表達顯著升高[12-14]。外源表達 PPARγ能促進 NIH3T3成纖維細胞向脂肪細胞分化并誘導生脂基因表達[11,18]。肝臟高表達PPARγ刺激小鼠形成脂肪肝,并誘導脂肪特異性基因和成脂相關基因的強烈表達[10]。相反,ob/ob和脂肪萎縮的AZIP小鼠背景下,肝臟特異性敲除 PPARγ 能顯著地緩解脂肪肝癥狀[19,20]。與上述結果一致,我們發現,給小鼠尾靜脈注射Ad/PPARγ,肝臟增大,肝細胞出現脂肪變,表明外源表達PPARγ促進脂肪肝的形成,提示肝臟脂肪合成代謝增加,肝臟能量存儲增多。那么,PPARα與PPARγ的作用會不會相互抵消呢?
本研究中,預先給小鼠飼喂含有Wy-14,643的日糧,激活PPARα,啟動其調控的脂肪酸氧化系統,再給小鼠尾靜脈注射Ad/PPARγ,外源表達PPARγ,刺激肝臟脂肪變性。肝臟大體形態和組織形態學表明激活PPARα可以有效減緩PPARγ誘導的脂肪肝。然而,有關脂肪形成、脂肪酸氧化系統相關基因及蛋白的表達需要進一步研究,以闡明激活PPARα緩解PPARγ誘導脂肪變的分子機制。
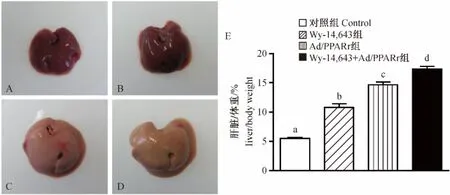
注:A.野生型小鼠肝臟;B.Wy-14,643處理組小鼠肝臟;C.Ad/PPARγ處理組小鼠肝臟;D.Wy-14,643+Ad/PPARγ處理組小鼠肝臟;E,肝臟重量與體重百分比,不同字母表示差異有顯著性(采用 Tukey方法進行多重比較,其中,Control vs.Wy-14,643,Control vs.Ad/PPARγ,Control vs.Wy-14,643+Ad/PPARγ,Wy-14,643 vs.Ad/PPARγ,Wy-14,643 vs.Wy-14,643+Ad/PPARγ,P < 0.01;Ad/PPARγ vs.Wy-14,643+Ad/PPARγ,P <0.05)。圖1 小鼠肝臟大體形態及重量變化Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse liver treated with Wy-14,643+Ad/PPARγ;E.Liver to body weight ratio.The different letter shows significant difference(Tukey’s multiple comparison test,Control vs.Wy-14,643,Control vs.Ad/PPARγ,Control vs.Wy-14,643+Ad/PPARγ,Wy-14,643 vs.Ad/PPARγ,Wy-14,643 vs.Wy-14,643+Ad/PPARγ,P <0.01;Ad/PPARγ vs.Wy-14,643+Ad/PPARγ,P <0.05).Fig.1 Gross changes of the mouse livers.
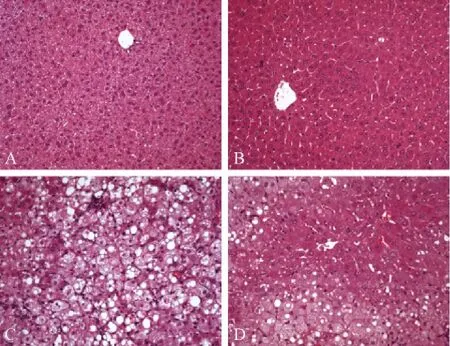
注:A.野生型小鼠肝臟;B.Wy-14,643處理組小鼠肝臟;C.Ad/PPARγ 處理組小鼠肝臟;D.Wy-14,643+Ad/PPARγ 處理組小鼠肝臟。圖2 各組小鼠肝臟病理組織(H&E染色,×20)Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse liver treated with Wy-14,643+Ad/PPARγ.Fig.2 Histological appearance of the liver tissues.H&E staining,×20
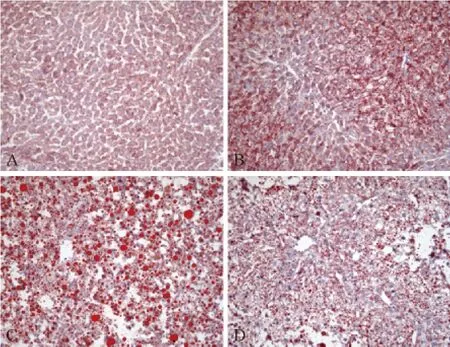
注:A.野生型小鼠肝臟;B.Wy-14,643處理組小鼠肝臟;C.Ad/PPARγ 處理組小鼠肝臟;D.Wy-14,643+Ad/PPARγ 處理組小鼠肝臟。圖3 各組小鼠肝臟病理組織(油紅O染色,×20)Note.A.A wild-type mouse;B.A mouse treated with Wy-14,643;C.A mouse treated with Ad/PPARγ;D.A mouse treated with Wy-14,643+Ad/PPARγ.Fig.3 Histological appearance of the mouse liver.Oil red O staining,×20
[1]Misra P,Reddy JK.Peroxisome proliferator-activated receptor-alpha activation and excess energy burning in hepatocarcinogenesis[J].Biochimie,2014,98:63 -74.
[2]Vluggens A,Reddy JK.Nuclear receptors and transcription factors in the development of fatty liver disease[J].Curr Drug Metab,2012,13(10):1422-1435.
[3]Wang YX.PPARs:diverse regulators in energy metabolism and metabolic diseases[J].Cell Res,2010,20(2):124 -137.
[4]Kliewer SA,Forman BM,Blumberg B,et al.Differential expression and activation of a family of murine peroxisome proliferator-activated receptors[J].Proc Natl Acad Sci U S A,1994,91(15):7355-7359.
[5]Gao Q,Jia Y,Yang G,et al.PPARα deficient ob/ob obese mice become more obese and manifest severe hepatic steatosis due to decreased fatty acid oxidation [J].Am J Pathol,2015,185(5):1396-408
[6]Rao MS,Reddy JK.PPARα in the pathogenesis of fatty liver disease[J].Hepatology,2004,40(4):783 -786.
[7]Hashimoto T,Cook WS,Qi C,et al.Defect in peroxisome proliferator-activated receptor alpha-inducible fatty acid oxidation determines the severity of hepatic steatosis in response to fasting[J].J Biol Chem,2000,275(37):28918-28928.
[8]Pawlak M,Lefebvre P,Staels B.Molecular mechanism of PPARα action and its impact on lipid metabolism,inflammation and fibrosis in non-alcoholic fatty liver disease [J].J Hepatol,2015,62(3):720-733.
[9]Janani C,Ranjitha Kumari BD.PPAR gamma gene—a review[J].Diabetes Metab Syndr,2015,9(1):46 -50.
[10]Bai L,Jia Y,Viswakarma N,et al.Transcription coactivator mediator subunit MED1 is required for the development of fatty liver in the mouse[J].Hepatology,2011,53(4):1164 -1174.
[11]Tontonoz P,Hu E,Spiegelman BM.Stimulation of adipogenesis in fibroblasts by PPAR gamma 2,a lipid-activated transcription factor[J].Cell,1994,79(7):1147 -1156.
[12]Costet P,Legendre C,More J,et al.Peroxisome proliferator-activated receptor alpha-isoform deficiency leads to progressive dyslipidemia with sexually dimorphic obesity and steatosis[J].J Biol Chem,1998,273(45):29577-29585.
[13]Memon RA,Tecott LH,Nonogaki K,et al.Up-regulation of peroxisome proliferator-activated receptors(PPAR-alpha)and PPAR-gamma messenger ribonucleic acid expression in the liver in murine obesity:troglitazone induces expression of PPAR-gamma-responsive adipose tissue-specific genes in the liver of obese diabetic mice[J].Endocrinology,2000,141(11):4021 -4031.
[14]Vidal-Puig A,Jimenez-Linan M,Lowell BB,et al.Regulation of PPAR gamma gene expression by nutrition and obesity in rodents[J].J Clin Invest,1996,97(11):2553 -2561.
[15]Ip E,Farrell G,Hall P,et al.Administration of the potent PPARalpha agonist,Wy-14,643,reverses nutritional fibrosis and steatohepatitis in mice[J].Hepatology,2004,39(5):1286 -1296.
[16]Rao MS,Papreddy K,Musunuri S,et al.Prevention/reversal of choline deficiency-induced steatohepatitis by a peroxisome proliferator-activated receptor alpha ligand in rats [J].In Vivo,2002,16(2):145-152.
[17]Kashireddy PV,Rao MS.Lack of peroxisome proliferator-activated receptor alpha in mice enhances methionine and choline deficient diet-induced steatohepatitis[J].Hepatol Res,2004,30(2):104-110.
[18]Rosen ED,Sarraf P,Troy AE,et al.PPAR gamma is required for the differentiation of adipose tissue in vivo and in vitro[J].Mol Cell,1999,4(4):611-617.
[19]Gavrilova O,Haluzik M,Matsusue K,et al.Liver peroxisome proliferator-activated receptorgamma contributesto hepatic steatosis,triglyceride clearance,and regulation of body fat mass[J].J Biol Chem,2003,278(36):34268-34276.
[20]Matsusue K,Haluzik M,Lambert G,et al.Liver-specific disruption of PPARgamma in leptin-deficient mice improves fatty liver but aggravates diabetic phenotypes[J].J Clin Invest,2003,111(5):737-747.

