人工設計二硫鍵增強谷氨酰胺轉胺酶熱穩定性
劉中美, 杜 坤, 周哲敏
(江南大學 生物工程學院,江蘇 無錫 214122)
谷氨酰胺轉胺酶(Transglutaminase,TGase,EC 2.3.2.13)是一種能夠催化酰基轉移反應的酶。它可以催化谷氨酰胺殘基的γ-羧酰胺基與各種酰基受體發生反應,實現蛋白質分子內、分子間交聯,從而極大地改變蛋白質的性質[1]。TGase廣泛應用于食品行業、生物醫藥、組織工程、紡織和皮革處理等多個領域[2-3]。由于TGase的卓越催化功能而倍受越來越多的研究者的青睞,它被譽為 “21世紀超級粘合劑”。
對TGase的研究可以追溯到50年前,美國生物化學家Heinrich Waelsch在人腦和肝臟提取物中首次發現具有酰胺基轉移催化功能的TGase酶[3]。微生物來源的 TGases (Microbial TGase,MTG)是1989年日本味之素公司首次發現的,由土壤中分離出的茂原鏈霉菌(Streptomyces mobaraense)產生[4]。與其它來源的TGase相比,MTG具有非Ca2+依賴性、溫度和pH穩定性高等特點[5-6]。此外,MTG生產周期短、產量高、成本低,易于工業化生產。S.mobaraense來源的MTG一級氨基酸序列于1993年被測定[7],由331個氨基酸組成,與動物來源的TGase相比,二者序列相似度低。S.mobaraense MTG的晶體結構于2002年被解析,二級結構屬于α+β型,含11個α-螺旋及8個β-折疊;催化活性基團Cys64、Asp255和His274均位于分子裂縫底部[8]。
目前,微生物來源的MTG已經實現了商品化(ActivaTM),ActivaTM中每克粉末中含有100個單位的酶活,但是其中只有體積分數1%的蛋白,體積分數99%的是麥芽糖糊精。麥芽糖糊精的作用是增強MTG的穩定性和使產品易于操作[9],因為酶的熱穩定性越好,在應用過程中可耐受的操作溫度越高,反應速率越快,成本也就越低。德國馬丁路德大學的Pietzsch研究組利用隨機突變和飽和突變等技術,提高了S.mobaraense來源的MTG的熱穩定性。研究結果表明,影響MTG熱穩定性的突變點大都集中在MTG的N端區域[10]。
作者參考Pietzsch研究組的實驗結果,采用理性設計手段,通過分子生物學技術、結構分析軟件、分子模擬等手段對Streptomyces hygroscopicus來源的MTG進行分子改造。通過結構比對和序列分析,并借助二硫鍵預測軟件Disulfide by design,在MTG的N端區域引入二硫鍵,使MTG的熱穩定性得到提高,進一步促進其工業化應用。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 質粒pET22b-pro-MTG、E.coli BL21(DE3)和E.coli JM109為本實驗室保存。
1.1.2 試劑與儀器 N-carboxybenzoyl-L-glutaminyl-glycine (N-CBZ-Gln-GLy)、L-谷氨酸-γ-單羥胺酸購自Sigma公司;中性蛋白酶Dispase:購自Worthington公司,PCR引物:生工生物工程(上海)股份有限公司合成。
紫外分光光度計(UV-1800):上海美譜達有限公司產品;HiTrap Q HP和HiTrap SP HP:GE公司產品;AKTA avant:GE 公司產品;Millipore 超濾離心管 Ultra-15 3K,默克公司產品。
1.1.3 主要培養基 LB培養基:10 g/L蛋白胨,5 g/L 酵母提取物,10 g/L NaCl,pH 7.0。 TB 培養基:12 g/L蛋白胨,24 g/L酵母提取物,體積分數0.4%甘油,17 mmol/L KH2PO4,72 mmol/L K2HPO4,pH 7.0。
1.2 方法
1.2.1 構建分泌表達載體 pET22b-pro-MTG(4-284)以載體pET22b-pro-MTG[11]為模板,D4C-up和D4C-down為引物,進行全質粒PCR,得到重組質粒pET-pro-MTG (D4C)。 以載體pET-pro-MTG(D4C)為模板,G284C-up和G284C-down為引物,進行全質粒PCR,獲得重組質粒pET-pro-MTG(4-284)。引物序列見表1,質粒均經過測序驗證。

表1 研究所用引物Table 1 Primers used in this study
1.2.2 重組蛋白酶的誘導表達 將轉化子接于含有50 mg/L氨芐青霉素的LB培養基中,37℃過夜培養后轉接至TB培養基中 (含有4 g/L葡萄糖和50 mg/L氨芐青霉素),37℃條件下培養至OD600為0.5~0.6,加入IPTG至終濃度為0.4 mmol/L,20℃條件下誘導40 h。
1.2.3 酶原活化與蛋白質純化 參照報道[12],收集發酵液,并在發酵液中加入終質量濃度為5 mg/L的中性蛋白酶Dispase,37℃保溫1 h,活化pro-MTG和 pro-MTG(4-284)。活化完成后,硫銨沉淀法(硫酸銨濃度55%~75%)收集目標蛋白,復溶于10 mmol/L磷酸鉀緩沖液(pH 6.0)。
將復溶液經過層析柱HiTrap SP HP分離純化,用含0.5 mmol/L NaCl的磷酸鉀緩沖液(pH 6.0)進行線性洗脫。收集含有目標蛋白的峰,并將收集的樣品于25 mmol/L Tris-HCl(pH 8.0)中透析過夜。將透析樣品離心取上清,注入HiTrap Q HP離子柱,并用含有0.5 mmol/L NaCl的25 mmol/L Tris-HCl(pH 8.0)溶液進行線性洗脫,收集目標蛋白。用SDS-PAGE凝膠電泳來檢測目標蛋白純度,Brandford法檢測蛋白質濃度。
1.2.4 檢測蛋白的二硫鍵含量 參照文獻[13],將蛋白MTG和MTG(4-284),分別稀釋在含有和不含有還原劑(10 mmol/L DTT)的溶液 A(80 mmol/L磷酸鉀緩沖液,質量分數2%SDS,pH 8.0)中,在沸水中煮10 min使蛋白變性。用超濾離心管(Millipore Ultra-15 3K)濃縮蛋白,同時用溶液A洗去DTT,然后取樣測蛋白質濃度。測定各樣品的吸光度值,計算各樣品在有DTT和無DTT存在時,半胱氨酸含量的變化,進而算出二硫鍵的含量。
1.2.5 酶學性質與熱穩定性測定 將重組MTG和MTG(4-284)分別在 37、45、50、55、65 ℃下處理 10 min,然后在冰上冷卻30 min。以N-CBZ-Gln-GLy(30 mmol/L)為底物,用比色法測定MTG酶活[11]。一個單位谷氨酰胺轉胺酶酶活的定義為:37℃時每分鐘催化形成1 μmol L-谷氨酸-γ-單羥基肟酸的酶量。
1.2.6 圓二色譜 用10 mmol/L磷酸鉀緩沖液稀釋至蛋白質質量濃度為0.2 mg/mL,通過MOS-450/AF-CD分光偏振計分別測定重組MTG和MTG(4-284)的T50值。吸收池寬10 mm,檢測波長為222 nm,溫度范圍為40~80℃。
1.2.7 抗胰蛋白酶降解測試 將純化后的蛋白樣品稀釋至0.5 mg/mL并分別加入終濃度為0.1 U/mL的胰蛋白酶。37℃保溫3 h,每隔0.5 h取樣一次,用SDS-PAGE凝膠電泳檢測蛋白的降解程度。
1.2.8 同 源 建 模 通 過 Swiss-Model(http://swissmodel.expasy.org/)對來源于 S.hygroscopicus的MTG進行同源建模,具體方法參見網站上的說明。模板為來源于Streptomyces mobaranesis的MTG(1IU4),兩者之間的氨基酸序列同源性為79.2%。利用 PROCHECK (http://nihserver.mbi.ucla.edu/SAVES/)對模型空間結構的準確性進行評估,結果顯示所有的氨基酸都是在合理的位置,表明構建的模型準確性較高。
2 結果與討論
2.1 MTG上二硫鍵位置的選取及質粒構建
S.mobaraense來源的MTG的N端區域對于MTG的熱穩定性起著很關鍵的作用[10]。S.hygroscopicus和S.mobaraense來源的MTG的序列同源性高達79.2%,因此推斷S.hygroscopicus來源的MTG的N端區域對其熱穩定性同樣重要,在該區域設計二硫鍵預期可以提高其穩定性。
通過同源建模獲得S.hygroscopicus來源的MTG的三維結構圖(圖1)。選定N端的Loop區作為改造的目標,利用Disulfide by Design軟件在目標區域預測二硫鍵的氨基酸位點,結果顯示在D4和G284之間可能形成二硫鍵。構建突變體質粒pET-pro-MTG(4-284),以檢測二硫鍵對MTG熱穩定性的影響。
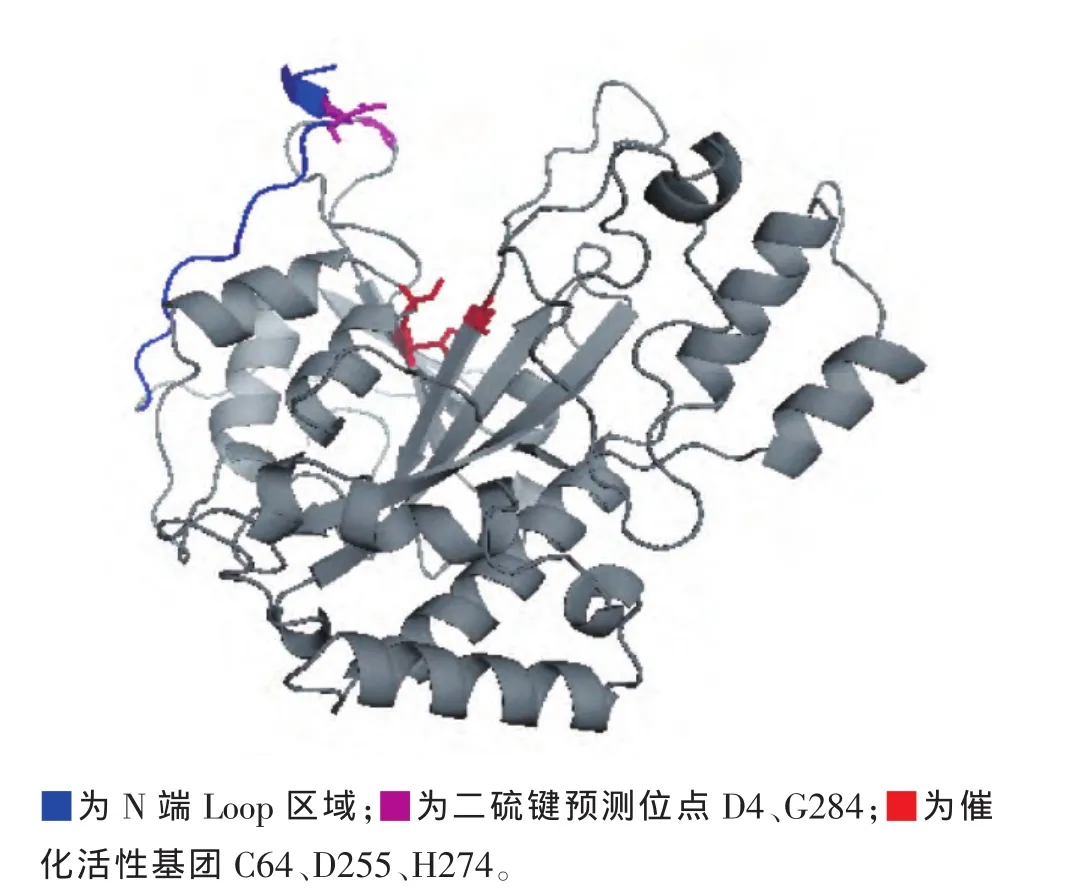
圖1 三維結構圖Fig.1 3D structure comparison of MTG
2.2 MTG和MTG(4-284)的表達、活化與純化
MTG和MTG(4-284)進行胞外表達,經過中性蛋白酶Dispase活化、硫酸銨分級沉淀 (質量分數55%~75%)、陽離子層析和陰離子層析后,獲得了純度較高的MTG和MTG(4-284),SDS-PAGE結果如圖2所示。
2.3MTG和MTG(4-284)的二硫鍵數量測定
二硫鍵的數量是通過對比MTG和MTG(4-284)在還原性環境(經DTT處理)和非還原性環境(未經DTT處理)下的巰基含量來確定的[13]。結果如表2所示,MTG在經DTT處理前后,其巰基含量基本沒有變化。每個MTG內只含有1個巰基,這和已知的蛋白序列只含一個半胱氨酸相一致。MTG(4-284)在經DTT處理后,檢測到的巰基含量約是DTT處理前的3倍,這說明經DTT處理后,一個二硫鍵被打開了,進而釋放出了兩個巰基。實驗結果表明MTG(4-284)內形成了一個二硫鍵。

圖2 純化蛋白電泳圖Fig.2 SDS-PAGE analysis of the purified proteins
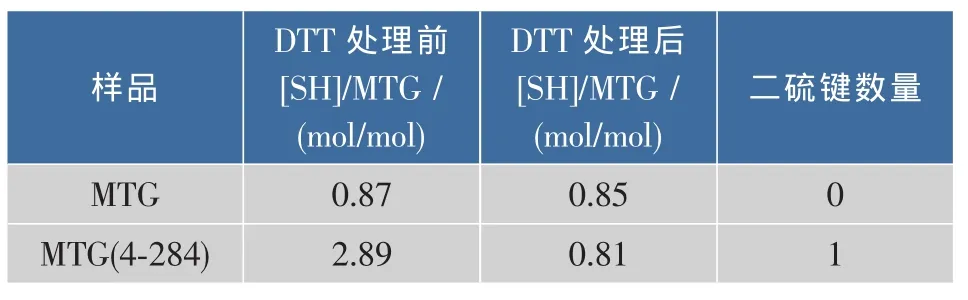
表2 MTG和MTG(4-284)的二硫鍵數量Table 2 Disulfide numbers of MTG and MTG(4-284)
2.4 MTG和MTG(4-284)的熱穩定性比較
將 MTG 和 MTG(4-284)在 37、45、50、55、60 ℃分別下處理10 min,再冰浴30 min,進行酶活檢測。如圖 3所示,MTG和 MTG(4-284)在 45℃處理 10 min后,酶活基本沒有降低,表明在該溫度下MTG的熱穩定性較好。MTG在50~60℃的環境下酶活隨著溫度的升高而迅速降低,而MTG(4-284)在55℃下處理10 min后,仍然保留95%的酶活,表明MTG(4-284)的熱穩性有了很大的提高。
圓二色譜技術測定MTG和MTG(4-284)的T50分別為 58 和 65℃(圖 4),表明 MTG(4-284)的蛋白質在變性和解折疊過程中所需的溫度均有所提高,反映出其熱穩定性提高了。這與熱處理后檢測酶活的結果一致。以上結果表明在S.hygroscopicus來源的MTG的N端區域引入二硫鍵可以提高其熱穩定性。
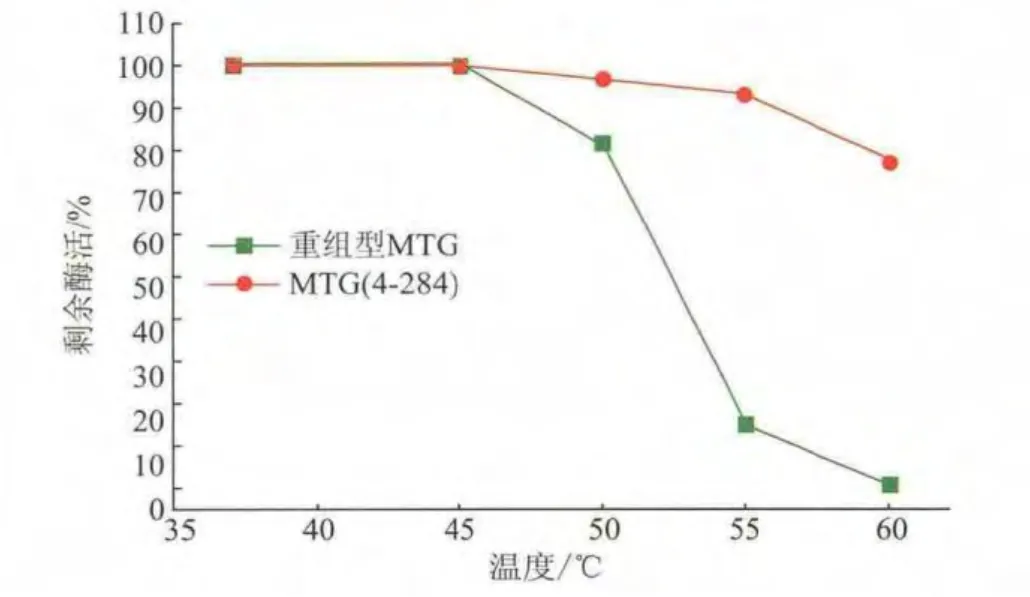
圖3 MTG和MTG(4-284)的熱穩定性Fig.3 Thermostability of MTG and MTG (4-284)at different temperature
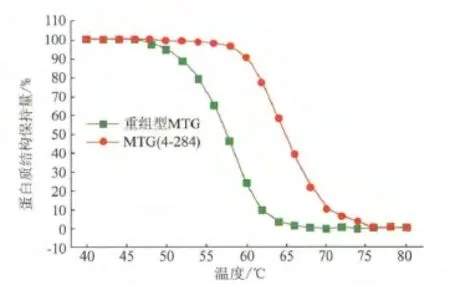
圖4 MTG 和 MTG(4-284)的 T50Fig.4 The T50of MTG and MTG(4-284)
2.5 MTG和MTG(4-284)的抗胰蛋白酶降解能力比較
胰蛋白酶經常被用來檢測蛋白酶的抗降解能力。從圖5中可以看出,MTG在經過3 h的胰蛋白酶處理后,目標條帶基本消失,在27 000左右出現一個明顯條帶。而MTG(4-284)在處理3 h后,依然有著比較明顯的條帶,下方也沒有出現降解的蛋白條帶。以上結果顯示MTG(4-284)抗胰蛋白酶降解的能力明顯增強。
MTG(4-284)熱穩性和抗蛋白酶降解的能力都有所提高,進一步表明在N端引入二硫鍵有效的提高了MTG(4-284)的穩定性。
3.6 MTG和MTG(4-284)的酶學性質比較
MTG(4-284)的比酶活略低于MTG;Km和kcat的結果顯示,引入的二硫鍵使得kcat變化略大,Km值變化很小,表明二硫鍵的引入基本沒有影響酶與底物的結合,而是底物進入活性中心后,酶分子完成催化所需的時間受到了一定的影響;MTG(4-284)在熱穩定性提高的同時,最適反應溫度也有所提高。
3 結語
作者通過在MTG的N端區域人工設計并引入二硫鍵,有效提高了其穩定性。圓二色譜檢測結果表明二硫鍵的引入使得其T50由58提高至65℃;酶活力檢測結果表明二硫鍵的引入導致比酶活略有所下降,由13.3 U/mg下降為12.5 U/mg;酶動力學參數表明二硫鍵的引入沒有影響酶與底物的結合過程,而是影響了底物進入活性中心后的催化過程。作者研究結果表明S.hygroscopicus來源的MTG的N端區域對于其穩定性重要影響,而該區域相對遠離活性中心,也比較適合進行分子改造。
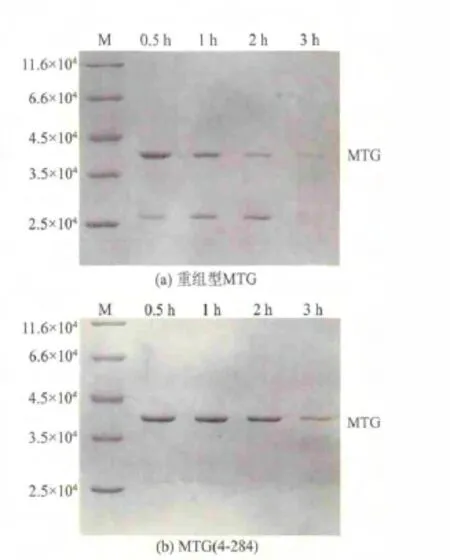
圖5 MTG(a)和MTG(4-284)(b)抗胰蛋白酶降解比較Fig.5 Trypsin-resistance of MTG(a)and MTG(4-284)(b)
[1]Yokoyama K,Nio N,Kikuchi Y.Properties and applications of microbial transglutaminase[J].Appl Microbiol Biotechnol,2004,64(4):447-454.
[2]Santos M,Torne J M.Recent patents on transglutaminase production and applications:a brief review[J].Recent Pat Biotechnol,2009,3(3):166-174.
[3]Beninati S,Bergamini C M,Piacentini M.An overview of the first 50 years of transglutaminase research[J].Amino Acids,2009,36(4):591-598.
[4]Ando H,Adachi M,Umeda K,et al.Purification and characteristics of a novel transglutaminase derived from microorganisms[J].Agric Biol Chem,1989,53(10):2613-2617.
[5]Yokoyama K,Utsumi H,Nakamura T,et al.Screening for improved activity of a transglutaminase from Streptomyces mobaraensis created by a novel rational mutagenesis and random mutagenesis[J].Appl Microbiol Biotechnol,2010,87(6):2087-2096.
[6]Heck T,Faccio G,Richter M,et al.Enzyme-catalyzed protein crosslinking[J].Appl Microbiol Biotechnol,2013,97 (2):461-475.
[7]Kanaji T,Ozaki H,Takao T,et al.Primary structure of microbial transglutaminase from Streptoverticillium sp.strain s-8112[J].J Biol Chem,1993,268(16):11565-11572.
[8]Kashiwagi T,Yokoyama K,Ishikawa K,et al.Crystal structure of microbial transglutaminase from Streptoverticillium mobaraense[J].J Biol Chem,2002,277(46):44252-44260.
[9]Sommer C,Hertel T C,Schmelzer C E,et al.Investigations on the activation of recombinant microbial pro-transglutaminase:in contrast to proteinase K,dispase removes the histidine-tag[J].Amino Acids,2012,42(2-3):997-1006.
[10]Mark C K,Hertel T C,Pietzsch M.Random mutagenesis of a recombinant microbial transglutaminase for the generation of thermostable and heat-sensitive variants[J].J Biotechnol,2008,136(3-4):156-162.
[11]杜坤,周麗,堵國成,等.內含肽介導谷氨酰胺轉胺酶酶原的活化[J].食品科學,2013,34(9):90-94.DU Kun,ZHOU Li,DU Guocheng,et al.Intein-mediated activation of transglutaminase from Streptomyces hygroscopicus[J].Food Science,2013,34(9):90-94.(in Chinese)
[12]LIU S,ZHANG D,WANG M,et al.The pro-region of Streptomyces hygroscopicus transglutaminase affects its secretion by Escherichia coli[J].FEMS Microbiol Lett,2011,324(2):98-105.
[13]Jeong M Y,Kim S,Yun C W,et al.Engineering a de novo internal disulfide bridge to improve the thermal stability of xylanase from Bacillus stearothermophilus No.236[J].J Biotechnol,2007,127(2):300-309.

