人β-防御素-2在肝細胞癌中的表達及其意義*
李榮江 桂水清 黃振華 曾憲成
β-防御素-2是由哺乳動物上皮細胞產生,主要存在宿主-環境的界面位置,是宿主抵御各種侵襲的第一道化學屏障的重要組成成分,在機體免疫防御中發揮著極其重要的作用。β-防御素-2除對真菌、革蘭陰性菌、革蘭陽性菌、螺旋體、分枝桿菌及某些包膜病毒具有很強的殺傷活性外,還可抑制腫瘤細胞生長。本研究通過檢測人β-防御素-2在肝癌組織、癌旁組織和正常肝組織中的表達,以及其對肝癌細胞凋亡的影響,旨在探討人β-防御素-2在肝癌發生、發展中的作用,現報道如下。
1 材料與方法
1.1 標本來源 收集2011年8月-2014年10月手術切除的原發性肝癌標本45例,其中男34例,女11例,年齡37~69歲,平均52.5歲,病理學檢查證實均為肝細胞肝癌,所有標本術前均未進行化療或放療;肝癌癌旁組織30例;活檢取正常肝組織(均為肝內膽管結石肝葉切除肝組織)20例。所有標本手術切除后立即放入液氮中-70 ℃冷凍保存,并切取少量組織用10%甲醛固定,石蠟包埋,連續4 μm進行病理切片。
1.2 實驗材料 免疫組織化學試劑盒(Invitrogeng公司, 美 國 ),Trizol(Gibco公 司, 美 國 ),Primescript RT MasterMiX、PremixTaq Version2.0、實時聚合酶鏈反應(realtime polymerase chain reaction,Real-Time PCR) SYBR Premix Ex Taq(Takara公司,日本),SP免疫組化試劑盒(北京中杉生物技術有限公司),dNTPS試劑盒(Promega公司)。HBD-2的上游引物5-CATGAGGGTCTTGTATCTCCTCT-3’及下游引物5-CCTCCTCAT-GGCTTTTTGCAGC-3’,均由上海生工生物工程技術服務有限公司合成。
1.3 方法
1.3.1 檢測HBD-2 mRNA的表達 根據說明書,采用Trizol法從所有肝癌組織、肝癌癌旁組織和正常肝組織標本中提取mRNA,根據逆轉錄試劑盒說明,將mRNA逆轉錄成cDNA;將cDNA用于PremixTaq Version2.0試劑做PCR分析表達情況。并將cDNA用于Real-Time PCR,定量檢測HBD-2 mRNA表達情況,具體的方法按照試劑盒說明進行。Real-Time PCR工作條件:95 ℃ 4 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 30 s,進行40個循環;75℃ 5 min。對HBD-2 mRNA以及內參照β-actin分別進行實時熒光定量PCR進行擴增,PCR定量計算 mRNA,待測樣品中的表達量用2-△Ct表示,2-△Ct=2-(Ct目的基因-Ct內參基因)。
1.3.2 檢測HBD-2蛋白的表達 采用鏈霉素抗生物素蛋白-過氧化酶連接(SP)法,HBD-2一抗工作濃度為1∶50。實驗步驟依據試劑盒說明進行。結果判斷:組織切片染色以胞漿中染成淡黃或棕黃色為陽性,根據陽性細胞百分率分為:陽性細胞數<5%為陰性,10%~50%為弱陽性,>50%為強陽性。
1.3.3 肝癌組織的細胞凋亡檢測 采用原位末端標記法(TUNEL法),在200倍鏡下隨機選取10個視野,計算1000個腫瘤細胞中陽性染色細胞百分率,根據以下公式計算細胞凋亡表達指數(AI),凋亡指數(AI)=(凋亡小體+凋亡細胞數)/細胞總數×100%。
1.4 統計學處理 采用SPSS 19.0統計軟件對實驗數據進行分析,計量資料以(±s)表示,比較采用t檢驗或秩和檢驗,計數資料以率(%)表示,比較采用 字2檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1 HBD-2 mRNA檢測結果 PCR結果顯示,在肝癌組織、癌旁組織和正常肝組織中均可檢測到HBD-2 mRNA(圖1)。Real-Time PCR結果顯示,HBD-2 mRNA在肝癌組織、癌旁組織和正常肝組織中的表達均值分別為(1.469±0.519)、(3.742±0.394)和(3.835±0.256),三組間比較差異有統計學意義(F=336.87,P<0.01)。正常肝組織和癌旁組織中,HBD-2 mRNA的表達比較差異無統計學意義(P=0.46);相對于正常的肝組織和癌旁肝組織,在肝癌組織中HBD-2 mRNA的表達明顯下降,比較差異有統計學意義(P=0.00)。
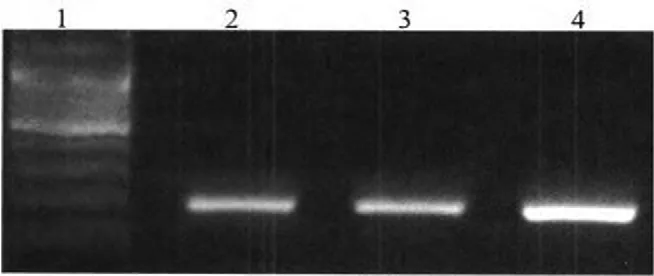
圖1 肝癌組織、癌旁組織和正常肝組織HBD-2 mRNA的表達注:1為Marker;2為肝癌組織;3為癌旁組織;4為正常肝組織
2.2 HBD-2蛋白表達檢測結果 HBD-2蛋白在正常肝組織及肝細胞癌組織中可呈陰性或陽性表達(圖2);HBD-2蛋白在肝癌組織、癌旁組織和正常肝組織中的表達率比較差異有統計學意義(P<0.05),見表1。
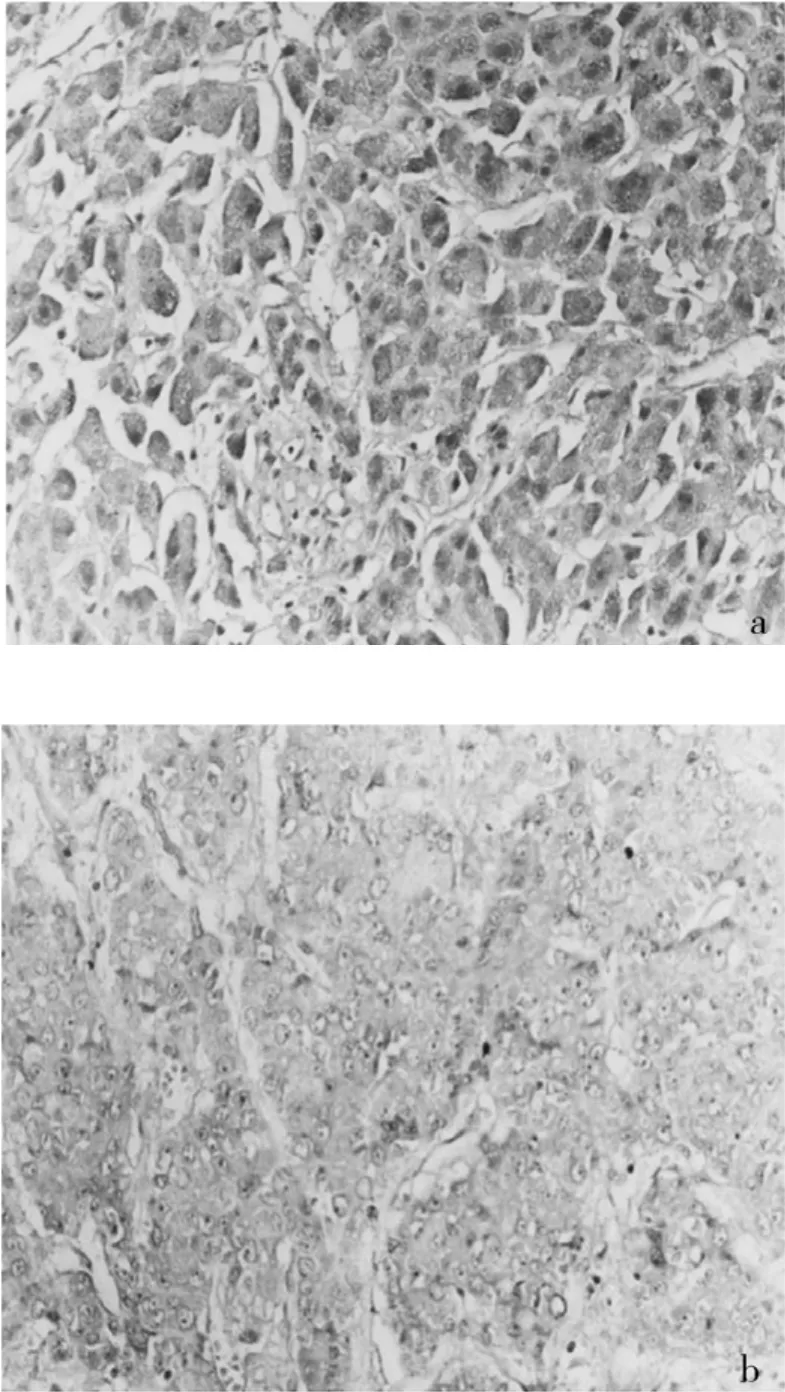
圖2 HBD-2在肝癌組織及正常肝組織中的表達
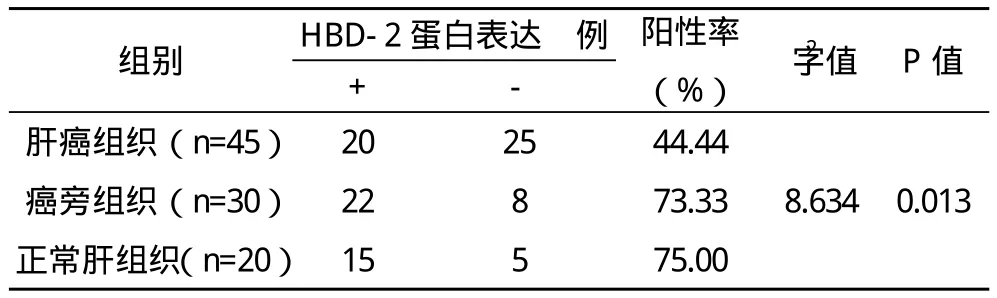
表1 HBD-2蛋白在肝癌組織、癌旁組織和正常肝組織中的表達
2.3 不同肝癌組凋亡指數(AI)比較 HBD-2蛋白陽性表達肝癌組20例的凋亡指數為(3.279±0.309)%,HBD-2蛋白陰性表達肝癌組25例的凋亡指數為(2.072±0.289)%,兩組凋亡指數比較差異有統計學意義(t=13.501,P=0.000)。
3 討論
人體的防御素主要可分為兩大類,即α-防御素和β-防御素,HBD-2屬β-防御素家族成員。防御素在天然免疫功能中扮演多種作用,據報道人類的HBD具有抗腫瘤的作用[1]。HBD-2是由41個氨基酸殘基陽離子構成的短肽,富含半胱氨酸。含6個氨基酸殘基構成的3個二硫鍵結構及3束β片層結構。HBD-2表面有較多正電荷,其空間結構可分為帶電區和疏水區。HBD-2獨特結構使其既有親水性又有親脂性,可在多種微生物細胞膜上形成孔道,破壞微生物細胞膜,文獻[2]指出HBD-2可能參與了尖銳濕疣的免疫反應過程并發揮了一定的作用。HBD-2是天然免疫的重要組成成分,存在于全身各種組織細胞中如皮膚、牙齦、扁桃體、肺、胃、小腸、結腸、膀胱、血管、骨髓等[3-5]。另外,在一些腫瘤組織也存在,如口腔鱗狀細胞癌、食管癌、前列腺癌等[6]。
目前已在多種腫瘤組織中如泌尿生殖系統腫瘤、呼吸系統腫瘤、消化系統腫瘤等發現防御素[7-8]。體內防御素水平及其發生變異可能與某些腫瘤發生、治療及預后相關[9-11]。低濃度的防御素不影響正常細胞,但有明顯抗腫瘤作用,其抗腫瘤作用可能與細胞骨架有關[12]。細胞膜可能是防御素作用的靶之一,當細胞發生癌變后,細胞膜表面的負電荷增加,利于帶正電荷的防御素與腫瘤細胞膜結合,導致細胞骨架改變。研究發現,鼠β-防御素可增加腫瘤抗原的可識別性,在腫瘤體液免疫和細胞免疫中發揮作用[13]。此外,β-防御素可以破壞腫瘤細胞的骨架,防止紡錘絲形成及阻止細胞的有絲分裂,從而抑制腫瘤的生長,還可以破壞腫瘤細胞的線粒體引起腫瘤細胞死亡或誘導腫瘤細胞凋亡[14]。另外,β-防御素可通過體液免疫方面抵抗癌細胞的入侵[15]。
本研究結果顯示相對于正常肝組織及癌旁組織,肝細胞癌組織HBD-2 mRNA的表達量明顯下降,比較差異有統計學意義(P<0.01),但正常肝組織與癌旁組織HBD-2 mRNA的表達量比較差異無統計學意義(P>0.05);免疫組化結果顯示,肝細胞癌HBD-2蛋白的表達明顯低于正常肝組織及癌旁組織;HBD-2蛋白表達陽性的肝癌組織細胞凋亡指數明顯高于HBD-2蛋白表達陰性的肝癌組織,比較差異有統計學意義(P<0.01)。以上結果表明,在肝細胞癌的發生過程中,HBD-2 mRNA的表達量的下降使HBD-2蛋白表達下調,從而導致肝癌細胞凋亡減少,提示HBD-2可能在肝癌細胞的發生中有一定作用,而且可能是通過影響細胞凋亡起作用,HBD-2在肝細胞癌的發生、發展及預后中的作用需要進一步的研究。
[1] Shestakova T, Zhuravel E, Bolgova L,et al.Immunohistochemical analysis of beta-defensin-2 expression in human lung tumors[J].Exp Oncol,2010,32(4):273-276.
[2]屈麗,甄莉.β-防御素-2和γ干擾素在尖銳濕疣皮損中表達的研究[J].中國醫學創新,2013,10(12):4-6.
[3] Pereira A L,Holzhausen M,Franco G C,et al.Human β-defensin-2 and protease activated receptor-2 expression in patients with chronic periodontitis[J].Arch Oral Biol,2012,57(12):1609-1614.
[4] Bauer B,Wex T,Kuester D,et al.Differential expression of human beta defensin 2 and 3 in gastric mucosa of Helicobacter pylori-infected individuals[J].Helicobacter,2013,18(1):6-12.
[5] Choi I J,Rhee C S,Lee C H,et al.Effect of allergic rhinitis on the expression of human β-defensin-2 in tonsils[J].Ann Allergy Asthma Immunol,2013,110(3):178-183.
[6] Kim H J,Jung J R,Kim H J,et al.Expression of human β-defensin-2 in the prostate[J].BJU Int,2011,107(1):144-149.
[7] Bose S K,Gibson W,Bullard R S,et al.PAX2 oncogene negatively regulates the expression of the host defense peptide human beta defensin-1 in prostate cancer[J].Mol Immunol,2009,46(6):1140-1148.
[8] Semlali A,Al Amri A,Azzi A,et al.Expression and new exon mutations of the human beta defensins and their association on colon cancer development[J].PLoS One,2015,10(6):e0 126 868.
[9] Shi N,Jin F,Zhang X,et al.Overexpression of human β-defensin-2 promotes growth and invasion during esophageal carcinogenesis[J].Oncotarget,2014,5(22):11 333-11 344.
[10] Scola N,Gambichler T,Saklaoui H,et al.The expression of antimicrobial peptides is significantly altered in cutaneous squamous cell carcinoma and precursor lesions[J].Br J Dermatol,2012,167(3):591-597.
[11] Joly S,Compton L M,Pujol C,et al.Loss of human beta-defensin 1,2,and 3 expression in oral squamous cell carcinoma[J].Oral Microbiol Immunol,2009,24(5):353-360.
[12] Steinstraesser L,Kraneburg U,Jacobsen F,et al.Host defense peptides and their antimicrobial-immunomodulatory duality[J].Immunobiology,2011,216(3):322-333.
[13] Oppenheim J J,Biragyn A,Kwak L W,et al.Roles of antimicrobial peptides such as defensins in innate and adaptive immunity[J].Ann Rheum Dis,2003,62(Suppl 2):ii17-ii21.
[14] Lapis K.Host defense peptides and peptidomimetics as new weapons for cancer treatment[J].Magy Onkol,2010,54(1):47-58.
[15] Arnett E,Seveau S.The multifaceted activities of mammalian defensins[J].Curr Pharm Des,2011,17(38):4254-4269.

