紫杉醇脂質納米粒子對KB、SKOV3細胞作用的對比分析
王宗站 楊金霞 周宓 邢曉波
紫杉醇(TAX)被廣泛用于乳腺癌、非小細胞肺癌、卵巢癌、頭頸部腫瘤。紫杉醇水溶性差,將其溶于無水乙醇和聚氧乙基代蓖麻油的混合溶媒中,此溶媒容易導致嚴重的過敏反應[1]。脂質體作為轉運載體,其制作簡單、能降低藥物不良反應的發生并容易實現腫瘤靶向等治療的優點[2]。紫杉醇脂質納米粒子作用KB、SKOV3,探討其作用機制,為臨床應用提供基礎證實。
1 材料與方法
1.1 材料 紫杉醇納米粒子(TAX-NLC,蘇州大學,批號:20080525),1640培養基(GIBCO公司),Fluo-3(美國Molecular Probes公司),小牛血清(GIBCO公司),胎牛血清(GIBCO公司),Dapi(上海寶曼科技生物有限公司),MTT(上海勵瑞生物科技有限公司),Phellotin Tax-Red(美國Molecular Probes公司),TCP-SP型激光共聚焦顯微鏡(德國Leica公司),人口腔上皮癌KB細胞(中科院上海細胞庫),人卵巢癌SKOV3細胞(中科院上海細胞庫),HERA CO2培養箱(德國Kedro公司)。
1.2 細胞培養 KB細胞以含15%小牛血清的RPMI-1640培養,SKOV3以含15%胎牛血清的RPMI-1640培養,培養箱CO2濃度設定為5%,溫度設定為37 ℃。
1.3 方法
1.3.1 TAX-NLC作用KB、SKOV3細胞后鈣濃度的變化 制備KB、SKOV3細胞懸液,接種在蓋玻片上;培養24 h后,PBS洗滌3次;放入4 μmol/L的Fluo-3負載液中,在常溫條件下避光培養40 min,PBS洗滌;放入激光共聚焦顯微鏡專用凹槽內,加入200 μL無血清1640培養基;對照組為200 μL無血清1640,實驗組為終濃度是100 nmol/L的TAX-NLC 200μL,同時在電腦上標記細胞,動態觀測細胞內熒光強度變化。
1.3.2 TAX-NLC作用KB、SKOV3細胞對F-肌動蛋白的影響 KB、SKOV3細胞接種在蓋玻片上,培養24 h,加入最終濃度為100 nmol/L的TAX-NLC,作用3 h,PBS洗滌細胞,繼續培養24 h。PBS洗滌,以戊二醛固定30 min,PBS洗滌,加入1%的tritonX-100和1%的BSA放置30 min,PBS洗滌。再加入5 μg/mL的Taxax Red-x phallodin 100 μL避光培養30 min,PBS洗滌,加入2 μg/mL的Dapi 100 μL避光培養30 min。激光共聚焦顯微鏡下觀察KB、SKOV3細胞F-肌動蛋白形態學變化。
1.3.3 MTT法檢測TAX-NLC對KB、SKOV3細胞的抑制率 將KB、SKOV3細胞接種于96孔培養板中,每孔終體積為100 μL,設置6個復孔。培養24 h,每孔加入TAXNLC 10 μL,終濃度為100 nmol/L,對照組加入10 μL 1640培養基,培養3 h,PBS洗滌細胞。加入培養基繼續培養12、24、48、72 h,上機測試前4 h加入10 μL 5 mg/mL的MTT,棄上清液,加入100 μL DMSO,震蕩10 min,在波長為570 nm處測各孔OD值。每組重復3次。100 nmol/L TAX-NLC對KB、SKOV3細胞的抑制率為(1-實驗組OD值/對照組OD值)×100%。
1.3.4 熒光顯微鏡下觀察TAX-NLC作用KB、SKOV3細胞誘導多核細胞 制備細胞懸液,接種到蓋玻片上,培養24 h后,加入終濃度為100 nmol/L的TAX-NLC,作用3 h后,繼續培養24 h,每組設3個平行樣本。PBS洗滌細胞,以2%的戊二醛在常溫下固定30 min,PBS洗滌,加入2 μg/mL的Dapi 100 μL在常溫下避光培養30 min,在熒光顯微鏡下觀察細胞核的形態變化。每個樣品至少計數10個高倍鏡視野,計數1000個細胞。
1.4 統計學處理 采用SPSS 16.0進行統計學分析,計量資料以(±s)表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 激光共聚焦顯微鏡下觀察細胞熒光強度變化 對照組KB細胞、SKOV3細胞,隨著時間的延長,熒光強度逐漸增強,細胞亮度也隨之逐漸增加,形態越來越清晰。100 nmol/L的TAX-NLC作用KB、SKOV3細胞后,細胞亮度也逐漸增加,細胞形態逐漸清晰,但其亮度遠遠超過對照組。Fluo-3可以與細胞內游離鈣結合,細胞內熒光強度的增強說明細胞內鈣離子濃度的增加。100 nmol/LTAX-NLC作用后,KB 細胞熒光強度在60 min時,達到最高值;SKOV3細胞在50 min時,達到最高值。SKOV3細胞在開始時熒光強度就很高。對照組KB細胞內熒光強度去本底后最大值為12(圖1),實驗組KB細胞內熒光強度去本底后最大值為68(圖2);對照組SKOV3細胞內熒光強度去本底后最大值為16(圖3),實驗組SKOV3細胞內熒光強度去本底后最大值為38(圖4)。
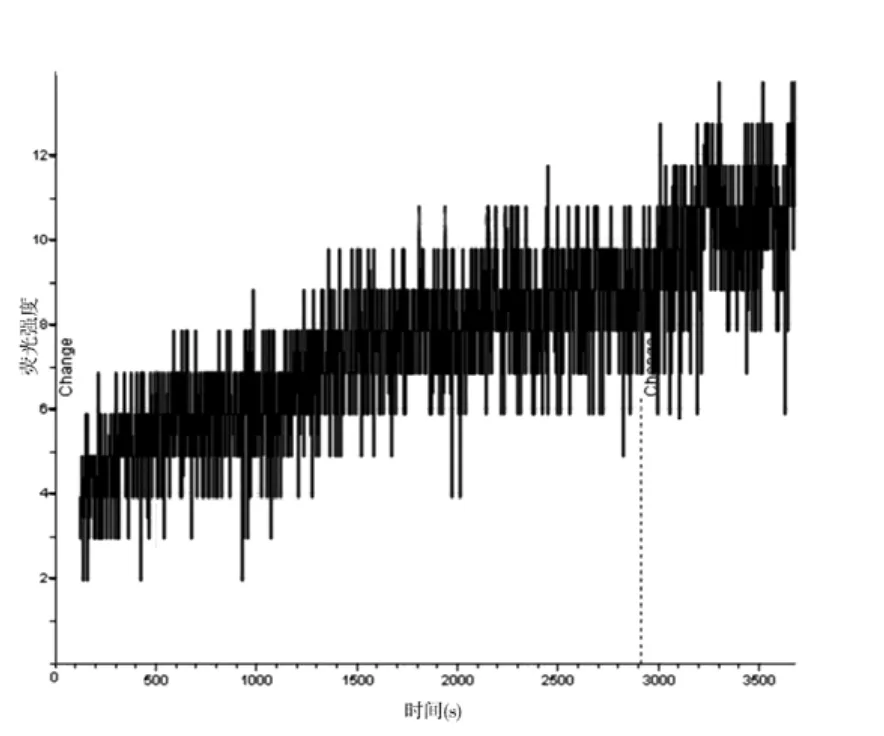
圖1 對照組去本底KB細胞熒光強度
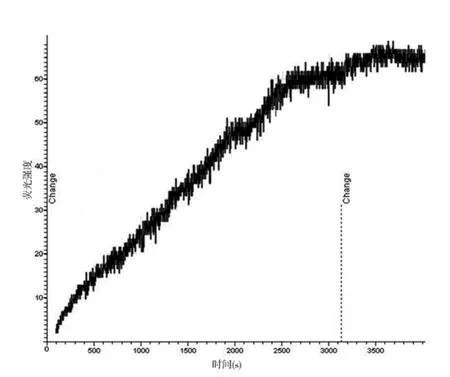
圖2 實驗組KB細胞去本底熒光強度

圖3 對照組SKOV3細胞去本底熒光強度

圖4 實驗組SKOV3細胞熒光強度
2.2 激光共聚焦纖維鏡下觀察KB、SKOV3細胞F-肌動蛋白的變化 藍色的為細胞核,紅色的F-肌動蛋白,圖5、7為未加藥組KB、SKOV3細胞F-肌動蛋白形態圖像,F-肌動蛋白以細胞核為中心往四周呈放射狀分布,條理清楚,結構完整,呈絲狀排列。圖6、8是經100 nmol/L的TAX-NLC作用后F-肌動蛋白形態圖像,F-肌動蛋白集聚呈團塊狀或點狀,條理不清楚,結構不完整,排列紊亂。
2.3 MTT實驗測定細胞抑制率 100 nmol/LTAX-NLC 24、48、72 h對KB細胞的抑制率高于對SKOV3細胞的抑制率(P<0.05)。見表1。
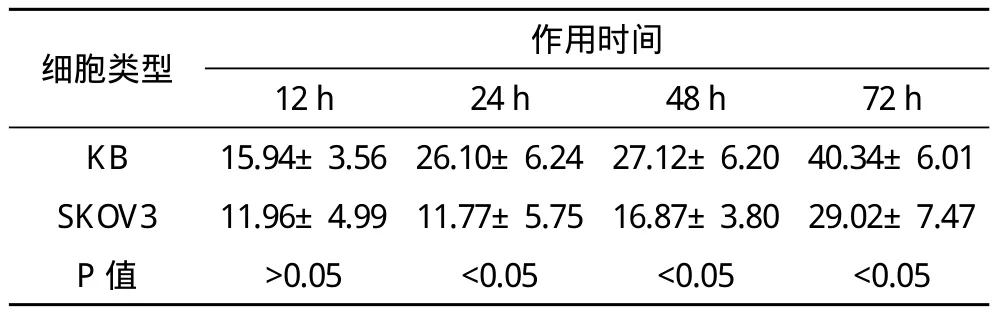
表1 100 nmol/L TAX-NLC對KB、SKOV3細胞的抑制率(x-±s,n=3) %
2.4 熒光顯微鏡下觀察TAX-NLC誘導KB、SKOV3細胞產生多核細胞 正常KB、SKOV3細胞基本很少能見到多核細胞,加藥后多核細胞數目明顯增多。100 nmol/L的TAX-NLC作用KB、SKOV3細胞后,多核細胞比例分別為(85.62±2.51)%,(56.22±3.14)。100 nmol/L TAX-NLC 誘導KB、SKOV3細胞產生的多核細胞數目相比較,KB細胞的數目明顯多于SKOV3細胞,差異有統計學意義(P<0.05)。見圖9~12。
3 討論
TAX是臨床上廣泛使用的一類抗腫瘤藥物,對卵巢癌、乳腺癌、非小細胞肺癌、頭頸部腫瘤、前列腺癌等均有較好療效[3]。TAX-NLC是由TAX、硬脂酸、卵磷脂、膽固醇、玉米油、無水乙醇經高壓乳勻合成的納米化脂質藥物。劉圣活等[4]報道納米顆粒具有優良的傳輸性能。TAX以脂質納米粒為載體,可以將TAX載入腫瘤細胞內,更好地殺傷細胞。劉敏等[5]報道,TAX-NLC對KB細胞的殺傷作用優于TAX,其作用機制可能是TAX-NLC更容易通過細胞膜,并在細胞中濃聚。

圖5 正常KB細胞F-actin
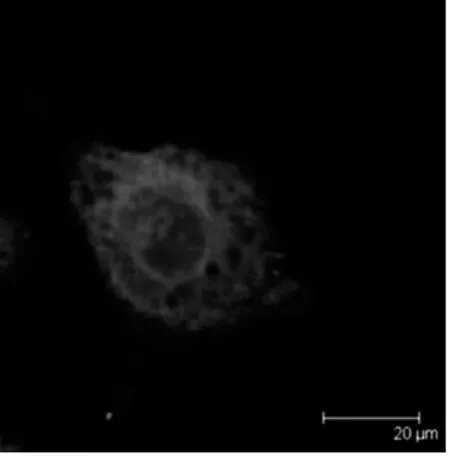
圖6 實驗組KB細胞F-actin
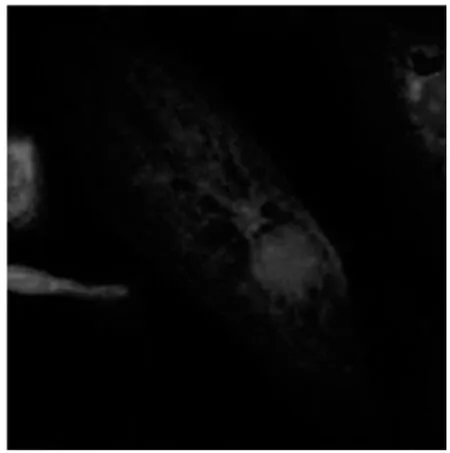
圖7 正常SKOV3細胞F-actin

圖8 實驗組SKOV3細胞F-actin

圖9 正常KB細胞 ×1000(熒光顯微鏡)

圖10 實驗組KB細胞 ×1000(熒光顯微鏡)
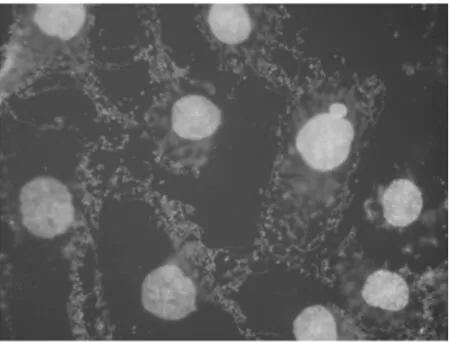
圖11 正常SKOV3細胞×1000(熒光顯微鏡)
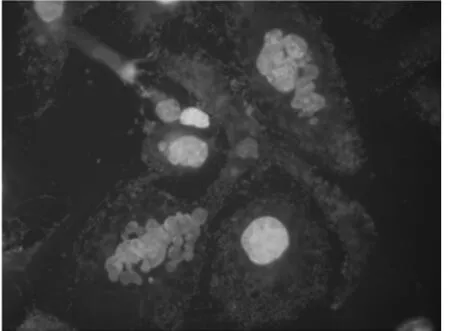
圖12 實驗組SKOV3細胞×1000(熒光顯微鏡)
紫杉醇的抗腫瘤作用靶點在微管上[6],通過抑制微管解聚,干擾有絲分裂紡錘體的組裝,染色體不能分離,使腫瘤細胞阻滯在G2、M期,最終達到抗腫瘤的目的[7-8]。高鵬[9]報道紫杉醇可以阻斷微管網的重建路徑,將癌細胞的分裂控制在G2/M階段,抑制癌細胞擴散。胞漿內Ca2+可以調控微絲的構架分布,低濃度時可阻斷微絲末端的延伸,高濃度時可將其切成片段。微管的組裝與解聚受到鈣離子濃度的影響,低濃度時促進組裝,高濃度時促使其解聚,而微管的解聚也會促使胞外鈣離子向細胞內流動,進而造成細胞內鈣離子濃聚[10]。本實驗中,TAX-NLC作用KB、SKOV3細胞后,細胞內Ca2+濃度迅速升高,隨后出現F-actin變性,聚集成點狀、團塊狀,從而使細胞喪失功能,最后死亡。說明胞內Ca2+濃度增加在TAX-NLC的抗腫瘤機制方面發揮了重要作用。
本實驗中,對照組熒光強度隨時間的延長也輕微的逐漸升高,可能是由于激光的照射激發細胞外的鈣離子向細胞內流動,游離鈣與Fluo-3結合,從而顯示熒光強度增加。KB細胞對照組去本底后熒光強度最高值為12,SKOV3細胞對照組在相同時相點為11,相差不是太大。實驗組KB細胞鈣離子濃度去本底后最大值為68,是細胞外鈣離子濃度的5.6倍;實驗組SKOV3細胞內鈣離子濃度去本底后最大值為38,是細胞外鈣離子濃度的3.4倍;而KB細胞的胞內鈣離子濃度大約是SKOV3細胞內鈣離子濃度的1.7倍。TAXNLC可能是啟動了某種機制,使細胞內的鈣離子濃度升高,致使F-actin形態異常,功能障礙,進而導致微絲功能喪失,最終細胞死亡。細胞內鈣離子濃度升高的原因,目前還不十分清楚。一方面可能是激光的照射導致細胞內結合鈣的解離或者是細胞外鈣離子的內流;另一方面可能是微管十分穩定,不能解聚,反饋機制要求鈣離子濃度升高,促使微管解聚,進而導致鈣離子濃度的升高。TAX-NLC作用后KB細胞鈣離子濃度比SKOV3的濃度高,可能KB細胞對TAX-NLC更敏感,也可能KB細胞惡性程度更高。SKOV3細胞開始時就有較高鈣離子濃度,而后又緩慢升高,而KB細胞的鈣濃度開始時就從較低水平逐漸的升高,說明SKOV3細胞在加入TAX-NLC的即刻就有產生了大量的游離鈣,而KB細胞的游離鈣是通過TAX-NLC作用后逐漸釋放的。
100 nmol/L的TAX-NLC對KB細胞的抑制率約為SKOV3細胞的1.5倍,與細胞內鈣離子濃度變化的結果基本是一致的,即抑制率與細胞內鈣離子濃度是密切相關聯的。TAX-NLC對KB細胞有較強的抗腫瘤作用,可能是因為它將更多的TAX載入到細胞內。TAX-NLC可能僅改變其劑型和跨膜的性能,而TAX本身的抗腫瘤特性并沒有發生改變。張麗等實驗結果證實[11],TAX與紫杉醇脂質體對細胞抑制機制相似。
正常培養細胞中ASG細胞很少會形成多核巨細胞,但TAX作用于ASG細胞后會形成大量多核巨細胞。多核瘤細胞的形成是細胞死亡前的特征性表現之一[12-13]。TAX作用于微管,阻止了紡錘絲的形成,細胞核可以正常的分裂,而細胞漿不能正常的分裂,進而一個胞漿內可見多個細胞核,形成多核細胞。曾春等[14]研究發現TAX作用骨肉瘤U-2OS細胞后,出現大量多核細胞,其數量隨藥物濃度及作用時間的增加而增加。本實驗中,100 nmol/L的TAX-NLC對KB、SKOV3細胞作用后,產生大量的多核細胞,有的可見多核巨細胞,兩者比較差異有統計學意義,TAX-NLC誘導KB細胞產生的多核細胞比例約為SKOV3細胞的1.5倍,此結果與細胞抑制率、細胞內鈣離子濃度基本相一致。TAX-NLC作用KB、SKOV3細胞,使細胞內鈣離子濃度增高,導致F-actin功能障礙,進而使細胞的微管系統的平衡遭到破壞,導致細胞生長抑制,產生大量的多核細胞,最后細胞死亡。
Shi-Mun等[15]研究認為多核細胞的出現和細胞凋亡有一定的關系,表達突變型p53的細胞可以打亂細胞周期的阻滯,出現多核細胞,表達野生型p53的細胞出現有絲分裂的阻滯,在某些因素的影響下,出現細胞凋亡。不依賴p53基因的細胞也可以產生多核細胞。成纖維細胞,在松胞素的作用下,細胞核正常分裂,而細胞質失去正常分裂能力,形成的雙核細胞,而且還可以進入下一個周期,并沒有出現細胞凋亡。TAX-NLC作用KB、SKOV3細胞后,產生大量的多核細胞,其產生的原因可能與p53基因有一定的關系。
TAX-NLC 與TAX具有相似的抗腫瘤機制,作用于微管系統,使細胞內鈣離子濃度增加,使F-actin聚集成團塊狀、點狀,微絲的功能受到影響,有的形成多核細胞,最終導致細胞死亡。TAX-NLC改變了劑型,更利于用藥,療效更好,有著廣泛的應用前景。
[1] Kutuk O, Letai A. Displacement of Bin by Bmf and Puma rather than increase in Bim level mediates paclitaxl-induced apoptosis in breast cancer celld[J]. Cell Death Differ, 2010,17(10):1624-1635.
[2] Dhanikula R S, Dhanikula A B, Panchanula R, et al.Thermoreversible liposomal poloxamerel for the delivery of paclitaxel:dose proportionality and hematological toxicity studies[J]. Pharmazie,2008,63(6):439-445.
[3]張春芳. 紫杉醇注射液60例藥物不良反應分析[J]. 中國醫學創新,2012, 9 (23) :146-147.
[4]劉圣活,帥心濤,周建華,等. MG7抗體靶向紫杉醇納米藥物對胃癌治療的研究[J]. 中國醫學創新,2011, 8(17):3-5.
[5]劉敏,李智慧,許玉杰. 納米化紫杉醇與電離輻射對KB細胞聯合作用的研究 [J]. 蘇州大學學報(醫學版),2011, 31(1):16-20.
[6]許成貴. 紫杉醇聯合化療對中晚期胃癌的臨床療效觀察及抗癌作用機制的探討[J]. 中國醫學創新,2013, 10(16):34-36.
[7] Srivastava V, Negi A S, Kumar J K, et al. Plant-based anticancer molecules: A chemical and biological profile of some important leads[J].Bioorganic ﹠ Medicinal Chemistry, 2005,13(21):5892-5908.
[8] Anil K S, Alka G, Deepika A. Paclitaxel and its formulations[J]. Int J Pharm, 2002,235(122): 179-192.
[9]高鵬. 周劑量紫杉醇聯合表阿霉素治療晚期乳腺癌的臨床觀察[J].中國醫學創新,2014, 11(36):43-44.
[10] Hill P B, Dora K A, Hughes A D. The involvement of intracellular Ca2+in 5-HT (1B/1D) receptor-mediated contraction of the rabbit isolated renal artery[J]. Br J Pharmacol, 2000, 130(4): 835-842.
[11]張麗,佟仲生,李淑芬,等. 紫杉醇脂質體對乳腺癌MCF-7細胞生長抑制作用的機制[J]. 腫瘤防治研究,2013,40(2):138-143.
[12] Reinecke P, Knopf C, Schmitz M, et al. Growth inhibitory effects of Paclitaxel on human epitheliod sarcoma in vitro[J].Cancer,2000,88(7):1614-1622.
[13] Swanson P E, Carroll S B, Zhang X F, et al. Spontaneous premature chromosome condensation, micronucleus formation,and non-apoptotic cell death in heart Hela S3 cell Ultrastructural observations[J].Am J Pathol,1995,146(4):963-971.
[14]曾春,郭衛,馮傳漢. 紫杉醇誘導骨肉瘤細胞系凋亡的體外研究 [J].中華骨科雜志,2002, 22(11):675-679.
[15] Shi-Mun Kim, Rockki Kim, Jae-Hyun Ryu, et al. Multinuclear giant cell formation is enhanced by down-regulation of Wnt signaling in gastric cancer cell line, AGS [J]. Experimental Cell Research, 2005,308(1): 18-28.

