eha基因調控遲緩愛德華菌抵抗巨噬細胞氧化殺菌作用
徐澤炎,李玉紅,成 靜,鄭恩金,高大慶,盛安康,陸承平
·論 著·
eha基因調控遲緩愛德華菌抵抗巨噬細胞氧化殺菌作用
徐澤炎1,李玉紅2,成 靜1,鄭恩金2,高大慶2,盛安康2,陸承平3
目的 遲緩愛德華菌(E.tarda)能夠在巨噬細胞內生存和繁殖,必須抵抗細胞產生活性氧的殺菌作用。eha基因是該菌一個重要的轉錄調控基因,本研究探討eha基因調控E.tarda抵抗巨噬細胞氧化殺菌的機制。方法 光鏡觀察野生株和缺失株分別感染RAW264.7巨噬細胞的過程,及菌落計數法測定細菌胞內存活數目;測定細菌在不同H2O2濃度中的存活率;流式法檢測細菌感染巨噬細胞后產生活性氧的細胞比率;qRT-PCR測定細菌超氧化物歧化酶基因sodC和過氧化氫酶基因katB的轉錄水平。結果eha基因的缺失,使E.tarda在巨噬細胞內的繁殖速率明顯下降(P<0.05),使該菌在不同H2O2濃度中的存活率顯著降低(P<0.05),使該菌感染細胞組產生活性氧的細胞比率升高;qRT-PCR結果顯示,eha基因的缺失使得該菌的超氧化物歧化酶基因sodC和過氧化氫酶基因katB轉錄水平下降。結論eha基因通過調控E.tarda菌分解H2O2相關基因的表達,從而影響該菌分解巨噬細胞中活性氧的能力和在胞內外的存活率。因此,eha基因調控了E.tarda菌抵抗巨噬細胞內氧化殺菌作用,有助于該菌在巨噬細胞內生存和繁殖。
eha基因;巨噬細胞;E.tarda;活性氧
遲緩愛德華菌(Edwardsiellatarda,簡稱E.tarda)屬于腸桿菌科愛德華菌屬,分布廣泛,可感染魚類、兩棲類、爬行類、鳥類及哺乳類等。該菌能夠引起多種魚類感染,是水產養殖業的重要病原體[1]。該菌能夠在巨噬細胞中生存和繁殖, 必須抵抗細胞產生活性氧(reactive oxygen species,ROS)的殺菌作用[2-3]。
高大慶等用鳥槍法在E.tarda中發現的一個溶血調控基因(Et haemolysin activator gene,簡稱eha),前期的研究表明Eha蛋白是E.tarda菌一個重要的轉錄調控因子[4-5]。本研究發現,和野生株相比,eha缺失株在巨噬細胞內繁殖速率和在不同濃度過氧化氫的存活率明顯下降,并探討eha基因調控E.tarda抵抗巨噬細胞氧化殺菌的機制。
1 材料與方法
1.1 材料
1.1.1 菌株和培養基 強毒株E.tarda菌ET-13由南京農業大學陸承平教授惠贈。ET-13的eha缺失株(Δeha)和Δeha互補株(ehaComp)由本室保存。細菌采用LB(Luria Broth)培養基來培養。
1.1.2 小鼠巨噬細胞 RAW264.7,巨噬細胞為上海獸醫研究所王少輝博士惠贈。胎牛血清(FBS)、胰蛋白酶購自Hyclone公司;DMEM培養液購自Gibco公司。
1.2 方法
1.2.1 細菌胞內存活實驗 以100∶1的感染復數MOI(multiplicity of infection) 將對數期細菌,加入單層細胞中,共孵育1 h后,PBS漂洗細胞3遍,再用含100 μg/mL慶大霉素的細胞培養液孵育1 h,換含10 μg/mL慶大霉素的細胞培養液繼續培養2 h,4 h或6 h;在預定時間點,用PBS洗細胞3次,加入含1% Triton X-100的PBS裂解10 min,將裂解產物10倍系列稀釋后,涂在LB瓊脂平板上;37 ℃培養24 h,進行菌落記數(cfu/mL)。每次試驗設3個平行組,取平均值,并重復3次;以培養時間為橫坐標,CFU/mL為縱坐標,繪制細菌胞內細菌數目和時間的曲線。
1.2.2 光鏡下觀察 細菌感染細胞的方法同上,收集細胞;固定細胞,用姬母薩染液染色細胞和細菌。在油鏡下觀察,細菌被染成紫紅色或紫藍色,而細胞質則被染成淺紅色。
1.2.3 體外應激實驗 按參考文獻[6]的方法檢測各種濃度過氧化氫處理后細菌的存活率。
1.2.4 巨噬細胞產生活性氧的檢測 以10∶1 MOI的對數期細菌感染RAW264.7細胞2 h后,將10 μmol/L DCFH-DA的DMEM培養液500 μL懸浮細胞,37 ℃培養20 min。用流式細胞儀(激發波長485 nm,發射波長530 nm) 檢測細胞產生活性氧(reactive oxygen species, ROS)的細胞比率,設置未添加菌液細胞的孔為陰性對照。
1.2.5 qRT-PCR 按試劑盒說明書,提取細菌RNA, RNA逆轉錄成cDNA。再以cDNA為模版,用超氧化物歧化酶基因(superoxidedismutaseC,sodC)的引物(F-GACCGCCAGCCAAAGGTCCA,R-GCGAGTCGACTACGCGGACT)和過氧化氫酶基因(catalaseB,katB)的引物(F-ATGCGGGTCGGACGTGCCAG,R- TCCACGGGCCGTAGCGACA)分別擴增兩基因,以擴增16SrRNA基因(F- TAGGTCGCTTAGGACATCTC,R- AGGGCCGGCTTGGCGACCGT)作為內標參照,定量檢測各基因的轉錄水平。
1.2.6 統計學分析 細菌的存活率之間的比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 比較E.tarda野生株和eha缺失株在巨噬細胞內存活的差異 從圖1中可以看出,用野生株和eha缺失株分別感染RAW264.7細胞1 h,高濃度慶大霉素殺胞外菌1 h,再低濃度慶大霉素繼續培養,以抑制胞外菌的繁殖。用1% Triton X-100裂解細胞,釋放胞內細菌,涂平板進行菌落計數(cfu/mL)。結果顯示,胞內cfu/mL隨培養時間呈上升趨勢,這表明野生株和eha缺失株均可在巨噬細胞內存活并繁殖。和野生株相比,在繼續培養4 h和6 h時,eha缺失株感染的細胞內細菌cfu/mL明顯降低(P<0.05),表明eha基因對于E.tarda在巨噬細胞內的繁殖起重要的作用。互補株的變化趨勢介于野生株和eha缺失株之間。
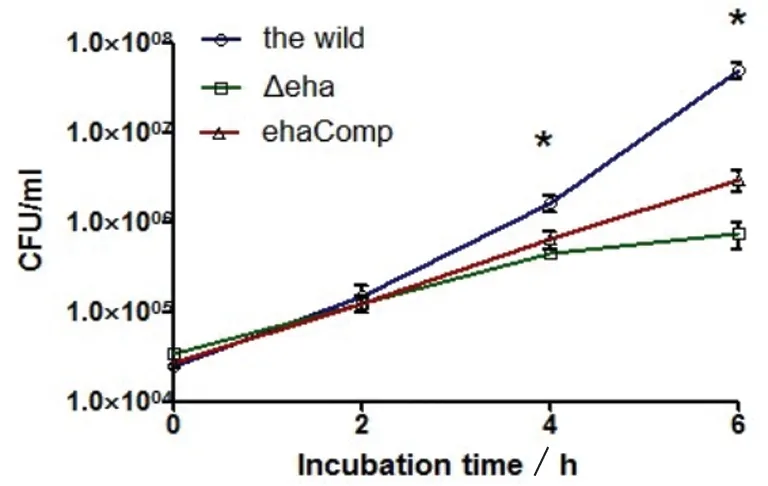
圖1 比較E.tarda菌 ET-13野生株、eha缺失株和互補株在巨噬細胞內細菌數目的差異
2.2 光鏡下觀察野生株和eha缺失株在巨噬細胞內存活的差異 圖2 結果顯示,A和B是未感染細菌的RAW264.7細胞;C和D分別是RAW264.7細胞感染野生株和eha缺失株1 h,慶大霉素處理1 h后,可見胞內細菌;E和F分別是RAW264.7細胞感染野生株和eha缺失株1 h,慶大霉素處理1 h,再繼續培養2 h后,可見細胞內細菌數量增多;G和H分別是RAW264.7細胞感染野生株和eha缺失株1 h,慶大霉素處理1 h,再繼續培養6 h后,野生株在巨噬細胞內的數量大量增多,明顯多于eha缺失株。
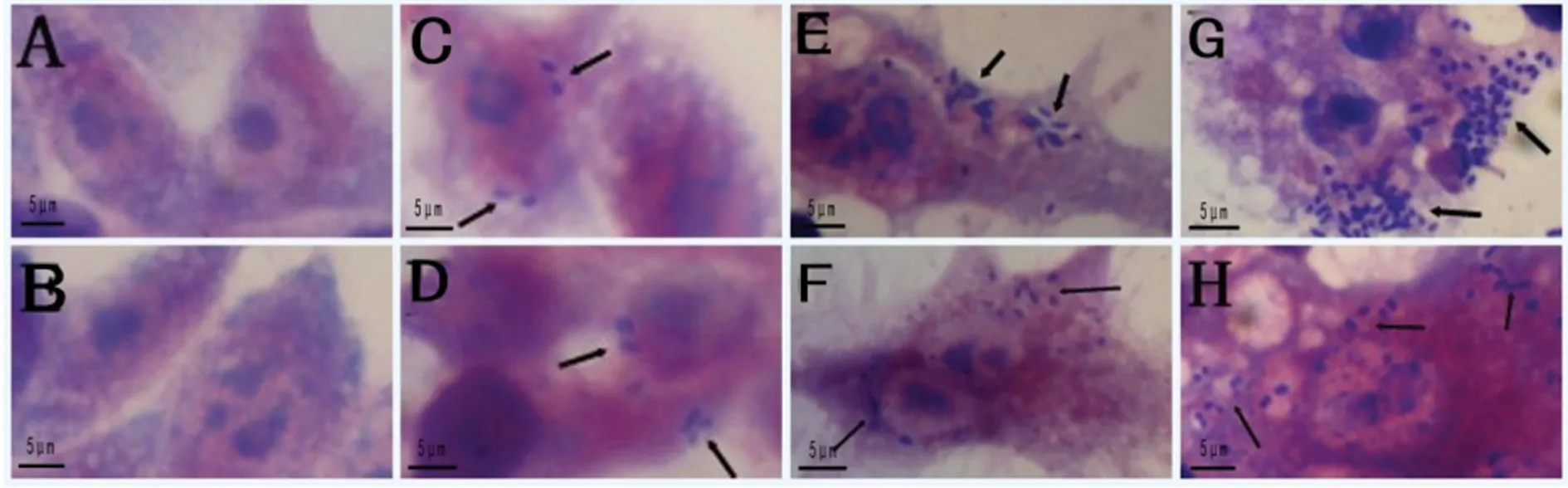
A and B :Uninfected RAW264.7 macrophages; C and D:RAW264.7 Infected with the wild and the Δeha for1 hours , and handled with gentamycin for 1 h; E and F:Incubated for 2 hours after C and D; G and H: Incubated for 6 hours after C and D. The arrows show the intracellular bacteria.
圖2 光鏡下觀察野生株和eha缺失株在巨噬細胞內細菌數目的差異(×10 000)
Fig.2 Comparison of the differences of the survival rates of the wild and the Δeha of ET-13 within macrophages under light microscope(×10 00)
2.3 細菌經過氧化氫處理后的存活率 模擬細菌在巨噬細胞吞噬溶酶體氧化的環境,分別用不同濃度1 mmol/L、2 mmol/L、5 mmol/L、10 mmol/L的過氧化氫處理細菌30 min后,eha缺失株的存活率明顯低于野生株(P<0.05),互補株的存活率介于缺失株和野生株之間,結果如圖3所示。
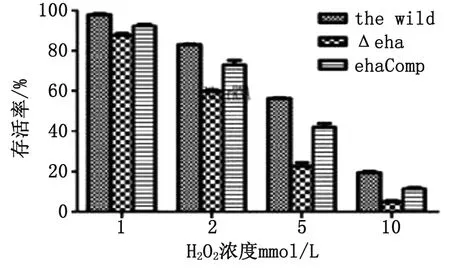
圖3 比較ET-13野生株、缺失株和互補株經過氧化氫處理后細菌存活率的差異
Fig.3 Comparison of the differences of survival rates of the wild,the Δeha and the ehaComp of ET-13
2.4 比較E.tarda野生株和eha缺失株刺激巨噬細胞產生活性氧的差異 收集細胞,檢測細胞產生活性氧的細胞比率。流式結果如圖4。加熒光探針未感染的細胞(圖B)中產生活性氧的細胞比率為23.15%,高于未加熒光探針未感染的細胞組(圖A),說明感染細菌后巨噬細胞產生活性氧的細胞比率相對未感染的細胞組高;eha缺失株感染細胞組(圖D,65.49%)高于野生株組(圖C,55.32%),互補株組(圖E,56.10%)接近野生株組。
2.5 qRT-PCR顯示eha基因對E.tarda和ROS相關基因的調控作用 由StepOnePlus Real-time PCR System Software得出數據,eha缺失株中超氧化物歧化酶基因sodC和過氧化氫酶基因katG的轉錄水平分別為野生株的0.1倍和0.42倍。因此,和野生株相比,Δeha缺失株中sodC 和katB的轉錄水平降低,結果提示E.tarda中eha基因對抗氧化相關的基因有正調控作用。
3 討 論
E.tarda通過消化道粘膜和皮膚傷口感染宿主,被巨噬細胞等主要的固有免疫細胞吞噬,可在其中存活和繁殖,最后裂解細胞質膜,釋放進入淋巴和血液,并感染全身[2]當巨噬細胞與E.tarda菌接觸后,細菌表面的多種物質可激活巨噬細胞細胞膜的NADPH氧化酶,從而引起呼吸爆發,產生反應性氧中介物(reactive oxygen intermediate, ROI)或反應性氮中介物(reactive nitrogen intermediate,RNI)導致細菌損傷,如發生DNA突變、膜蛋白發生氧化變性失活等,從而殺死細菌。E.tarda菌產生各種酶分解巨噬細胞呼吸暴發產生的活性氧,逃避巨噬細胞的殺傷作用,達到在胞內存活和增殖的目的,最終導致疾病的發生[7]。E.tarda產生的過氧化氫酶(Kat B)和超氧化物歧化酶(SodB)可以幫助細菌將有毒害的氧化物降解為水和氧氣[8]。
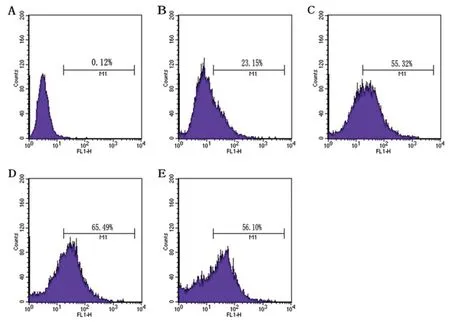
A: Uninfected and with no fluorescent probes; B: added by fluorescent probes and uninfected; C: added by fluorescent probes and infected with the wild; D: added by fluorescent probes and infected with the Δeha; E:added by fluorescent probes and infected with the ehaComp.
圖4 比較 ET-13野生株、eha缺失株和互補株感染后巨噬細胞中產生活性氧細胞比率的差異
Fig.4 Comparison of the differences of the rate of cells produced ROS by the macrophages infected the wild,the Δeha and the ehaComp of ET-13
本研究表明E.tarda毒力株ET-13野生株和eha缺失株均能夠在巨噬細胞內生存和繁殖,但eha缺失株在胞內繁殖速率明顯降低。和野生株相比,其eha缺失株在不同濃度H2O2下生存能力降低,和缺失株產生過氧化氫酶和超氧化物歧化酶的產量減少有關,因此,eha基因可以調控E.tarda一些基因抵抗巨噬細胞氧化殺菌作用。
[1]Chen AP,Jiang YL,Qian D et al. Edwardsiellasis[J].China Fisheries,2011,7:49-50.(in Chinese) 陳愛平,江育林,錢冬,等. 遲緩愛德華氏菌病 [J].中國水產,2011,7:49-50.
[2]Leung KY, Siame BA, Tenkink BJ,et al.Edwardsiellatarda- Virulence mechanisms of an emerging gastroenteritis pathogen .Microbes Infect, 2012;14(1):26-34. DOI:10.1016/j.micinf. 2011.08.005.
[3]Ishibe K, Osatomi K, Hara K, et al. Comparison of the responses of peritoneal macrophages from Japanese flounder (Paralichthys olivaceus) against high virulent and low virulent strains ofEdwardsiellatarda[J]. Fish Shellfish Immunol,2008,24(2):243-51. DOI:10.1016/j.fsi.2007.11.001.
[4]Gao DQ, Kan B, Lu CP,et al. Primary Analysis and Sequencing the Hemolytic Relative Gene ofEdwardsiellatarda[J].J Genetics Genomics. 2001,25(12):1162-1167.(in Chinese) 高大慶,闞飆,陸承平,等.遲緩愛德華菌溶血相關基因的測序和初步的功能分析[J].遺傳學報,2001,25(12):1162-1167.
[5]Gao DQ, Cheng J, Zheng EJ,et al. Eha, a transcriptional regulator of hemolytic activity ofEdwardsiellatarda[J]. FEMS Microbiol Lett 2014,353(2),132-140. DOI:10. 1111/1574 -6968.12420.
[6]Pan HJ, Hao B, Li J,et al, Impact of Cpx on the virulence ofEdwardsiellatarda[J]. Marine Sci, 2013,37(2):17-21. (in Chinese) 潘海建,郝斌,李杰,等. Cpx 對遲緩愛德華氏菌毒力的影響[J].海洋科學,2013,37(2):17-21.
[7]Srinivasa Rao PS, Lim TM, Leung KY. Opsonized virulentEdwardsiellatardastrains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates[J]. Infect Immun,2001,69(9):5689-5697.DOI:10.1128/IAI.69.9.5697.2001.
[8]Cheng S, Zhang M, Sun L. The iron-cofactored superoxide dismutase ofEdwardsiellatardainhibits macrophage-mediated innate immune response [J]. Fish Shellfish Immunol,2010,29(6):972-978. DOI:10.1016/j.fsi. 2010.08.004.
Gao Da-qing,Email: dgao2@yahoo.com
ehagene is required forEdwardsiellatardaoxidative stress resistance in macrophage
XU Ze-yan1,LI Yu-hong2,CHENG Jing1,ZHENG En-jin2,GAO Da-qing2,SHENG An-kang2,LU Cheng-ping3
(1.SchoolofMedicine,JiangsuUniversity,Zhenjiang212000,China; 2.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China; 3.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
AsEdwardsiellatarda(E.tarda)can survive and replicate in macrophages, it must resist against reactive oxygen species (ROS) produced by the cells. The haemolysin activator gene (eha) is an important transcriptive regulating gene.Our researches studied the mechanism for theehagene how to regulateE.tardato resist oxidation stress in macrophages. After the bacteria have infected RAW264.7 macrophages, bacterial colonies were counted on LB plates. The results of the above experiment and the observation under optical microscope indicated that both the wild and the Δehastrains can survive and multiply within macrophages, and the reproductive rate of the Δehawithin macrophages decreased obviously than that of the wild. The survival rate of the Δehain H2O2was less than that of the wild. After the level of ROS from macrophages infected with bacteria were detected by flow cytometry(FCM), the ROS from the macrophages infected with the Δeha(65.49%) was more than that of the wild (55.32%). The qRT-PCR results showed further that the mutation of theehagene regulated down the expressions of catalase and superoxide dismutase genes inE.tarda. Therefore, the results indicated thatehagene has affected bacterial ability of decomposing ROS in macrophages and survival ability in H2O2,as the gene may control the expressions of catalase and superoxide dismutase genes inE.tarda.
ehagene;macrophage;Edwardsiellatarda; ROS
高大慶,Email:dgao2@yahoo.com
1.江蘇大學醫學院,鎮江 212000; 2.東南大學醫學院,南京 210009; 3.南京農業大學動物醫學院,南京 210095
Supported by the Doctor Inovation Fund of Jiangsu Province(No. CX10B-283z), and the Natural Science Foundation of Jiangsu(No.SBK2015022394)
10.3969/cjz.j.issn.1002-2694.2015.06.001
R378.2
A
1002-2694(2015)06-0497-04
2014-06-11;
2014-11-09
江蘇省博士研究生創新課題基金(No.CX10B-283z)資助和江蘇省自然科學基金聯合資助(No.SBK2015022394)

