雞傳染性法氏囊病病毒BC6/85株VP2基因的原核表達、純化及鑒定
劉丹,楊承槐,吳華偉,李啟紅,高金源,陳建,郎洪武
(中國獸醫藥品監察所,北京100081)
雞傳染性法氏囊病病毒BC6/85株VP2基因的原核表達、純化及鑒定
劉丹,楊承槐,吳華偉,李啟紅,高金源,陳建,郎洪武?
(中國獸醫藥品監察所,北京100081)
為獲得可用于雞傳染性法氏囊病病毒(IBDV)抗體檢測的重組抗原VP2蛋白,根據GenBank中發表的IBDV VP2序列設計一對特異性引物,應用RT-PCR技術克隆IBDV經典標準攻毒株(BC6/85株)的VP2基因,插入質粒pET-32a中構建重組表達質粒pET-32a-VP2,經IPTG誘導后獲得了以包涵體形式表達的重組蛋白。重組蛋白純化后,Western-blot檢測表明具有良好的反應原性。本研究為下步建立IBDV抗體的間接ELISA方法及新型疫苗的研制奠定了基礎。
雞傳染性法氏囊病病毒;VP2基因;克隆;原核表達
雞傳染性法氏囊病病毒(Infectious Bursal Disease Virus,IBDV)屬于雙RNA病毒科,其基因組由A和B兩個雙鏈RNA片段組成,編碼5種病毒蛋白,分別為VP1、VP2、VP3、VP4和VP5[1]。其中VP2是IBDV的主要結構蛋白和宿主保護性抗原,含有能誘導中和抗體的抗原決定簇,其誘導產生的中和抗體能被動地保護宿主免受IBDV的感染[2-3],VP2還與病毒毒力、病毒抗原變異及細胞凋亡等有關[4-5],已成為近年來眾多學者研究的熱點。
眾多研究人員利用VP2的免疫原性研究抗IBD的基因工程疫苗,已經在大腸桿菌、重組桿狀病毒、酵母等諸多表達系統中,成功表達VP2蛋白[6-8]。這些表達系統表達的VP2蛋白都能誘導產生較高的中和抗體,并且國內已有商品化的基因工程亞單位疫苗[9],但利用VP2建立相關檢測方法的研究卻甚少。為了建立監測IBDV抗體的ELISA方法和研究VP2蛋白的免疫原性,本試驗對IBDV經典標準攻毒株(BC6/85株)的VP2基因進行克隆并構建其原核重組表達載體,進行誘導表達、純化和鑒定,旨在獲得可用于IBDV抗體檢測的重組抗原VP2蛋白,為IBDV抗體檢測方法的建立和基因工程疫苗的研究提供基礎。
1 材料與方法
1.1 材料
1.1.1 病毒、細菌和載體 IBDV BC6/85株,由中國獸醫藥品監察所菌種保藏中心提供;E.coli TOP10感受態細胞,購于天根生化科技有限公司;Rosetta(DE3)感受態細胞,購于康為世紀生物科技有限公司;pMD18-T載體,購于大連寶生物工程有限公司;pET-32a載體由本實驗室保存。
1.1.2 主要試劑 Ex Taq DNA聚合酶、dNTPs、EcoR Ι、Xho Ι、Marker DL2000、Marker DL15000,2×SDS-PAGE loading buffer,蛋白Marker,均購自大連寶生物工程有限公司;質粒提取試劑盒、膠回收試劑盒、Trizol?Reagent試劑盒均購自天根生化科技有限公司;Donkey anti-chicken IgY購自康為世紀生物科技有限公司;IPTG為Sigma公司產品。其他化學試劑均為分析純級試劑。
1.2 方法
1.2.1 引物的設計與合成 根據GenBank中發表的IBDV基因組序列,利用引物設計軟件Primer 5.0設計一對特異性引物,由北京Invitrogen公司合成。上游引物P1:CGAATTCATGACAAACCTG?CAAGAT,下游引物P2:CCGCTCGAGTCACCT? TAGGGCCCGGATTAT,為方便目的基因的克隆及表達,在上、下游引物的5’端分別引入EcoR Ι和Xho Ι酶切位點(以下劃線指示),VP2基因的擴增長度約為1356 bp。
1.2.2 IBDV總RNA的提取 按照Trizol?Reagent試劑盒說明書提取病毒總RNA。
1.2.3 IBDV VP2基因的RT-PCR擴增 按照反轉錄試劑盒說明書進行第一鏈cDNA的合成。以cDNA為模板,進行PCR擴增,反應體系如下:10×PCR buffer 5 μL,dNTPs(2.5 mmol/L each)4 μL,P1和P2引物(濃度均為10 μmol/L)各1 μL,cDNA模板5 μL,Ex Taq DNA聚合酶0.5 μL,補加ddH2O至50 μL。反應條件為:95℃預變性5 min;94℃30 s,52℃45 s,72℃45 s,共30個循環;72℃10 min。反應結束后取5 μL進行瓊脂糖凝膠電泳,觀察擴增結果。PCR產物經瓊脂糖凝膠電泳后,用DNA回收試劑盒回收預期的目的片段。
1.2.4 IBDV VP2基因的克隆與鑒定 將回收的目的片段連接到pMD18-T載體上,轉化TOP10感受態細胞,獲得重組質粒pMD18T-VP2。將PCR和酶切鑒定均正確的重組質粒送Invitrogen公司測序。
1.2.5 原核表達載體的構建與鑒定 將陽性重組質粒pMD18T-VP2用EcoR Ι和Xho Ι雙酶切后回收并純化,與同樣雙酶切的原核載體pET-32a進行連接,得到重組原核表達載體pET-32a-VP2,經PCR和酶切鑒定正確后,送Invitrogen公司測序。
1.2.6 pET-32a-VP2的誘導表達與條件優化 將重組質粒pET-32a-VP2轉化至表達菌株Rosetta(DE3),挑取單個菌落接種含Amp+的LB培養基中,37℃培養至OD600=0.8時,加入IPTG至終濃度為1 mmol/L,在誘導后1、2、3、4、5、6 h分別取出1 mL,離心2 min收集菌體,用PBS重懸沉淀,加入等體積2×SDS上樣緩沖液,水浴煮沸10 min,進行SDS-PAGE凝膠電泳以確定IPTG的最佳誘導時間。
分別取1 mL培養物5份,加入IPTG至終濃度分別為0.1、0.5、1.0、2.0、4.0 mmol/L,按上法進行誘導表達和處理,SDS-PAGE檢測表達情況,以確定IPTG的最佳誘導濃度;在IPTG濃度為1 mmol/L時,在25℃、30℃和37℃分別對重組菌進行誘導表達,誘導時間為5 h,以確定最佳誘導溫度。
1.2.7 重組蛋白的純化和鑒定 重組菌按優化好的條件進行誘導表達后,離心收集菌體,超聲波裂解菌體,分別收集上清及沉淀進行SDS-PAGE蛋白電泳,確定表達產物是可溶性蛋白還是包涵體蛋白。對重組蛋白進行過柱純化,純化步驟參考王倩倩等方法[10]。應用Western-blot鑒定純化的重組蛋白,步驟如下:將純化的蛋白進行SDS-PAGE電泳,轉印2 h,封閉2 h;PBST洗滌3次,加入PBS稀釋的雞傳染性法氏囊病陽性血清(1∶500稀釋)或His單抗,作用1 h;PBST洗滌3次,加入1∶10000稀釋的Donkey anti-chicken IgY或HRP標記的羊抗鼠二抗,作用1 h;PBST洗滌3次,用TMB顯色試劑盒進行顯色,觀察結果。
2 結果
2.1 VP2基因的RT-PCR擴增 應用所設計的特異性引物對IBDV BC6/85株的VP2基因進行RT-PCR擴增,得到一條長度約為1356 bp的目的條帶(圖1),與預期片段大小一致。
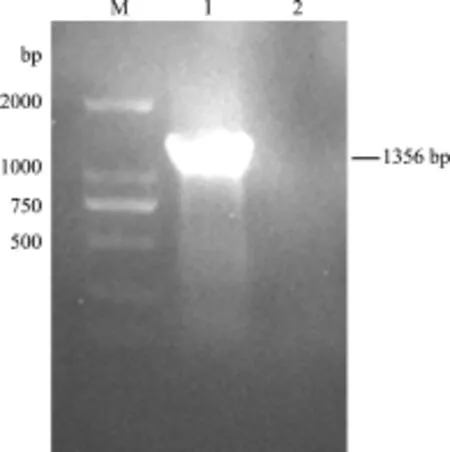
圖1 IBDV BC6/85株VP2基因的RT-PCR擴增
2.2 pMD18T-VP2的PCR和酶切鑒定 將重組質粒pMD18T-VP2進行PCR鑒定,可擴增出1356 bp大小的特異片段;經EcoR Ι和Xho Ι雙酶切鑒定,可獲得與預期大小一致的片段(圖2)。將PCR和酶切鑒定正確的重組質粒送Invitrogen公司測序,測序結果表明,成功構建了pMD18T-VP2重組質粒。

圖2 pMD18T-VP2的PCR和酶切鑒定
2.3 VP2基因原核表達載體的構建與鑒定 將經PCR初步鑒定為陽性的重組原核表達載體pET-32a-VP2,再以EcoR Ι和Xho Ι對其進行雙酶切鑒定,結果顯示出現兩條條帶,一條為約5900 bp的載體片段,一條約為1356 bp大小的目的基因片段(圖3),對重組質粒的測序結果表明原核重組表達質粒構建成功。

圖3 pET-32a-VP2的PCR和酶切鑒定
2.4 pET-32a-VP2的誘導表達與條件優化
2.4.1 最佳誘導時間的確定 將重組質粒pET-32a-VP2轉化至表達菌株Rosetta(DE3),進行誘導表達,SDS-PAGE結果表明,誘導5 h時表達量最高(圖4)。
2.4.2 IPTG誘導濃度的確定 由圖5可知,IPTG濃度在1 mmol/L時,表達量最高,故確定該濃度為最佳誘導濃度。
2.4.3 最佳誘導溫度的確定 在25、30和37℃分別對重組菌進行誘導表達,SDS-PAGE結果顯示在37℃時表達量最高,確定為最佳的誘導溫度(圖6)。
2.5 重組蛋白純化及鑒定
2.5.1 重組蛋白可溶性分析結果 重組菌在37℃、1 mmol/L IPTG誘導表達5 h,離心收集菌體,超聲波裂解菌體,分別收集上清及沉淀進行SDS-PAGE蛋白電泳,由圖7可以看出,在上清中未見預期蛋白條帶,在沉淀中可見預期的蛋白條帶,說明表達的蛋白主要以包涵體形式存在。
2.5.2 重組蛋白的純化和Western-blot鑒定 用SDS-PAGE電泳鑒定純化后的表達產物,在65 kD處得到單一的條帶,與預期大小相符,表明純化的產物為VP2蛋白(圖8)。純化的蛋白,經SDS-PAGE后,轉移至硝酸纖維素膜,進行Western-blot鑒定,如圖9所示,復性蛋白能分別被抗His單克隆抗體和雞傳染性法氏囊病陽性血清特異性識別,表明純化的VP2蛋白具有良好的反應原性。
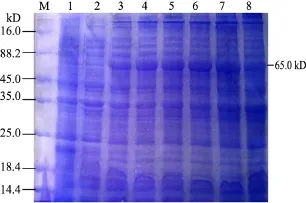
圖4 pET-32a-VP2 IPTG最佳誘導時間的確定
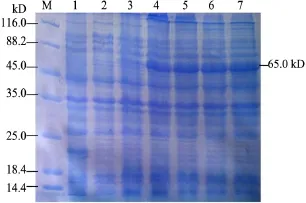
圖5 pET-32a-VP2 IPTG最佳誘導濃度的確定

圖6 pET-32a-VP2 IPTG最佳誘導溫度的確定
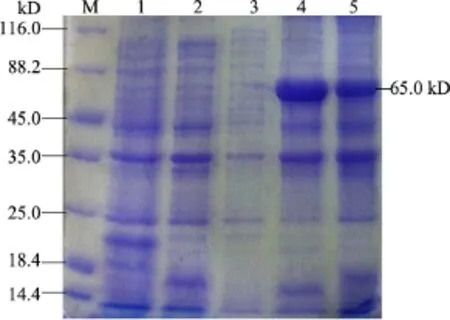
圖7 pET-32a-VP2表達形式的確定
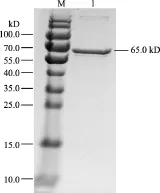
圖8 純化的VP2蛋白SDS-PAGE電泳鑒定圖

圖9 純化的VP2蛋白的Western-blot鑒定圖
3 討論
血清學方法檢測雞群的IBD感染情況和雞群免疫后的抗體水平,有利于建立免疫監測體系、進行疫苗的免疫效力評估和制定合理的免疫程序。國外已有商品化的IBDV抗體ELISA檢測試劑盒,但價格昂貴不利于推廣應用,國內商品化試劑盒大多以全病毒作為包被抗原,進行ELISA檢測時有較強的背景反應和非特異性反應,所以利用表達的蛋白作為包被抗原,建立相關檢測方法,具有廣闊的應用前景。
VP2不僅是IBDV的主要結構蛋白,還是宿主保護性抗原,與中和抗體產生、病毒毒力變異及抗原漂變等有關[11],因此利用VP2來研發基因工程疫苗成為近年來的研究熱點,先后研制了不同表達系統的VP2亞單位疫苗[12-14]。但利用VP2建立ELISA抗體檢測方法的研究卻甚少,為獲得可用于IBDV抗體檢測的重組抗原VP2蛋白,本研究利用大腸桿菌表達系統表達IBDV的VP2蛋白,關鍵問題是選擇合適的表達載體和大腸桿菌表達菌株。最初構建原核表達載體,選擇了pET-28a載體,轉化BL21(DE3)表達菌,SDS-PAGE結果顯示,表達量很低,且表達的目的條帶大小與載體上條帶接近,不利于區分目的條帶。然后考慮使用pET-32a載體,誘導后發現在BL21(DE3)中不表達,改用表達菌株Rosetta(DE3),表達量明顯提高,這可能是由于Rosetta能提供稀有密碼子AUA,AGG,AGA,CUA,CCC和GGA所需的tRNA,從而提高包含稀有密碼子的基因片段的表達量。
VP2蛋白表達后可觀察到約65 kD的條帶,與預期大小一致,這也與國內其他學者原核表達的vp2蛋白大小一致[15-16]。將表達的目的蛋白純化后,用Western blot檢測目的蛋白,一抗為雞傳染性法氏囊病陽性血清,二抗為驢抗雞IgY,結果顯示目的蛋白處出現一條特異性條帶,而空載體對照則沒有,進一步表明表達的目的蛋白是VP2蛋白,并且表達的重組蛋白具有良好的反應原性。本研究為下步研究VP2的免疫原性和建立IBDV抗體檢測方法奠定了基礎。
[1] Muller H,Islam M R,Raue R.Research on infectious bursal disease--the past,the present and the future[J].Vet Microbiol,2003,97(1/2):153-165.
[2] Fahey K J,Erny K,Crooks J.A conformational immunogen on VP-2 of infectious bursal disease virus that induces virusneutralizing antibodies that passively protect chickens[J].J Gen Virol,1989,70(6):1473-1481.
[3] Heine H G,Haritou M,Failla P,et al.Sequence analysis and expression of the host-protective immunogen VP2 of a variant strain of infectious bursal disease virus which can circumvent vaccination with standard type I strains[J].J Gen Virol,1991,72(8):1835-1843.
[4] Cao Y C,Yeung W S,Law M,et al.Molecular characterization of seven Chinese isolates of infectious bursal disease virus:classical,very virulent,and variant strains[J].Avian Dis,1998,42(2):340-351.
[5] Ona A,Luque D,Abaitua F,et al.The C-terminal domain of the pVP2 precursor is essential for the interaction between VP2 and VP3,the capsid polypeptides of infectious bursal disease virus[J].Virology,2004,322(1):135-142.
[6] Jagadish M N,Vaughan P R,Irving R A,et al.Expression and characterization of infectious bursal disease virus polyprotein in yeast[J].Gene,1990,95(2):179-186.
[7] Heine H G,Boyle D B.Infectious bursal disease virus structural protein VP2 expressed by a fowlpox virus recombinant confers protection against disease in chickens[J].Arch Virol,1993,131(3/4):277-292.
[8] 單學強,李明義,高軒.傳染性法氏囊病病毒VP2基因原核表達及抗原性分析[J].動物醫學進展,2012,33(5):18-21.
[9] 農業部公告第865號.雞傳染性法氏囊病基因工程亞單位疫苗[Z].
[10]王倩倩,張改平,王選年,等.IBDV VP2蛋白P22表位多肽的原核表達及初步鑒定[J].河南農業科學,2012,41(5):150-153.
[11]Brown M D,Green P,Skinner M A.VP2 sequences of recent European‘very virulent’isolates of infectious bursal disease virusare closely related to each other but are distinct from those of‘classical’strains[J].J Gen Virol,1994,75(Pt3):675-680.
[12]Macreadie I G,Vaughan P R,Chapman A J,et al.Passive protection against infectious bursal disease virus by viral VP2 expressed in yeast[J].Vaccine,1990,8(6):549-552.
[13]Francois A,Chevalier C,Delmas B,et al.Avian adenovirus CELO recombinants expressing VP2 of infectious bursal disease virus induce protectionagainstbursaldiseaseinchickens[J].Vaccine,2004,22(17/18):2351-2360.
[14]Kim S J,Sung H W,Han J H,et al.Protection against very virulent infectious bursal disease virus in chickens immunized with DNA vaccines[J].Vet Microbiol,2004,101(1):39-51.
[15]杜冬華,周靜,王愛華,等.傳染性法氏囊病病毒HB株VP2蛋白的表達及免疫原性測定[J].動物醫學進展,2013,34(2):71-74.
[16]高玉龍,高宏雷,鄧小蕓,等.雞傳染性法氏囊病毒VP2基因的原核表達與抗原性分析[J].中國生物制品學雜志,2006,19(2):143-145.
(編輯:李文平)
Prokaryotic Expression,Purification and Identification of VP2 Gene of Infectious Bursal Disease Virus BC6/85 Strain
LIU Dan,YANG Cheng-huai,WU Hua-wei,LI Qi-hong,GAO Jin-yuan,CHEN Jian,LANG Hong-wu?
(China Institute of Veterinary Drug Control,Beijing 100081,China)
In order to obtain recombinant VP2 antigen for chicken infectious bursal disease virus(IBDV)antibody detection,a pair of specific primers were designed according to the published sequence of IBDV VP2 gene.The VP2 gene was amplified by RT-PCR from IBDV BC6/85 strain and cloned into pET-32a vector,the recombinant plasmid pET-32a-VP2 was induced by IPTG to get the recombinant protein expressed in inclusion body forms.After the recombinant protein was purified,Western blot detection showed that the expressed protein had good antigenicity and could be used for IBDV antibody detection.The research provides a foundation for IBDV antibody detection research and development of new vaccines.
infectious bursal disease virus;BC6/85Strain;VP2 gene;prokaryotic expression
2014-11-25
A
1002-1280(2015)05-0017-05
S858.31
中國獸醫藥品監察所所級課題(201421)
劉丹,助理研究員,從事豬用疫苗檢驗及相關研究工作。
郎洪武,E-mail:langhongwu@ivdc.org.cn

