附子干姜與辛伐他汀及其聯用治療馬兜鈴酸腎病研究
陳燕喬,張雅倩,王友群
(中國藥科大學 藥理研究室,江蘇 南京 210009)
?
附子干姜與辛伐他汀及其聯用治療馬兜鈴酸腎病研究
陳燕喬,張雅倩,王友群*
(中國藥科大學 藥理研究室,江蘇 南京 210009)
目的:觀察附子干姜、辛伐他汀及聯用對關木通所致馬兜鈴酸腎病模型的影響。方法:將雄性ICR小鼠隨機分為5組:正常組(C)、模型組(M)、附子干姜組(FG)、辛伐他汀組(X)、附子干姜+辛伐他汀組(FGX);模型組及各治療組小鼠灌胃給予關木通水煎劑(7g/kg·d),正常組小鼠灌胃給予等量水,給藥4天后停藥3天,持續4周;各治療組自第3周起分別給予附子干姜(5g/kg·d)、辛伐他汀(10mg/kg·d)、附子干姜(5g/kg·d)+辛伐他汀(10mg/kg·d)。4周后取小鼠血清測定肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)水平,取腎組織測定丙二醛(MDA)、谷胱甘肽(GSH)和γ-谷氨酰轉移酶(γ-GT)濃度,并記錄左腎、左睪丸系數。結果:與模型組比較,各治療組均可降低血清肌酐、尿素氮、尿酸、谷丙轉氨酶、谷草轉氨酶水平,且兩者合用可增加附子干姜對肌酐、尿酸的排泄;與模型組比較,各給藥組均能升高腎組織中γ-GT含量,且FG組與FGX能升高腎組織MDA水平,降低GSH水平。結論:附子干姜與辛伐他汀對馬兜鈴酸腎病均有保護作用,且兩者聯用可相互補充,提高治療馬兜鈴酸腎病的效應。
馬兜鈴酸腎病;腎臟纖維化;附子干姜;辛伐他汀
馬兜鈴酸(Aristolochic acids,AAs)為馬兜鈴科植物的主要次生代謝物,對機體可產生較強的腎毒性、致癌性和致突變作用,其中馬兜鈴酸Ⅰ(AAⅠ)和馬兜鈴酸Ⅱ(AAⅡ)為其主要毒性有效成分[1]。慢性馬兜鈴酸腎病多由長期持續或間斷性小劑量服用含馬兜鈴酸中草藥所導致的腎間質纖維化疾病。研究發現,馬兜鈴酸可通過多種病理機制誘導腎近曲小管上皮細胞凋亡[2],但目前仍缺乏有效的治療方法,因此利用動物模型進行相關研究是有必要的。
關木通性味苦寒,在機體內阻礙氣化,造成陽虛陰盛,形成以寡細胞性腎間質纖維化為主要的病理特征[3],與慢性馬兜鈴酸腎病患者的臨床表現相似。附子具有回陽救逆、溫陽利水、散寒止痛的功效,現代藥理學研究證實附子有改善微循環、抗寒冷和興奮垂體—腎上腺皮質激素等作用[4],常與干姜配伍使用,可達增效減毒的作用。辛伐他汀為常見降血脂藥物,研究發現,他汀類藥物除降脂的腎臟保護作用外,還有非依賴降脂的腎臟保護作用,其作用機制包括抑制藥物在近端腎小管細胞的聚集、產生抗脂質過氧化、減少蛋白尿,下調血管緊張素受體、改善血管內皮細胞功能,從而延緩腎臟損害[5]。本研究目的為探討附子干姜、辛伐他汀及聯合應用對慢性馬兜鈴酸腎病模型小鼠的治療作用及機理。
1 材料
1.1 藥品與試劑
關木通飲片購自南京市百信藥房,黑附子購自于南京市益豐大藥房;干姜購自于南京市先聲藥店,所用中藥材均經專家鑒定確認;辛伐他汀(批號:140327,海南海靈化學制藥有限公司)購自南京先聲大藥房。肌酐、尿素氮、尿酸、谷草轉氨酶、谷丙轉氨酶、丙二醛、γ-谷氨酰轉移酶和谷胱甘肽等試劑盒購于南京建成生物工程研究所。
1.2 動物與儀器
雄性清潔級小鼠90只,體重為(25±2)g,購自南京青龍山動物繁殖廠,動物合格證號:SCXK(蘇)2007-0001。實驗期間給予標準飼料,自由攝食飲水,室內溫度控制為20~25℃。
721分光光度計(上海第三分析儀器廠);0412-1型低速離心機(上海醫療器械有限手術器械廠);BS-110-S型電子天平(北京賽多利斯公司)。
2 方法
2.1 中藥水煎劑制備
稱取適量關木通,加入8倍體積自來水,浸泡1h,武火煮沸后微沸1h,4層紗布過濾,收集濾液;殘渣加入6倍體積的自來水,微沸30min,亦過濾;合并兩次濾液,文火濃縮,得相當于0.7g/mL關木通的水煎液。同法制備附子干姜水煎劑0.5g/mL。
2.2 實驗方法
經環境適應性飼養1周后,將雄性ICR小鼠隨機分為5組:正常對照組(C組)、關木通模型組(M組)、附子干姜組(FG組)、辛伐他汀組(X組)、附子干姜+辛伐他汀組(FGX組)。C組給予灌胃等體積飲用水,其他4組灌胃給予7g/kg·d的關木通水煎劑,給藥4天后停藥3天,持續4周;從第3周起,各給藥組在給予造模藥基礎上再分別灌胃給予相應的治療藥物,即FG(5g/kg·d)、X(10mg/kg·d)、FG(5g/kg·d)+X(10mg/kg·d)。
2.3 指標測定
各組小鼠給藥4周后,摘除眼球取血并處死解剖,血樣旋轉離心(1 500r·min-1,10 min)后取上層血清于-20℃下保存,用于測定血清SCr、BUN、ALT、AST、UA等指標。取左側肝臟和腎臟的部分組織按1∶9質量體積比加入生理鹽水,在冰浴條件下制成10%的組織勻漿,以2 000rpm的轉速,離心10min后取上清液于-20℃保存備測。SCr、BUN、ALT、AST、γ-GT、蛋白、MDA、GSH等指標測定的具體操作按試劑盒說明書進行。
2.4 統計學分析
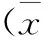
3 結果
3.1 各組小鼠左腎系數、左睪丸系數變化
與正常組比較,模型組小鼠左腎系數顯著升高(P<0.01),左睪丸系數顯著降低(P<0.01)。與模型組比較,各治療組左腎系數均有顯著性降低(P<0.01),左睪丸系數顯著升高(P<0.01),且在降低腎系數方面附子干姜組效應最為顯著。見表1。
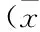
表1 各組小鼠左腎系數、左睪系數測定結果 ±s,n=8)
注:與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01。
3.2 各組小鼠血清生化指標變化
與正常對照組比較,模型組小鼠肌酐、尿素氮、尿酸和谷草、谷丙的含量均顯著升高(P<0.01);與模型組相比較,FG組、X組、FGX組生化指標的含量均顯著降低(P<0.01),且辛伐他汀組血清肌酐、尿酸濃度與正常組比較無明顯差異。見表2。
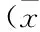
表2 各組小鼠血清生化指標測定結果比較 ±s,n=8)
注:與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01。
3.3 各組小鼠腎臟生化指標變化
與正常組比較,模型組小鼠腎臟組織中MDA、γ-GT、GSH均顯著性升高(P<0.01);附子干姜組和附子干姜+辛伐他汀組均能顯著性升高腎臟MDA、γ-GT的含量(P<0.01),降低GSH含量(P<0.05);辛伐他汀組小鼠腎臟組織中γ-GT的含量有顯著升高(P<0.01),對MDA、GSH含量的影響與模型組無較大差別。見表3。
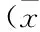
表3 各組小鼠腎臟生化指標測定結果比較 ±s,n=8)
注:與C組比較,*P<0.05,**P<0.01;與M組比較,#P<0.05,##P<0.01。
4 討論
中醫學認為,藥物性腎損害為藥毒侵襲臟腑,耗傷氣血,或傷及臟腑后失治、誤治,導致久病臟腑虧損、氣血陰陽虛衰、腎精虧虛,可歸于中醫學虛勞范疇[6]。腎氣虧虛、氣化不足,升清泌濁功能障礙,不能及時轉輸、運化水液及毒素,從而形成濕濁、濕熱、尿毒、瘀血等癥狀[7]。馬兜鈴酸類藥物關木通引起的腎纖維化疾病特點為起病隱匿、進展較快。目前公認的治療原則主要為延緩腎病進展。附子干姜辨證治療腎陰腎陽虧,辛伐他汀對癥治療、抗炎,促進毒性藥物及其代謝產物的排泄,兩者合用,以期達到標本兼治的目的。
本實驗結果顯示,與正常對照組比較,模型組小鼠的腎臟系數顯著性增加(P<0.01),睪丸系數顯著性降低(P<0.01),觀察發現模型組小鼠的腎臟發白腫大,睪丸萎縮,顯示關木通已造成腎臟損傷,且對生殖系統造成一定損害。在腎功能不全時,肌酐、尿素氮、尿酸在體內蓄積成為對機體有害的毒素,為檢查腎功能的主要指標,本實驗發現模型組小鼠肌酐、尿素氮及尿酸均顯著增加(P<0.01)。轉氨酶為反映肝臟功能的指標,主要存在于肝細胞內,當肝細胞發生炎癥、壞死、中毒等造成肝細胞受損時,轉氨酶便會釋放到血液里,使血清轉氨酶升高。模型組結果發現,ALT、AST均顯著性增加(P<0.01),研究指出AAⅠ在體內分布具有器官特異性,雖大部分在腎臟組織分布且清除緩慢,但部分在肝臟代謝可能造成一定程度的肝組織損傷[8]。γ-谷氨酰轉移酶(γ-GT)主要存在于血清及除肌肉外的所有組織中,其中以腎近曲小管刷狀邊緣含量最高,且血清γ-GT的含量與慢性腎病進展有關[9]。本實驗結果顯示:模型組γ-GT顯著性降低(P<0.01),推測原因可能為腎間質纖維化時腎小管上皮細胞可見刷狀邊緣脫落,上皮細胞濁腫,顆粒變性及壞死脫落,嚴重者有腎小管基膜裸露[10],從而導致γ-GT含量降低。MDA、GSH則反映腎臟損傷狀態的小鼠腎臟細胞氧化還原狀態。通常腎組織氧自由基的產生與清除處于相對平衡狀態,但慢性腎損傷時,機體的氧化與抗氧化系統發生改變。實驗中模型組顯著性降低腎臟MDA(P<0.01),GSH升高(P<0.01),說明模型組小鼠腎臟中氧化還原相關酶處于低活性狀態,推測可能與馬兜鈴酸腎病引起的腎陽虛證候有關,且γ-GT為參與谷胱甘肽及其衍生物代謝的關鍵酶[11],其含量降低會導致GSH的蓄積。
與模型組相比較,在腎系數與睪丸系數方面,附子干姜組、辛伐他汀組及合用組均能顯著性降低腎系數(P<0.01),升高睪丸系數(P<0.01),且附子干姜腎臟保護作用最強,兩者合用較辛伐他汀組有較好的降低腎系數作用。推測原因可能為附子干姜配伍使用充分發揮其溫陽通脈作用;他汀類則主要通過抑制藥物的聚集,產生抗炎等效應[12],合用可增強辛伐他汀腎臟保護效應。在肌酐、尿素氮與尿酸方面,治療組能顯著降低血清中的濃度(P<0.01),且辛伐他汀組促進肌酐、尿酸排泄能力最強,附子干姜降低尿素氮能力最強,兩者合用可提高附子干姜對肌酐與尿酸的排泄。研究發現,他汀類藥物能作用于腎近端小管細胞的SLCO4C1轉運體,促進代謝產物和毒素的排泄[13]。附子干姜可發揮其通經活絡、上通下達、行走于表里的作用。在谷草轉氨酶與谷丙轉氨酶方面,治療組均有顯著的保護作用(P<0.01)。在MDA、GSH與γ-GT含量方面,附子干姜組能顯著性升高MDA與γ-GT含量(P<0.01),降低GSH含量(P<0.05);而辛伐他汀組對MDA、GSH作用不明顯,能顯著性升高γ-GT含量(P<0.01);兩則合用可改善附子干姜對γ-GT的作用,而對MDA、GSH的作用略有降低,無顯著性差異。
在慢性腎病治療中,常選用類固醇類激素和血管緊張素轉化酶進行治療,但通常會產生較多的不良反應且療效并不顯著,因此研發新型藥物已成為治療慢性腎臟纖維化疾病的主要方向。本實驗選用炮制附子干姜治療關木通所致的馬兜鈴酸腎病,發揮其溫脾、腎之陽、助氣化而行水濕的功效,兩藥配伍,相須并用。現代藥理學研究發現,附子干姜能發揮抗炎、降低蛋白尿及恢復腎功能的作用[14],辛伐他汀可通過影響基質金屬蛋白酶家族及抑制轉化生長因子β表達等作用,延緩腎臟纖維化。本實驗還研究兩者合用對腎病的影響,結果發現:兩者合用能提高附子干姜對毒素的排泄,升高腎臟組織γ-GT的含量,提示附子干姜與辛伐他汀合用在延緩腎纖維化疾病方面可發揮各自的優勢,起到協同作用,可控制腎臟纖維化發展,但其具體作用機制還需進一步探討。
[1] BAKHIYA N.Molecular evidence for an involvement of organic anion transporters (OATs) in aristolochic acid nephropathy[J]. Toxicology,2009,264(1-2): 74-9.
[2] 宋海波.馬兜鈴酸毒性研究進展及風險因素分析[J].中國中藥雜志,2014(12): 2246-2250.
[3] 高艷麗.關木通致大鼠慢性馬兜鈴酸腎病模型的建立及發病機理的研究[D].北京:中國協和醫科大學,2003.
[4] 楊金風.附子對微小病變腎病大鼠的影響[J]. 遼寧中醫雜志,2010(S1): 245-247.
[5] DASHTI-KHAVIDAKI S.Statins against drug-induced nephrotoxicity[J].J Pharm Pharm Sci,2013,16(4):588-608.
[6] 袁平霞,段光堂,賈志杰.辨證治療為主治療藥物性腎損害致慢性腎衰竭32例療效觀察[J].河北中醫,2011(12): 1798-1799.
[7] 米杰.慢性馬兜鈴酸腎病的中西醫結合治療[J].山東中醫藥大學學報,2005(4): 281-282.
[8] 周娜,李曉玫.馬兜鈴酸腎病研究的新進展[J].藥物不良反應雜志,2007(1): 1-6.
[9] RYU S.Gamma-Glutamyl transferase as a predictor of chronic kidney disease in nonhypertensive and nondiabetic Korean men[J]. Clin Chem,2007,53(1):71-77.
[10] 尹廣,劉正釗.馬兜鈴酸腎病發病機制與診斷的某些進展[J].中國中西醫結合腎病雜志,2009(3): 268-271.
[11] 焦連亭,蔡鋼強.高血清γ-谷氨酰轉移酶對疾病的預示作用[J].國際檢驗醫學雜志,2009,30(1):46-48.
[12] DASHTI-KHAVIDAKI S.Statins against drug-induced nephrotoxicity[J].J Pharm Pharm Sci,2013,16(4):588-608.
[13] TOYOHARA T.SLCO4C1 transporter eliminates uremic toxins and attenuates hypertension and renal inflammation[J]. J Am Soc Nephrol,2009,20(12):46-55.
[14] 馬菲.附子復方治療類風濕關節炎寒濕阻絡證的有效性和安全性的臨床研究[D].北京:北京中醫藥大學,2013.
(責任編輯:李嵐春)
Effective Treatment of Aconite and Dried Ginger,Simvastatin and Combination on Renal Interstitial Fibrosis Induced by Aristolochic Acid
Chen Yaoqiao,Zhang Yaqian,Wang Youqun*
(Department of Pharmacology,China Pharmaceutical University,Nanjing 210009,China)
Objective:To explore the influence of aconite and dried ginger,simvastatin and their combination on renal interstitial fibrosis induced by aristolochic acid. Methods:Male ICR mice were randomly divided into 5 groups including control(C) group,model(M) group,aconite and dried ginger(FG)group,simvastatin(X)group,aconite and dried ginger+ simvastatin(FGX)group. The mice in control group,in model group and in three treatment group were given distilled water or Caulis Aristolochiae Manshuriensis (7g/kg·d,the first four days every week and for a period of 4 weeks),and the treatment groups were given different drugs (FG(5g/kg·d),X(10mg/kg·d),FG(5g/kg·d)+X(10mg/kg·d)since the third week by intragastric administration. At the end of the experiment,in blood serum the levels of creatine(SCr),urea nitrogen(BUN),uric acid(UA),alanine transaminase(ALT) and aspartate aminotransferase(AST) were measured; in kidney tissue the contents of malondialdehyde(MDA),glutathione(GSH),γ-Glutamyltransferase(γ-GT) were detected.Results:(1) Compared with M group,the treatment groups significantly reduced the levels of Cr,BUN,UA,ALT and AST,and when combined with simvastatin,aconite and dried ginger promoted the excretion of creatine and uric acid.(2) Compared with M group,the treatment groups improved the contents ofγ-GT,aconite and dried ginger,the combination group both increased the contents of MDA and lowered the contents of GSH. Conclusion:Aconite and dried ginger,simvastatin both exert the protection of aristolochic acid nephropathy,and when combined together,they can complement ?each other to against the renal interstitial fibrosis.
Aristolochic Acid Nephropathy;Renal Interstitial Fibrosis;Aconite and Dried Ginger; Simvastatin
2014-11-04
陳燕喬(1988-),女,中國藥科大學藥理研究室碩士研究生,研究方向為心血管藥理。E-mail: chenyanqiao10@163.com
王友群(1956-),男,中國藥科大學副教授,研究方向為心血管藥理學。E-mail: wyqfbox@163.com
R277.51
A
1673-2197(2015)06-0018-03
10.11954/ytctyy.201506008

