高爐渣對Cd2+的吸附性能
王 哲,劉金亮,陳莉榮,黃國和
(1. 華北電力大學 資源與環境研究院,北京 102206;2. 內蒙古科技大學 能源與環境學院,內蒙古 包頭 014010)
高爐渣對Cd2+的吸附性能
王 哲1,2,劉金亮2,陳莉榮2,黃國和1
(1. 華北電力大學 資源與環境研究院,北京 102206;2. 內蒙古科技大學 能源與環境學院,內蒙古 包頭 014010)
采用包頭鋼鐵集團煉鐵廠的高爐渣為吸附劑(粒徑0.154 nm)對Cd2+進行吸附,運用SEM技術對吸附劑進行了表征,研究了初始Cd2+質量濃度、吸附劑加入量、吸附時間、吸附溫度和廢水pH對Cd2+去除率的影響,并探討了吸附機理。表征結果顯示:高爐渣吸附劑具有疏松多孔的特點,表面十分粗糙,比表面積較大。實驗結果表明:當吸附溫度為室溫(28 ℃)、廢水pH為7、初始Cd2+質量濃度為10 mg/L、吸附劑加入量為8 g/L、吸附時間為60 min時,Cd2+去除率達到98.55%;高爐渣對Cd2+的吸附符合擬二級動力學方程和Langmuir等溫吸附模型,且吸附反應易發生。
高爐渣;吸附;鎘離子;吸附等溫線;吸附動力學;工業廢水
工業廢水是水體污染的主要污染源,其中重金屬廢水的污染更加嚴重[1-2]。鎘是一種毒性很大的重金屬,它通過食物鏈富集,具有穩定、積累和不易消除的特點,可積累于人體的肝、腎和骨骼之中使人體產生慢性中毒[3]。含鎘廢水主要來源于礦山、冶煉廠、鎘化合物生產企業、鎳鎘電池生產企業和電鍍行業等[4]。重金屬廢水的常用處理方法有化學沉淀、離子交換、吸附、凝聚、膜分離等[5],這些方法大都存在二次污染、成本較高、對低濃度廢水的處理效果較差等缺點[6]。吸附法因其在廢水處理中的高效性和簡便操作性而被廣泛應用,但吸附劑的費用一般都較為昂貴,因此需要尋找一種較為廉價的替代材料。
高爐渣是煉鐵過程中產生的廢物,是一種具有很高潛在活性的玻璃體材料,也是一種多孔硅酸鹽材料,對水中雜質有較好的吸附性能[7]。可用高爐渣吸附的重金屬離子有Cu2+,Zn2+,Ni2+,Pb2+,Cr(Ⅵ),Cr(Ⅲ)等[8-14]。研究結果表明,高爐渣對這些重金屬離子的吸附效果很好,且吸附速率較快。
本工作以包頭鋼鐵集團煉鐵廠的高爐渣為吸附劑,研究了高爐渣吸附劑的微觀形貌及其對Cd2+的吸附行為,以期為拓寬高爐渣的綜合利用途徑、開發新型廉價高效吸附材料提供參考。
1 實驗部分
1.1 試劑、材料和儀器
CdCl2·2.5H2O、NaOH、鹽酸:分析純。
廢水:CdCl2·2.5H2O和蒸餾水配制的模擬含鎘廢水,用1 mol/L NaOH溶液和1 mol/L鹽酸調節pH。
高爐渣:取自包頭鋼鐵集團煉鐵廠4#高爐,其主要化學成分見表1[15]。

表1 高爐渣的主要化學成分w,%
AA-6300C型火焰原子吸收分光光度計:島津公司;QUANTA400型掃描電子顯微鏡:FEI公司;pHS-3C型數字式酸度計:上海精科天美科學儀器有限公司;FA2204B型電子天平:上海精科天美科學儀器有限公司;GZX-9140 MBE型數顯鼓風干燥箱:上海博迅實業有限公司;HY-B2型回旋振蕩器:常州國華電器有限公司;SHA-BA型水浴恒溫振蕩器:金壇市榮華儀器制造有限公司。
1.2 實驗原理
高爐渣所含的主要金屬氧化物為SiO2和CaO。當高爐渣加入到溶液中時,SiO2在溶液中會以SiO44-的形式存在,SiO44-特殊的晶體結構能促進離子交換和吸附作用[16];在堿性條件下,溶解于水中的Ca2+可形成無定形CaCO3,金屬離子吸附在其上,并最終整體被束縛于高爐渣的一些無定形金屬氧化物上,從而被吸附去除[17]。
高爐渣大多由非晶態玻璃體組成,是一種分相玻璃體,其中,分出的連續相是化學穩定性差的富鈣相,它是高爐渣化學活性的主要來源。高爐渣的玻璃體由網架形成體和網架改性體構成。網架形成體主要由SiO44-組成,而網架改性體主要由Ca2+組成,它存在于網架形成體的空隙中,以平衡電荷。高爐渣中的Al3+和Mg2+既是網架的形成體,又是網架的改性體。
1.3 實驗方法
將高爐渣用去離子水洗凈,在100~105 ℃下烘干,研磨,過100目分樣篩,即得實驗用高爐渣吸附劑(粒徑0.154 nm)。稱取一定量的吸附劑于250 mL具塞錐形瓶中,加入50 mL廢水,置于振蕩速率為120 r/min的恒溫振蕩器上振蕩吸附一段時間,靜置,取上清液過濾后置于聚乙烯瓶中待測。
1.4 分析方法
采用SEM技術觀察高爐渣吸附劑的微觀形貌。
采用火焰原子吸收分光光度計測定濾液中Cd2+的含量,計算去除率。

圖1 高爐渣吸附劑的SEM照片
2 結果與討論
2.1 SEM表征結果
高爐渣吸附劑的SEM照片見圖1。由圖1可見,高爐渣吸附劑具有疏松多孔的特點,表面十分粗糙,比表面積較大,對吸附Cd2+十分有利,因此可被用作吸附材料。
2.2 初始Cd2+質量濃度對Cd2+去除率的影響
當吸附溫度為室溫(28 ℃)、廢水pH為7、吸附劑加入量為8 g/L、吸附時間為60 min時,初始Cd2+質量濃度對Cd2+去除率的影響見圖2。
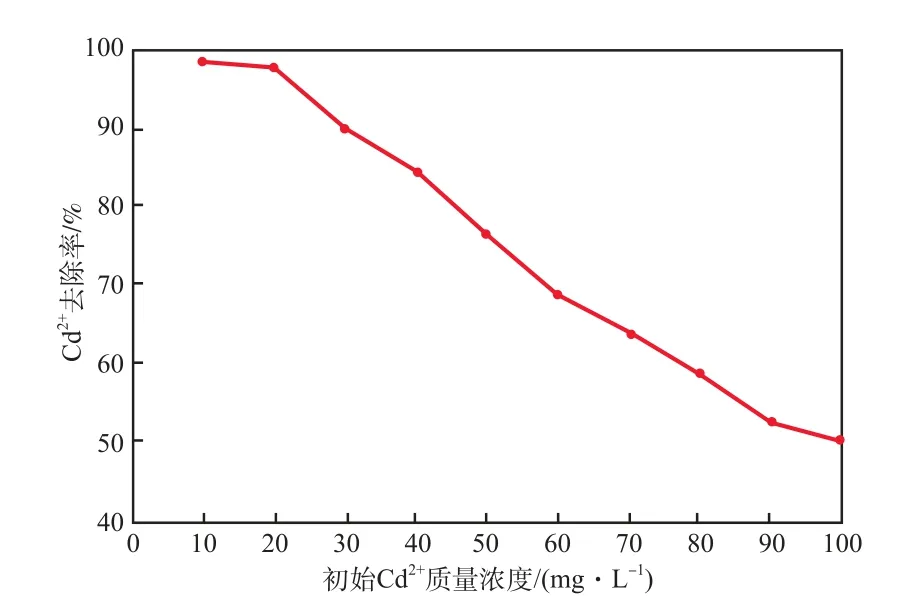
圖2 初始Cd2+質量濃度對Cd2+去除率的影響
由圖2可見,隨初始Cd2+質量濃度的增加,Cd2+去除率減小。這是因為吸附劑的吸附量逐漸接近飽和,無法吸附更多的Cd2+。在本實驗的吸附劑加入量范圍內,對低濃度廢水的吸附處理效果較好。因此,后續實驗的初始Cd2+質量濃度均采用10 mg/L。
2.3 吸附劑加入量對Cd2+去除率的影響
當吸附溫度為室溫(28 ℃)、廢水pH為7、初始Cd2+質量濃度為10 mg/L、吸附時間為60 min時,吸附劑加入量對Cd2+去除率的影響見圖3。由圖3可見:吸附劑加入量從2 g/L增至8 g/L時,Cd2+的去除率明顯增大,這主要是由于隨吸附劑用量的增加,所提供的吸附位點增加,在體系中金屬離子的總濃度不變的情況下,金屬離子的吸附率必隨之增大;但當吸附劑加入量繼續增加時,Cd2+去除率的變化不明顯,體系趨于平衡狀態,這是由于8 g/L的吸附劑加入量所提供吸附位點已經大量吸附了溶液中的Cd2+,多余的吸附劑很難再發揮作用。因此,后續實驗的吸附劑加入量均采用8 g/L。
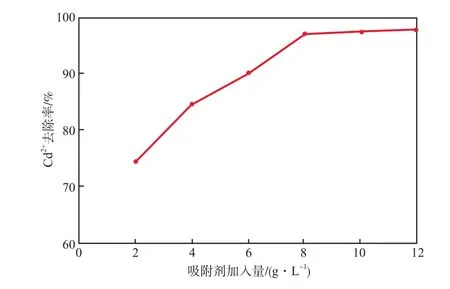
圖3 吸附劑加入量對Cd2+去除率的影響
2.4 吸附時間對Cd2+去除率的影響
當吸附溫度為室溫(28 ℃)、廢水pH為7、初始Cd2+質量濃度為10 mg/L、吸附劑加入量為8 g/L時,吸附時間對Cd2+去除率的影響見圖4。由圖4可見:隨吸附時間的延長,Cd2+去除率明顯增大;但當吸附時間達60 min時,繼續延長吸附時間,Cd2+去除率的變化不明顯。這是由于吸附時間越長,高爐渣與金屬離子間的接觸越充分,有利于吸附的進行,直至60 min時吸附接近飽和,吸附量不再增加。吸附過程中,固液兩相在60 min時達到動態平衡。因此,后續實驗的吸附時間均采用60 min。

圖4 吸附時間對Cd2+去除率的影響
2.5 吸附溫度對Cd2+去除率的影響
當廢水pH為7、初始Cd2+質量濃度為10 mg/L、吸附劑加入量為8 g/L、吸附時間為60 min時,吸附溫度對Cd2+去除率的影響見圖5。由圖5可見:隨溫度的升高Cd2+去除率增加,在溫度從20 ℃升至室溫(28 ℃)的過程中,Cd2+去除率的增大比較明顯;在溫度達到室溫后,繼續升溫,Cd2+去除率的變化不大。從實際工程應用角度考慮,溫度過高或過低都會增加投資和成本。因此,選擇吸附溫度為室溫。
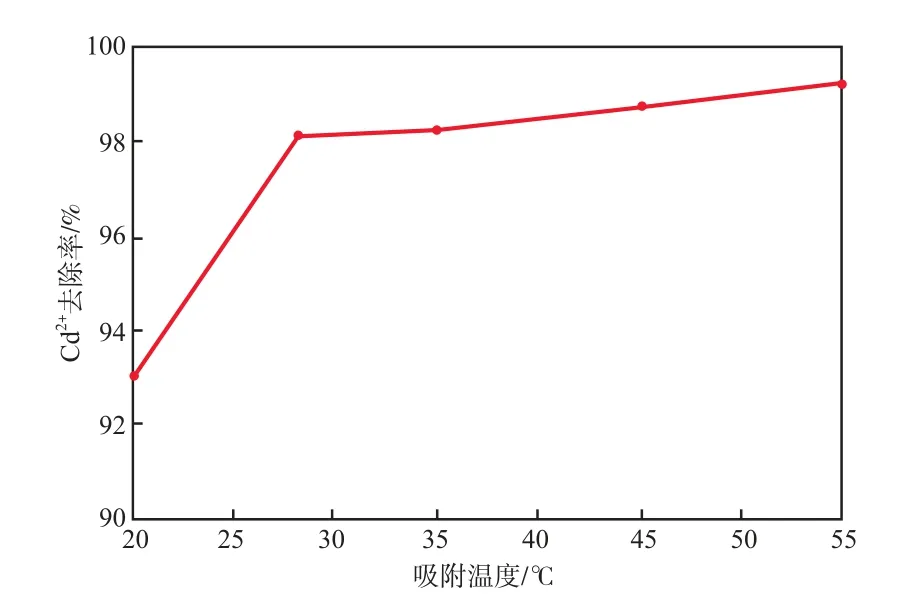
圖5 吸附溫度對Cd2+去除率的影響
2.6 廢水pH對Cd2+去除率的影響
當吸附溫度為室溫(28 ℃)、初始Cd2+質量濃度為10 mg/L、吸附劑加入量為8 g/L、吸附時間為
60 min時,廢水pH對Cd2+去除率的影響見圖6。由圖6可見:在強酸性條件下,隨pH的升高Cd2+去除率明顯增大;而當pH大于5時,Cd2+去除率的增加趨勢變緩。總體而言,在中性或堿性條件下,Cd2+的去除效果優于酸性條件。這主要是因為:在酸性條件下,Cd2+與H+之間存在對吸附位點的競爭,從而影響了對Cd2+的吸附效果;另一方面,隨pH的升高,OH-逐漸增多,會與Cd2+結合生成Cd(OH)2沉淀,增強了Cd2+的去除效果[18]。廢水未經酸堿調節時,其初始pH約為7。在實際工程應用中,若采用投加藥劑來提高廢水pH,會導致處理成本上升。綜合考慮,選擇廢水pH為7,即不調節廢水pH,此時的Cd2+去除率達到98.55%。
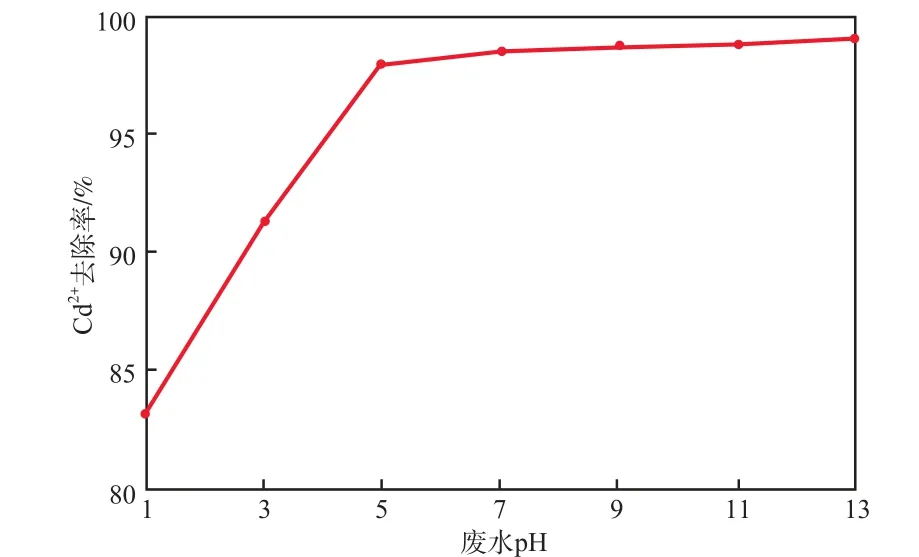
圖6 廢水pH對Cd2+去除率的影響
2.7 吸附動力學
分別采用擬一級動力學方程、擬二級動力學方程和顆粒內擴散方程(見式(1)~(3))對2.4節的實驗數據進行擬合,擬合結果見表2。由表2可見,擬二級動力學方程的相關系數最高(為0.999 7),而擬一級動力學和顆粒內擴散方程的相關系數較低,說明高爐渣吸附劑吸附Cd2+的動力學過程更符合擬二級動力學方程。

式中:t為吸附時間,min;qt為t時刻的吸附量,mg/g;qe為平衡吸附量,mg/g;k1為擬一級速率常數,min-1;k2為擬二級速率常數,g/(mg·min);kp為顆粒內擴散速率常數,mg/(g·min1/2);C為顆粒內擴散方程的截距,mg/g。
2.8 吸附等溫線
分別采用Langmuir等溫吸附模型(見式(4))和Freundlich等溫吸附模型(見式(5))對2.2節的實驗數據進行擬合,擬合結果見表3。

式中:ρe為吸附平衡時Cd2+的質量濃度,mg/L;qsat為飽和吸附量,mg/g;b為Langmuir吸附常數,L/mg;kf和n分別為Freundlich吸附常數和吸附強度系數。

表2 動力學方程的擬合結果表3 等溫吸附模型的擬合結果

?
由表3可見,Langmuir等溫吸附模型的相關系數為0.999 7,比Freundlich模型高出許多,說明高爐渣吸附劑對Cd2+的等溫吸附過程更符合Langmuir模型,這表明吸附發生在高爐渣吸附劑的同種吸附位點上。Langmuir模型的本質特征可用無量綱平衡常數(RL,見式(6))來表達,RL的大小反映出吸附的類型是不易發生的(RL>1)、線性的(RL=1)、易發生的(0<RL<1)或不可逆的(RL=0)[19]。對于本實驗,0<RL<1,表明高爐渣吸附劑對Cd2+的吸附是易發生的。

式中,ρ0為初始Cd2+質量濃度,mg/L。
3 結論
a)高爐渣吸附劑具有疏松多孔的特點,表面十分粗糙,比表面積較大,對吸附Cd2+十分有利。
b)當吸附溫度為室溫(28 ℃)、廢水pH為7、初始Cd2+質量濃度為10 mg/L、高爐渣吸附劑加入量為8 g/L、吸附時間為60 min時,Cd2+去除率達到98.55%。
c)高爐渣吸附劑對Cd2+的吸附符合擬二級動力學方程和Langmuir等溫吸附模型,且吸附反應易發生。
d)與其他除鎘方法相比,高爐渣吸附法具有工藝簡單、以廢治廢、成本低廉、處理效果好等優勢,因而具有良好的應用前景。
[1] 魯秀國,黨曉芳,鄢培培.核桃殼吸附劑對水中Pb2+的吸附[J].化工環保,2014,34(1):5 - 9.
[2] 丁春生,貢飛,陳姍,等.硝酸改性活性炭的制備及其對Cr(Ⅵ)的吸附性能[J].化工環保,2013,33(4):344 - 348.
[3] 牟淑杰. 改性累托石吸附處理含鎘廢水實驗研究[J].礦產綜合利用,2009(3):17 - 20.
[4] 趙永紅,成先雄,邱廷省. 啤酒酵母對鎘離子的吸附及鎘離子的解吸[J]. 金屬礦山,2007(4):74 - 77.
[5] Kim Tae-Young,Park Sun-Kyu,Cho Sung-Yong,et al. Adsorption of Heavy Metals by Brewery Biomass[J]. Korean J Chem Eng,2005,22(1):91 - 98.
[6] Demir A,Arisoy M. Biological and Chemical Removal of Cr(Ⅵ) from Waste Water:Cost and Benef t Analysis[J]. J Hazard Mater,2007,147(1/2):275 - 280.
[7] 吳達華,吳永革,林蓉. 高爐水淬礦渣結構特性及水化機理[J]. 石油鉆探技術,1997,25(1):33 -35,64.
[8] Dimitrova S V. Metal Sorption on Blast-Furnace Slag[J]. Water Res,1996,30(1):228 - 232.
[9] 王湖坤,龔文琪,吳龍華. 水淬渣 - 累托石混合吸附劑處理含Cu2+冶金廢水的研究[J]. 環境工程學報,2007,1(1):27 - 29.
[10] 賈飛虎,陳莉榮,竇艷銘,等. 水淬渣吸附劑處理含銅廢水試驗研究[J]. 內蒙古科技大學學報,2011,30(1):73 - 75.
[11] Srivastava S K,Gupta V K,Mohan D. Removal of Lead and Chromium by Activated Slag:A Blast-Furnace Waste[J]. J Environ Eng,1997,123(5):461 - 468.
[12] 趙靚潔,劉鳴達,王耀晶,等. 高爐渣吸附廢水中的鉛[J]. 環境工程學報,2010,4(7):1473 - 1477.
[13] Fahim N F,Barsoum B N,Eid A E,et al. Removal of Chromium(Ⅲ) from Tannery Wastewater Using Activated Carbon from Sugar Industrial Waste[J]. J Hazard Mater,2006,136(2):303 - 309.
[14] 鄭禮勝,王士龍,劉曉坤. 用礦渣處理含鉻廢水[J].材料保護,1997,30(3):21 - 23,5.
[15] 王春斌. 包鋼高爐渣綜合利用途徑的研究[J]. 包鋼科技,2001,27(1):76 - 78,19.
[16] Dimitrova S,Nikolov V,Mehandjiev D. Effect of the Heat Treatment on the Morphology and Sorption Ability to Metal Ions of Metallurgical Slag[J]. J Mater Sci,2001,36(11):2639 - 2643.
[17] Oh Chamteut,Rhee Sungsu,Oh Myounghak,et al. Removal characteristics of A(sⅢ) and A(sⅤ) from Acidic Aqueous Solution by Steel Making Slag[J]. J Hazard Mater,2012,213/214:147 - 155.
[18] Kim Do-Hyung,Shin Min-Chul,Choi Hyun-Doc,et al. Removal Mechanisms of Copper Using Steel-Making Slag:Adsorption and Precipitation[J]. Desalination,2008,223(1/2/3):283 - 289.
[19] Duan Jinming,Su Bing. Removal Characteristic of Cd(Ⅱ) from Acidic Aqueous Solution by Modif ed Steel-Making Slag[J]. Chem Eng J,2014,246:160 -167.
(編輯 魏京華)
Adsorption Capability of Blast Furnace Slag to Cd2+
Wang Zhe1,2,Liu Jinliang2,Chen Lirong2,Huang Guohe1
(1. Resources and Environmental Research Academy,North China Electric Power University,Beijing 102206,China;
2. School of Energy and Environment,Inner Mongolia University of Science and Technology,Baotou Inner Mongolia 014010,China)
The blast furnace slag (particle size 0.154 nm) from an ironmaking plant of Baogang Group was used for Cd2+adsorption. The adsorbent was characterized by SEM. The factors affecting the Cd2+removal rate were studied and the adsorption mechanism was discussed. The characterization results show that:The blast furnace slag is a porous adsorbent,with rough surface and large specif c surface area. The experimental results show that:When the adsorption temperature is atmospheric temperature (28 ℃),the wastewater pH is 7,the initial Cd2+mass concentration is 10 mg/L,the adsorbent dosage is 8 g/L and the adsorption time is 60 min,the Cd2+removal rate reaches 98.55%;The adsorption of Cd2+on blast furnace slag fits with the pseudo-second-order kinetics model and Langmuir isothermal adsorption model,and the adsorption reaction is easy to happen.
blast furnace slag;adsorption;cadmium ion;adsorption isotherm;adsorption kinetics;industrial wastewater
X756
A
1006 - 1878(2015)02 - 0187 - 05
2014 - 09 - 26;
2014 - 12 - 11。
王哲(1979—),女,內蒙古自治區包頭市人,博士,副教授,電話15804721992,電郵 wz0478@163.com。聯系人:劉金亮,電話15771250261,電郵 jayjinliang68@163.com。
內蒙古自治區高等學校科學研究項目(NJ2Y13149)。

