達烏爾黃鼠白色脂肪組織中多不飽和脂肪酸合成基因表達
門麗媛, 劉 帥, 于 超, 宋士一, 彭 霞, 楊 明
(1. 沈陽師范大學 化學與生命科學學院, 沈陽 110034;2. 沈陽師范大學 實驗教學中心, 沈陽 110034)
?
達烏爾黃鼠白色脂肪組織中多不飽和脂肪酸合成基因表達
門麗媛1, 劉 帥1, 于 超1, 宋士一1, 彭 霞2, 楊 明1
(1. 沈陽師范大學 化學與生命科學學院, 沈陽 110034;2. 沈陽師范大學 實驗教學中心, 沈陽 110034)
多不飽和脂肪酸對哺乳動物細胞膜的結構和功能、免疫能力、脂肪代謝等具有重要的調控作用。為研究其在冬眠動物體內合成受基因表達調控的情況,使用第2代轉錄組測序技術,對達烏爾黃鼠(Spermophilus dauricuricus)的白色脂肪組織進行轉錄組測序,得到羥酰基輔酶A還原酶、烯酰輔酶A脫氫酶、Δ-5去飽和酶和Δ-6去飽和酶的堿基序列,并測得它們在起始育肥期、快速育肥期、育肥完成期和冬眠期4個階段的差異表達情況。結果顯示:羥酰基輔酶A還原酶在冬眠期表達上調,與起始育肥期差異顯著;烯酰輔酶A脫氫酶在冬眠期的表達量也顯著高于起始育肥期和快速育肥期;Δ-5去飽和酶和Δ-6去飽和酶在起始育肥期高表達。表明達烏爾黃鼠體內多不飽和脂肪酸的合成存在著基因表達的調控,可能以此來實現在不同生理時期對細胞膜流動性和免疫能力的調節。
達烏爾黃鼠; 多不飽和脂肪酸; 基因表達
0 引 言
多不飽和脂肪酸(polyunsaturated fatty acids, PUFA)是指含有2個或更多個雙鍵的長鏈脂肪酸。根據第1個不飽和鍵位置不同,PUFA可分為ω-3、ω-6、ω-7、ω-9等系列,如距羧基最遠端的雙鍵是在倒數第3個碳原子上的稱為ω-3多不飽和脂肪酸。哺乳動物細胞內缺乏能夠在脂肪酸碳鏈第9個碳之后引入雙鍵的酶,所以,動物體內所需的不飽和脂肪酸需要從食物中攝取α-亞麻酸(α-Linolenic acid, ALA)和亞油酸(linoleic acid, LA)合成。ALA和LA是在體內合成其他PUFA的前體物質,通過一系列的延長酶與脫氫酶的作用合成二十碳五烯酸(eicosapentaenoic acid, EPA)、二十二碳六烯酸(docosahexaenoic acid, DHA)、三烯前列腺素等其他多不飽和脂肪酸[8-9],在此合成過程中細胞內質網上的Δ-5去飽和酶和Δ-6去飽和酶扮演著重要的作用[10]。
PUFA是細胞膜磷脂的重要組成成分,決定了細胞膜的流動性和變形性[1],在維護細胞膜的結構和功能方面有著重要的作用[2], 因此也對免疫細胞的免疫能力產生影響[3-5]。同時,PUFA與其代謝物能在細胞水平上通過與核受體或轉錄因子結合來對機體的不同組織進行基因表達的調控[6],從而發揮其廣泛的生物學功能,包括細胞內信號傳導通路[7]、細胞凋亡的調控、脂肪酸的代謝等。以往關于多不飽和脂肪酸功能的研究多采用在動物的日糧中添加飼喂的方法,例如對嚙齒動物的實驗發現,日糧添加PUFA 4天后脂肪酸合成酶(fatty acid synthetase, FAS)和6-磷酸葡萄糖脫氫酶(glucose-6-phosphogluconate dehydrogenase, G-6-PD)的活性明顯降低[11],并且硬脂酰輔酶A去飽和酶1(stearly CoA desaturase 1, SCD1)、乙酰輔酶A羧化酶(acetyl CoA carboxylase, ACC)、L-型丙酮酸激酶(Ltype pyruvate kinase, L-PK)、Δ-5去飽和酶、Δ-6去飽和酶、G-6-PD、肝臟中胰島素敏感性葡萄糖載體GLUT-4等基因的表達受到抑制[12]。給大鼠飼喂共軛亞油酸(conjugated linoleic acid, CLA),發現能夠增強其腹膜巨噬細胞的吞噬能力[13]和殺傷能力[14]。低劑量短期喂食DHA或EPA可以改變小鼠脾淋巴細胞的膜脂質成分和細胞功能[15]。用多不飽和脂肪酸含量較高的魚油飼喂的大鼠與其他組相比,母鼠和幼鼠的淋巴細胞表面的抗原分子CD25、CD54、CD28、CD56明顯增加[16]。免疫細胞膜上這些分子的表達增加,增強了T細胞和NK細胞的活性,提高了機體的免疫能力。
然而,目前關于動物體內自身的多不飽和脂肪酸合成情況的研究卻鮮有報道,本研究使用冬眠動物達烏爾黃鼠 (Spermophilus dauricus)為實驗動物,達烏爾黃鼠隸屬松鼠科黃鼠屬,是典型的貯脂類冬眠動物,目前已經是研究冬眠的優良模式動物。本研究組使用轉錄組測序的方法,檢測其多不飽和脂肪酸合成相關基因的編碼序列及在動物體重年周期變化的不同階段的基因差異表達情況,初步探索多不飽和脂肪酸在動物體內受主動調控的合成情況及對貯脂類冬眠動物在冬眠前的育肥準備階段和冬眠階段可能產生的影響。
1 材料和方法
1.1 實驗動物
達烏爾黃鼠20只(♀)于2012年5月捕自內蒙古通遼(43.37°N, 122.16°E),在沈陽師范大學動物房內單籠飼養,飼養籠大小48 cm×35 cm×20 cm,用碎刨花做巢材,自然溫度和光照,入眠后,放入5±2 ℃低溫房內。動物喂以標準鼠飼料(沈陽市于洪區前民動物飼料廠),水、食自取。
1.2 體重測量
使用精度為0.01 g電子天平每周稱量一次動物的體重。
1.3 取材與保存
根據動物體重的變化,分為起始育肥期(initial-fattening, I-F)(6月)、快速育肥期(rapid-fattening, R-F)(7月)、育肥完成期(finished-fattening, F-F)(8~9月)和冬眠期(hibernation, H)(10月~次年3月)4個階段進行取材,每階段5只動物(♀)。動物用CO2麻醉,然后斷頸處死(冬眠組動物直接處死),取腹腔內白色脂肪組織(white adipose tissue, WAT)置于離心管中,液氮速凍,低溫冰箱(-80 ℃)保存。
1.4 基因差異表達分析
1.4.1 轉錄組測序
將4個階段的所有樣本的WAT分別提取總RNA,同階段個體的RNA等量混合后,加熱使之打開二級結構后用帶有Oligo(dT)的磁珠富集mRNA。向得到的mRNA中加入適量打斷試劑,高溫條件下使其片斷化,再以片斷后的mRNA為模板,合成cDNA,經過磁珠純化、末端修復、3′末端加堿基A、加測序接頭后,進行PCR擴增, 從而完成該物種WAT轉錄組文庫的構建。構建好的文庫用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System進行質量和產量檢測,文庫質控合格后使用Illumina HiSeqTM2000進行測序。
1.4.2 基因表達量與差異表達分析
對原始數據進行篩選,去除adaptor和低質量序列(質量值Q≤5的堿基數占整個read的50%以上)得到Clean reads。對Clean reads做測序評估,統計基因表達量(RPKM值),得到差異檢驗的FDR值(假陽性率),并根據基因的表達量計算該基因在不同組樣本間的差異表達倍數。差異表達基因定義為FDR≤0.001且倍數差異在2倍以上(|log2Ratio|≥1)的基因。基因表達量的計算公式為
其中:RPKM為基因A的表達量;C為唯一比對到基因A的reads數;N為唯一比對到參考基因的總reads數;L為基因A的堿基數。
1.4.3 序列比對與功能分析
將差異表達基因比對到NCBI上做GO功能分析并作KEGG Pathway分析。
2 實驗結果
2.1 延長酶基因表達變化
達烏爾黃鼠WAT中羥酰基輔酶A脫氫酶的基因表達量在起始育肥期、快速育肥期、育肥完成期及冬眠期分別為24、30、41、66。冬眠期明顯高于起始育肥期,差異顯著(圖1)。烯酰輔酶A還原酶在4個時期的表達量為31、33、77、111。起始育肥期與快速育肥期無差異,但顯著低于冬眠期(圖2)。
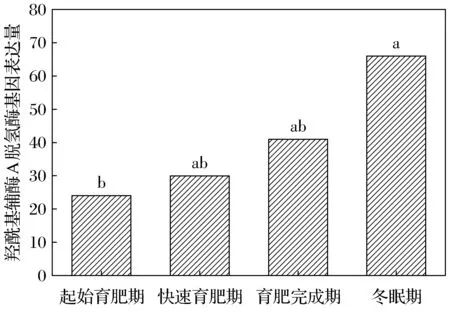
不同字母表示差異顯著,FDR≤0.001, |log2Ratio|≥1。
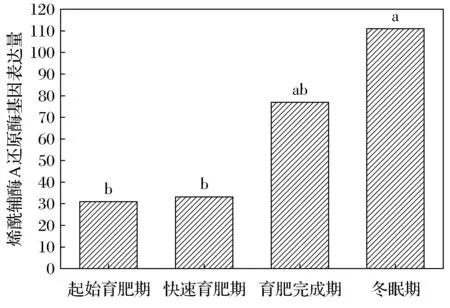
不同字母表示差異顯著,FDR≤0.001, |log2Ratio|≥1。
2.2 去飽和酶基因表達變化
達烏爾黃鼠WAT中Δ-5脫氫酶的基因表達量在起始育肥期、快速育肥期、育肥完成期及冬眠期分別為87、71、34、42。起始育肥期與快速育肥期無明顯差異,但顯著高于育肥完成期和冬眠期(圖3)。Δ-6脫氫酶的基因表達量分別為383、193、199、233。起始育肥期顯著高于快速育肥期和育肥完成期(圖4)。
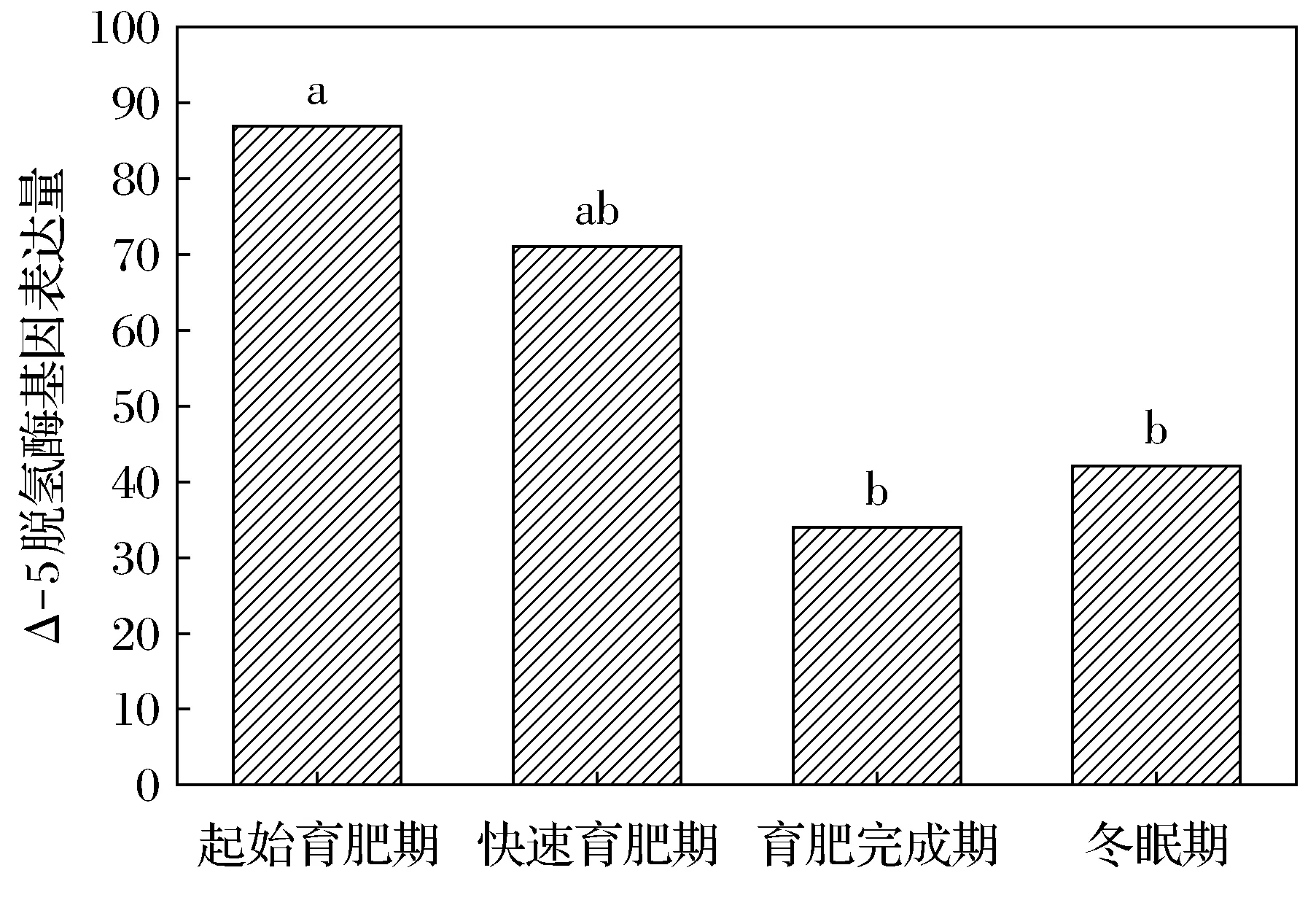
不同字母表示差異顯著,FDR≤0.001, |log2Ratio|≥1。
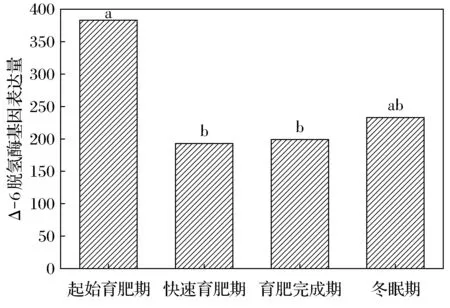
不同字母表示差異顯著,FDR≤0.001, |log2Ratio|≥1。
3 討 論
PUFA在生物體內的代謝是一個復雜的過程(圖5)[17],ω-6系和ω-3系2個系列PUFAs在體內有各自的代謝途徑,在相同的代謝步驟中所需的酶為同一酶系,共用相同的去飽和酶和鏈延長酶。脂肪酸鏈的延長是一個四步驟的反應,首先有不飽和脂肪酸與丙二酰輔酶A在3-酮脂酰-CoA合成酶作用下釋放一個CO2分子,生成3-酮脂酰輔酶A,隨后在NADPH和3-酮脂酰-CoA還原酶的共同作用下生成羥酰基輔酶A,并由羥酰基輔酶A脫氫酶脫水生成烯酰輔酶A,在烯酰輔酶A還原酶以及NADPH作為輔助因子的作用下形成烯酰基,由此碳鏈延長2個碳原子。達烏爾黃鼠的羥酰基輔酶A脫氫酶與烯酰輔酶A還原酶的表達量自起始育肥期至冬眠期呈現逐漸增加的趨勢,說明動物的低體溫、低代謝[8-19]的冬眠狀態并沒有抑制其體內PUFA形成過程的脂肪酸鏈延長反應。機體可能通過加強羥酰基輔酶A脫氫酶與烯酰輔酶A還原酶的轉錄來維持多不飽和脂肪酸的合成能力,以維持一定的細胞膜流動性和血液流動性[20-21]。
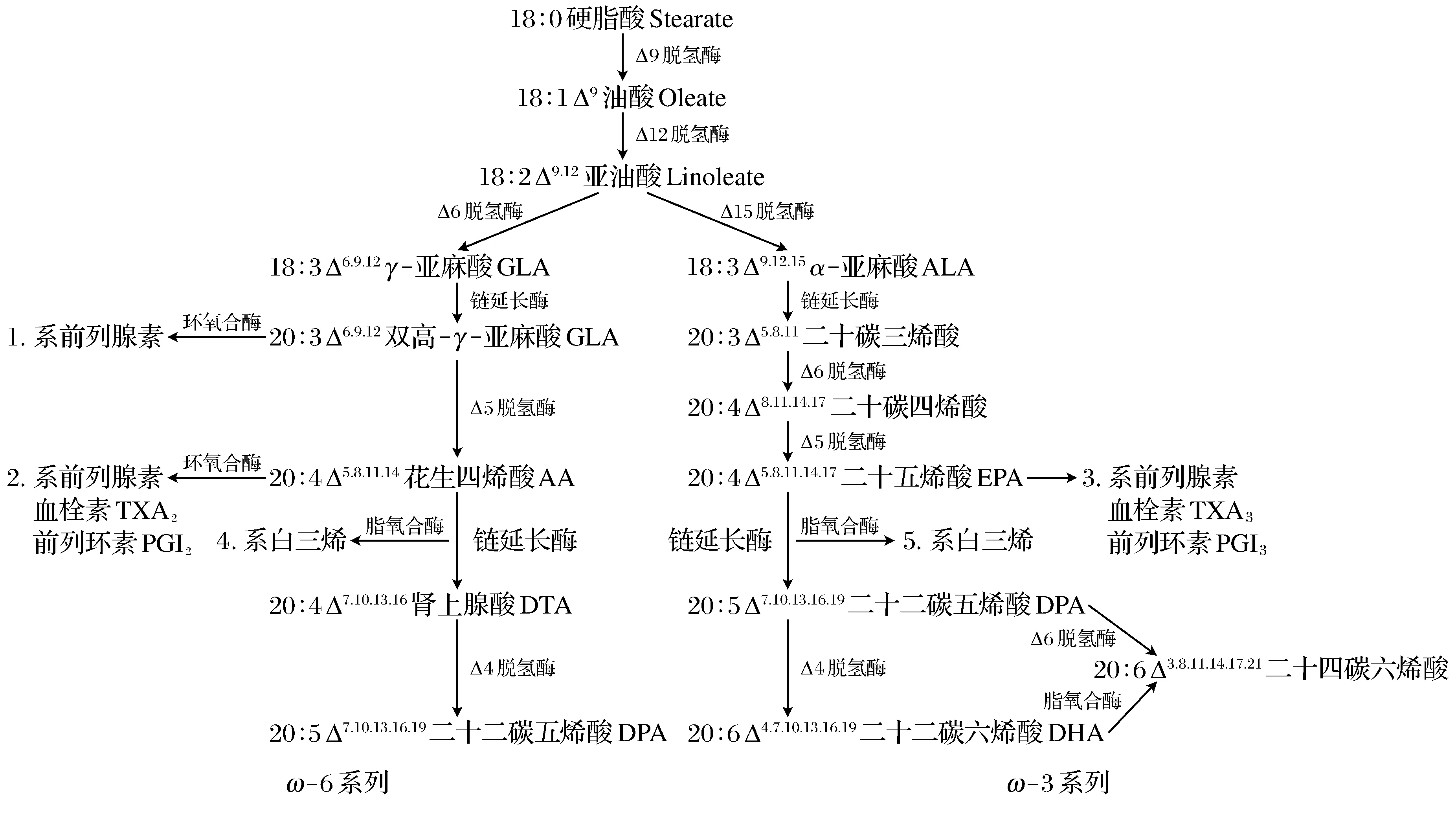
圖5 ω6和ω3 PUFAs在生物體中的合成轉化
哺乳動物缺乏Δ-12脫氫酶和Δ-15脫氫酶,不能完成油酸向亞麻酸轉化的過程,因此亞麻酸成為了哺乳動物的必須脂肪酸。Δ-5脫氫酶和Δ-6脫氫酶是亞麻酸轉化為其他PUFA的關鍵去飽和酶。實驗結果顯示Δ-5脫氫酶和Δ-6脫氫酶均在達烏爾黃鼠的起始育肥期表達量最多,說明此時多不飽和脂肪酸合成過程的去飽和反應大量發生,動物體內多不飽和脂肪酸可能在此時期合成最多,這與達烏爾黃鼠在育肥初期以脂肪酸合成代謝為主的結論相一致[22]。育肥完成期達烏爾黃鼠體重開始下降,機體的供能方式也發生改變,動物由活躍狀態向非活躍狀態轉變,Δ-5脫氫酶和Δ-6脫氫酶的低水平表達提示此階段PUFA的合成也開始降低,并持續到冬眠期。由于PUFA可以提高機體的非特異性免疫并雙向調節特異性免疫,因此可以推測Δ-5脫氫酶和Δ-6脫氫酶的表達降低,會降低PUFA的含量進而在一定程度上降低動物的免疫能力,這可能是冬眠動物在冬眠期間免疫功能受到抑制[23-24]的原因之一。
綜上所述,達烏爾黃鼠在不同的生理階段其體內與多不飽和脂肪酸合成過程相關的基因出現差異表達,延長酶系列的羥酰基輔酶A脫氫酶與烯酰輔酶A還原酶基因在冬眠期表達最高,去飽和酶系列的Δ-5脫氫酶和Δ-6脫氫酶在育肥初期表達最高。動物對體內PUFA合成過程的脂肪酸鏈的延長和去飽和作用存在著基因表達的調控,這可能與動物在不同時期需要PUFA發揮其生物學作用的強弱相關,具體的作用機制還需進一步研究。
[ 1 ]CALDER P C. Fatty acids, dietary lipids and lymphocyte functions[J]. Biochem Soc Trans, 1995,23:302-309.
[ 2 ]SHLOMO Y, SHARON R, RALPH C, et al. The role of polyunsaturated fatty acids in restoring the aging neuronal membrane[J]. Neurobiol Aging, 2002,23(5):843-853.
[ 3 ]蘆靈軍,陳曉理.ω-3 多不飽和脂肪酸與炎癥反應[J]. 國外醫學:外科學分冊, 2002, 29(6):340-343.
[ 4 ]李秋榮,馬健,施謙,等. 二十碳五烯酸影響T細胞膜脂肪微區域中IL-2受體的分布[J]. 營養學報, 2004,11(6):324-328.
[ 5 ]王新穎,黎介濤.ω-3多不飽和脂肪酸影響炎癥和免疫功能的基礎研究[J]. 腸外與腸內營養, 2007,14 (1):54-58.
[ 6 ]黃艷玲,羅旭剛. 飼糧脂肪酸對脂肪代謝酶有關基因表達的影響[J]. 動物營養報, 2005,17(4):1-5.
[ 7 ]RINALDI B, DIPIERRO P, VITELLI M R, et al. Effects of docosahexaenoic acid on calcium pathway in adult rat cardiomyocytes[J]. Life Sci, 2002,71(9):993-1004.
[ 8 ]黃升謀.ω-3系列多不飽和脂肪酸生理功能及其機理[J]. 襄樊學院學報, 2010,31(5):16-19.
[ 9 ]高宗穎,蘇麗,袁麗,等. 多不飽和脂肪酸的應用[J]. 農產品加工業, 2011(2):39-41.
[10]NAKAMURA M T, NARA T Y. Structure, function, and dietary regulation of delta6, delta5, and delta 9 desaturases[J]. Annu Rev Nutr, 2004,24:345-376.
[11]ALLMAN D W, GIBSON D M. Fatty acid synthesis during early linoleic acid deficiency in the mouse[J]. J Lipid Res, 1965,79:51-62.
[12]顏新春,汪以真,許梓榮. 日糧多不飽和脂肪酸對動物基因表達和脂肪細胞分化調解[J]. 飼料研究, 2001,2:4-5.
[13]COOK M E, MILLER C C, PARK Y, et al. Immune modulation by altered nutrient metabolism: nutritional control of immuneinduced growth depression[J]. Poult Sci, 1993,72:1301-1305.
[14]MICHAL J B, CHEW B P, SHULTZ T D, et al. Interaction of conjugated dienoic derivatives of linoleic acid withβ-carotene on cellular host defense[J]. FASEB J, 1992,6(2):1102.
[15]FOWLER K H, CHAPKIN R S, MCMURRAY D N. Effects of purified dietaryn-3 ethyl esters on murine T lymphocyte function[J]. J Immunol, 1993,151(10):5186-5197.
[16]LOMBARDI V R M, CAGIAO A, FERNANDEZ-NOVOA L, et al. Short term food supplementation effects of a fish derived extract on the immunological status of pregnant rats and their sucking pups[J]. Nutr Res, 2001,21(11):1425-1434.
[17]孫翔宇,高貴田,段愛莉,等. 多不飽和脂肪酸的研究進展[J]. 食品工業科技, 2012,33(7):418-423.
[18]HUT R A, BARNES B M, DAAN S. Body temperature patterns before, during, and after semi-natural hibernation in the European ground squirrel[J]. J Comp Physiol B, 2002,172:47- 58.
[19]HELDMAIER G, ORTMANN S, ELVERT R. Natural hypometabolism during hibernation and daily torpor in mammals[J]. Resp Physiol Neurobi, 2004,141(3):317-329.
[20]DESAGER J P, DRICOT J, HARVENGT C. Hypotriglyceridemic action of omega-3 fatty acids in healthy subjects does not occur by enhanced lipoprotein lipase and hepatic lipase activities[J]. Res Commun Chem Pathol Pharmacol,1989,65(2):269.
[21]ANDO M, SANAKA T, NIHEI H. Eicosapentanoic acid reduces plasma levels of remnant lipoproteins and prevents in vivo peroxidation of LDL in dialysis patients[J]. J Am Soc Nephrol, 1999,10(10):2177-2184.
[22]呂錚,宋士一,楊明,等. 達烏爾黃鼠入眠準備期的體溫、代謝率及能量特征[J]. 獸類學報, 2014,34(4):1-11.
[23]MATSUZAWA H, SHIMIZU K, OKADA K, et al. Analysis of targetorgans for the latency of murine cytomegalovirus DNA using specific pathogen free and germfree mice[J]. Arch Virol, 1995,140:853-864.
[24]蔡益鵬. 冬眠與免疫[J]. 生物學通報, 2002,37(6):19-22.
Gene expressions associated with poly unsaturated fatty acids synthetic in white adipose tissue in Daurian ground squirrel (Spermophilus dauricus)
MENLiyuan1,LIUShuai1,YUChao1,SONGShiyi1,PENGXia2,YANGMing1
(1. College of Chemistry and Life Science, Shenyang Normal University, Shenyang 110034, China;2. Experiment Centre, Shenyang Normal University, Shenyang 110034, China)
Polyunsaturated fatty acids play an important role in regulating the structure and function of cell membrane, immunity, lipid metabolism in mammalian. For researching the polyunsaturated fatty acids systhesis regulated by gene expression in hibernators, by means of the next transcriptome sequencing technology, we sequenced the transcriptom in the white adipose tissue of the Daurian ground squirrel (Spermophilus dauricus), and then got differentially expressed genes involved in hydroxyacyl-CoA reductase, enoyl-CoA dehydrogenase, delta-5 desaturase and delta-6 desaturase at four physiological stage: Initial-Fattening, Rapid-Fattening, Finished-Fattening and Hibernation. The results show that hydroxyacyl-CoA reductase up-regulate in hibernation and is different from Initial-Fattening significantly; The expression of enoyl-CoA dehydrogenase in Hibernation is also higher than Initial-Fattening and Rapid-Fattening significantly; delta-5 desaturase and delta-6 desaturase present a higher level in Initial-Fattening. These indicate that polyunsaturated fatty acids systhesis is regulated by gene expression in the Daurian ground squirrel. The cell membrane fluidity and immune ability may be adjusted in different physiological period by this way.
Daurian ground squirrel (Spermophilus dauricus); Polyunsaturated fatty acids; gene expression
2015-03-18。
國家自然科學基金資助項目(30770337,31170380)。
門麗媛(1990-),女,遼寧大連人,沈陽師范大學碩士研究生; 通信作者: 楊 明(1966-),女,遼寧昌圖人,沈陽師范大學教授,博士,碩士研究生導師。
1673-5862(2015)03-0319-05
Q958.1
A
10.3969/ j.issn.1673-5862.2015.03.001

